Органическая химия.
Тема 3.2. «Углеводороды»
Предельные углеводороды. Метан.
1. Гомологический ряд алканов.Метан. Строение, номенклатура,физические свойства.
2. Химические свойства,
3. Нахождение в природе, получение, применение.
4. Роль в организме и использование в медицине алканов и их галоген производных.
5. Понятие о циклоалканах, их строении и свойствах.
1. Изучение органической химии всегда начинается с предельных углеводородов.
 Метан(СН4) - простейший представитель предельных углеводородов.Гомологи метана называются алканами,атакже предельными и насыщенными углеводородами, потому что все связи в них одинарные (σ-связи) и к атомам углерода присоединено максимально возможное число других атомов водорода. Общая формула алканов – СnH2n+2
Метан(СН4) - простейший представитель предельных углеводородов.Гомологи метана называются алканами,атакже предельными и насыщенными углеводородами, потому что все связи в них одинарные (σ-связи) и к атомам углерода присоединено максимально возможное число других атомов водорода. Общая формула алканов – СnH2n+2
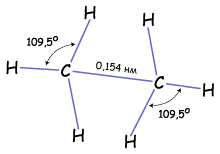
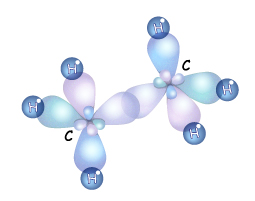
 Строение. Молекула метана имеет форму тетраэдра, и все четыре связи углерода с атомами водорода равноценны. В 3.1. мы рассматривали понятие гибридизации и ее виды. Если атом углерода находится в состоянии sp3 – гибридизации, то все четыре гибридные орбитали могут перекрываться с орбиталями атомов водорода на прямых, связывающих центры атомауглерода ичетырех атомов водорода. Между ними образуют прочные
Строение. Молекула метана имеет форму тетраэдра, и все четыре связи углерода с атомами водорода равноценны. В 3.1. мы рассматривали понятие гибридизации и ее виды. Если атом углерода находится в состоянии sp3 – гибридизации, то все четыре гибридные орбитали могут перекрываться с орбиталями атомов водорода на прямых, связывающих центры атомауглерода ичетырех атомов водорода. Между ними образуют прочные  -связиЕсли хотя бы одна из гибридных орбиталей углерода образует связь не с водородом, а с гибридной орбиталью другого атома углерода, то получается молекула очень похожая по строению на метан, но немного длиннее. Таким образом, может соединиться практически любое число атомов углерода, находящихся в sp3-гибридном состоянии. Углы между связями 109о, поэтому в пространстве молекулы будут принимать зигзагообразную форму или другую форму, т.к. вокруг одинарной σ-связи возможно свободное вращение.
-связиЕсли хотя бы одна из гибридных орбиталей углерода образует связь не с водородом, а с гибридной орбиталью другого атома углерода, то получается молекула очень похожая по строению на метан, но немного длиннее. Таким образом, может соединиться практически любое число атомов углерода, находящихся в sp3-гибридном состоянии. Углы между связями 109о, поэтому в пространстве молекулы будут принимать зигзагообразную форму или другую форму, т.к. вокруг одинарной σ-связи возможно свободное вращение.
Но при изображении структурных формул это не учитывают, а показывают только порядок соединения атомов углерода: СН3-СН2-СН2-СН3. Каждый из последующих углеводородов гомологического ряда будет отличаться от предыдущего на группу СН2, которую называют гомологической разностью. Связи в молекуле метана прочные, ковалентные,малополярные. И, поскольку смещение направлено от вершин тетраэдра в центр пирамиды, равнодействующая будет равна 0. А это значит, что молекула метана неполярна, несмотря на полярность связей С-Н. Аналогично обстоит дело и с молекулами других алканов. Кристаллическая решетка алканов молекулярная и между молекулами очень слабое взаимодействие.
Номенклатура алканов. Названия алканов приведены в таблице в лекции №1. Если надо подчеркнуть неразветвленный характер цепи, то перед названием алкана ставят букву n.Боковые цепи (углеводородные радикалы) называют как алканы, заменяя суффикс –ан, на -ил. Их перечисляют в алфавитном порядке, множительные приставки при этом не учитывают. Между цифрами ставят запятую, между цифрой и словом – дефис.
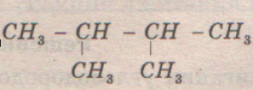
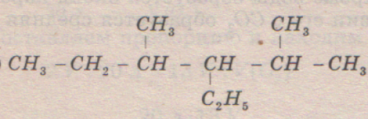 2,3-диметилбутан 2,4-диметил-3-этилгексан
2,3-диметилбутан 2,4-диметил-3-этилгексан
Физические свойства. Метан – это газ, без цвета и запаха, температура кипения (-168 С0), почти в 2 раза легче воздуха. В воде не растворим, но растворим в органических растворителях. У всех алканов такие же физические свойства, за исключением температуры кипения и плавления. Рассмотрим таблицу, в которой приведены формулы и температуры кипения и плавления алканов.
| формула | СН4 | С2Н6 | С3Н8 | С4Н10 | С5Н12 | С6Н14 | С7Н16 | С8Н18 | С9Н20 | С10Н22 | С16Н34 | С17Н36 |
| плавление кипение | -182 -162 | -183 -89 | -187 -42 | -138 -0,5 | -130 +36 | -95 +69 | -91 +98 | -57 +126 | -54 +151 | -30 +174 |
По данным таблицы видно, что с увеличением молекулярной массы возрастают температуры кипения и плавления. Т.е. при обычных условиях первые четыре гомолога (С1-С4) являются газами. Их достаточно легко можно превратить в жидкость при повышенном давлении. Нормальные алканы с С5-С17– это жидкости, с более длинной углеродной цепью (гептодекан) – твердые вещества, именно их часто называют парафинами. Иногда это название распространяют и на жидкие алканы. При одинаковом числе атомов углерода алканы с разветвленным строением имеют менее плотную упаковку и более низкие температуры кипения, чем нормальные алканы. В воде алканы не растворяются, но хорошо смешиваются друг с другом и с другими неполярными растворителями. Плотность у них меньше, чем у воды.
3. Химические свойства. В обычных условиях алканыинертны, они не взаимодействует с концентрированными кислотами и щелочами, не окисляются сильными окислителями (раствором марганцовки) при н.у. Русский химик М.И.Коновалов назвал их «химическими мертвецами».
1) Но они «не совсем мертвые». Как и все органические вещества алканыокисляются. Например, метан горит:СН4 + О2 → СО2 + Н2О (это полное или жесткое окисление, ∆Н = -890 кДж/моль, голубое пламя).
Но при мягких условиях (пониженная температура, присутствие катализаторов) продуктами окисления могут быть соответствующий спирт, альдегид или кислота: СН4 + О2→ СН3ОН(СН2О, НСООН).
С воздухом метан образует взрывоопасные смеси. Это является причиной взрывов в шахтах и жилых домах.
Гомологи метана тоже горят:С3Н8 + О2 → СО2 + Н2О (полное или жесткое окисление, чем больше молекулярная масса алкана, тем ниже температура пламени (у метана – бесцветное, у пропана - светящееся пламя). Для высшихалканов характерно неполное окисление, т.е. образование СО или сажи (коптящее пламя).Для гомологов метана тоже возможно мягкое (каталитическое) окисление, при этом образуются кислородсодержащие вещества с более длинной углеродной цепью: спирты, альдегиды, кислоты. Например, при каталитическом окислении бутана в промышленности получают уксусную кислоту.
Итак, при окислении алканов обычно образуется смесь кислородсодержащих органических соединений с разным числом атомов углерода. Конечными продуктами окисления являются вода и углекислый газ.
2)Как и все органические вещества метан при нагревании без доступа воздуха подвергается термическому разложению.СН4→С + Н2
СН4 + СН4 → СН3-СН3 + H2
СН3-СН3 → СН2=СН2 + H2
СН2=СН2 → СН≡СН + Н2
СH≡CН→ С + Н2
Или СН3-СН2- СН3 → СН3-СН=СН2 + H2→…→ С + Н2Эта реакция (дегидрирования) протекает при 400 С° в присутствии катализатора (Ptили Ni) и идет постепенно, много стадий.
При более высокой температуре (до 700 С°) начинается крекинг – реакции идущие с разрушением углеродного скелета.
СН3-СН2– СН2-СН2– СН2-СН3 → СН2=СН2 + СН3-СН2– СН2-СН3
Итак, при термическом разложении алканов обычно образуется смесь предельных и непредельных углеводородов с разным числом атомов углерода. Конечными продуктами разложения являются простые вещества водород и сажа (углерод аморфный).
3)Если осуществлять нагревание алканов в присутствии катализатора, то может происходить процесс изомеризации. Реакция изомеризации возможна если в цепи 4 и более атомов углерода.
Такой процесс в промышленности называют каталитическим крекингом.
СН3-СН2– СН2-СН2– СН2-СН3 →СН3-СН(СН3)– СН(СН3)–СН3
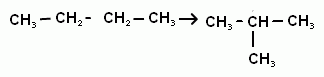
4) Прочные химические связи в алканах не склонны к гетеролитическому разрыву, но способны расщепляться гомолитически под действием активных свободных радикалов. Поэтому для алканов характерны реакции радикального замещения, в которых атомы водорода замещаются на другие атомы или группы атомов. Обозначаются реакции этого типа символом SR. По этому механизму легче всего происходит замещение у третичных атомов углерода, затем у вторичных и первичных. Но т.к. первичных атомов в молекуле больше, и они более доступны для атаки, то обычно одновременно проходят несколько реакций. Галогены (фтор, хлор, бром и иод) взаимодействуют с метаном (и его гомологами тоже) при облучении ультрафиолетовым светом или при высокой температуре (400-450 С0).
Общая схема: СН4 → СН3Сl → СН2Сl2 → СНСl3 → ССl4, т.е. атомы водорода в молекуле метана постепенно замещаются на атомы хлора, образуется смесь хлорпроизводных метана.
Уравнение первой стадии: СН4+ Сl2 →HCl+ СН3Сl. Образующийся хлорметан СН3Сl подвергается дальнейшему хлорированию аналогичным образом. Образуется дихлорметан (СН2Сl2), трихлорметан (СНСl3), и, наконец, тетрахлорметан (ССl4).
Т.е. уравнение 2 стадии: СН3Сl+ Сl2 →HCl+ СН2Сl2
Для 3 стадии: СН2Сl2+ Сl2 →HCl+ СНСl3
Для 4 стадии: СНСl3+ Сl2 →HCl+ ССl4
Процесс можно изобразить и такой схемой:
СН4 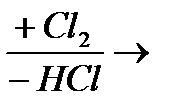 СН3Сl
СН3Сl 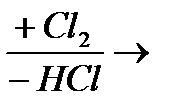 СН2Сl2
СН2Сl2 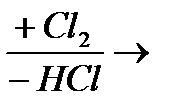 СНСl3
СНСl3 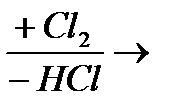 ССl4
ССl4
Эта реакция протекает по цепному механизму и может быть описана следующими процессами:
1) Инициирование или образование цепи, т.е. образование свободного радикала, начинающего цепь. Происходит под действием ультрафиолета или высокой температуры (связь в галогенах рвется легче, чем в метане) Сl2→ 2Cl.
2) Рост цепи Cl. + СН4 → HCl + CH3.иCH3. + Сl2 → СН3Сl + Cl. и т.д. Свободный радикал взаимодействует с молекулой, и образуется новый свободный радикал. Стадии 1) и 2) повторяются, пока не накопиться много свободных радикалов и не станет преобладать стадия 3) Обрыв цепи: Cl. + Cl. → Сl2 илиCH3. +CH3. → CH3-CH3илиCH3. + Cl. → СН3Сl
Реакция протекает, пока не закончится хлор, продуктами реакции будет смесь хлорпроизводных метана. А если хлора будет в избытке – то пока все атомы водорода в метане не заместятся на атомы хлора. Обратите внимание: в реакциях замещения обязательно образуется побочный продукт, в реакции хлорирования – это хлороводород.
Галогенирование пропана будет проходить аналогично, только водородов в молекуле больше.Реакция замещения не избирательна, т.е. замещаться может любой водород, это характерно для реакций идущих с образованием свободных радикалов:
СН3 –СН2- CH3 + Сl2 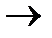 HCl+ СН3 –СН2- CH2Сlили …
HCl+ СН3 –СН2- CH2Сlили … 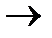 HCl+ СН3 –ССlН2–CH3
HCl+ СН3 –ССlН2–CH3
Нитрованиеалканов – тоже реакция свободнорадикальногозамещения, т.е. тоже химическое свойство, только реакция с другим реагентом. Азотная кислота может быть представлена как ОН−NO2, где после разрыва связи по гомолитическому механизму образуется свободный радикал - нитрогруппа. Реакция протекает с разбавленной кислотой при повышенной температуре и давлении. Ее иногда называют реакцией Коновалова.
СН3-СН3 + НNO3 →СН3-СН2 NO2+Н2О
Нахождение алканов в природе: Метан образуется при гниении органических веществ без доступа воздуха: в болотах, в шахтах, заброшенных колодцах и т.д. Составляет основную часть природного газа (до 98%)и попутного газа (до 80%). Другие газообразные алканы тоже входят в состав природного газа и попутного газа. Попутным называют газ, который растворен в нефти и добывается вместе с ней. В состав нефтив основном входят жидкие алканы. Кроме алканов там могут быть различные органические вещества, которые и дают нефти запах и цвет. Твердые алканы сопутствуют нефти и называют их горным воском или озокеритом.
Получение. Особой необходимости в этом нет, т.к. алканы широко распространены в природе. Иногда для получения метана используют реакцию гниения органических остатков (биотопливо).
В лаборатории метан получают при термическом разложении ацетата натрия
СН3СООNa→ СН4+Na2СО3
Возможен также синтез из простых веществ:
С + Н2→ СН4
Или гидрированием алкенов:
СН2=СН2 +Н2→ СН3-СН3
Алканы с четным числом атомов углерода можно получить в лаборатории ракцией Вюрца (принагревании в присутствии металлического натрия):
СН3 –СН2- CH2Сl+ Na 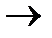 СН3 –СН2- CH2 - СН2 –СН2- CH3+NaCl
СН3 –СН2- CH2 - СН2 –СН2- CH3+NaCl