Дисциплина «БИОФИЗИКА»

Лекция № 6. «Изучение электрической активности одиночных ионных каналов»
Основные вопросы:
1. Методы обнаружения одиночных ионных каналов.
1.1. Метод БЛМ.
1.2. Пэтч-клэмп клеточных мембран.
2. Получаемая информация.
2.1. Проводимость ионного канала.
2.2. Кинетика работы ионного канала.
2.3. В–а характеристика канала.
3. Типы структур ионных каналов.
4. Заключение.
1. Методы обнаружения одиночных ионных каналов
Ионные каналы позволяют клетке регулировать проницаемость мембран для тех или других ионов, а это лежит в основе возбудимости клеток и ионной регуляции внутриклеточных процессов
Основной метод изучения работы ионных каналов – это измерение ионных токов через мембрану при определенном мембранном потенциале и известных концентрациях ионов по обе стороны мембраны. Методика регистрации ионных токов достаточно хорошо разработана и при наличии соответствующих измерительных приборов легко осуществима.
Однако при изучении интегральных ионных токов через открытые в мембране калиевые или натриевые каналы, на фоне низкой интегральной проводимости мембраны, создаваемой многими открытыми каналами, дискретные, малые изменения, проводимости одиночного канала неразличимы. В этом случае обнаружить каналы в мембране удается только по косвенным признакам, например при переменном электрическом напряжении на мембране. Подобные эксперименты проводились на модельных фосфолипидных мембранах. Для того чтобы выяснить, каков механизм переноса электрического заряда через мембрану: с помощью подвижных переносчиков или через каналы изучалась зависимость мембранной электропроводности от концентрации электролита в окружающей среде.

| 
|
| Рис.1. Проводимость мембраны, в которой присутствуют ионные каналы (2) или переносчики ионов (1), на постоянном токе. | Рис.2. Проводимость мембраны, в которой присутствуют ионные каналы (2) или переносчики ионов (1), на переменном токе. |
При постоянном электрическом напряжении проводимость мембраны в зависимости от концентрации электролита, как в случае переносчиков, так и при наличии каналов, имеет вид немонотонный кривой с насыщением. Насыщение обусловлено либо насыщением каналов переносимым ионом при высокой концентрации электролита, либо отсутствием свободной формы переносчика, насыщением переносчиков, в мембране (рис.1, кривые 1 и 2).
Однако если электрическая проводимость мембраны появляется в результате одновременной работы многих каналов, то при использовании переменного электрического напряжения с ростом концентрации электролита наблюдается её снижение и даже блокирование. Это указывает на уменьшение или полную непроводимость каждого из многих открытых единичных каналов, Причина в том, что при высокой концентрации электролита выход иона из канала затруднен. В этих условиях при подаче на мембрану переменного напряжения ион просто не успевает покидать канал, что приводит к блокированию трансмембранного ионного тока (рис.2, кривая 2). В то время как заряженные комплексы, например К+–валиномицин, при высокой концентрации электролита и любой частоте переменного электрического напряжения могут двигаться внутри мембраны в любом направлении, то есть зависимость тока от концентрации по-прежнему имеет вид кривой с насыщением.
Прямое обнаружение функционирующих одиночных ионных каналов в мембране по их электрической активности стало возможным при разрешении следующих методических проблем.
Во-первых, для непосредственного обнаружения ионных каналов необходим приборы, с помощью которых можно зарегистрировать малые токи, протекающие через одиночные ионные каналы, то есть токи порядка нескольких пикоА 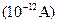 при частоте не менее 1 кГц. При этом подаваемый на мембрану электрический потенциал, обеспечивающий ионный ток в канале, должен не искажаться в результате перераспределения подаваемого на мембрану напряжения между элементами электроизмерительной схемы, возникающего при шунтировании мембраны в момент открытия ионного канала. С этой целью используются так называемые операционные усилители с обратной связью. Это специальный управляющий потенциалом источник напряжения, который поддерживает на мембране постоянную заданную разность электрических потенциалов.
при частоте не менее 1 кГц. При этом подаваемый на мембрану электрический потенциал, обеспечивающий ионный ток в канале, должен не искажаться в результате перераспределения подаваемого на мембрану напряжения между элементами электроизмерительной схемы, возникающего при шунтировании мембраны в момент открытия ионного канала. С этой целью используются так называемые операционные усилители с обратной связью. Это специальный управляющий потенциалом источник напряжения, который поддерживает на мембране постоянную заданную разность электрических потенциалов.
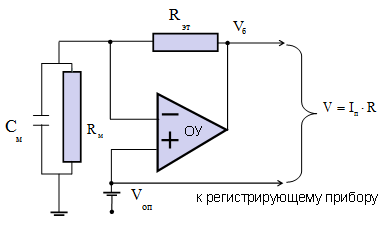
|
Рис. 3. Эквивалентная электрическая схема фиксации электрического потенциала на мембране на заданном уровне:  – эталонное сопротивление; – эталонное сопротивление; 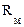 и и 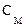 – соответственно электрическое сопротивление и электрическая емкость мембраны; – соответственно электрическое сопротивление и электрическая емкость мембраны; 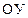 – дифференциальный усилитель с высоким коэффициентом усиления, на вход которого подается разность потенциалов, между измерительным электродом и электродом сравнения. – дифференциальный усилитель с высоким коэффициентом усиления, на вход которого подается разность потенциалов, между измерительным электродом и электродом сравнения.  – командный потенциал. – командный потенциал.
|
Принципиальная электрическая схема измерения токов в режиме фиксации напряжения представлена на рис. 3.
Метод фиксации потенциала на клеточной мембране первоначально использовался в работе с мембранами электровозбудимых клеток (гигантский аксон кальмара, гигантский нейрон улитки, мембраны харовых водорослей и др.), а затем стал применяться и при изучении искусственных мембран, преимущественно плоских бислойных липидных мембран (БЛМ), в которые встраивались каналообразующие соединения и комплексы.
1.1. Метод БЛМ
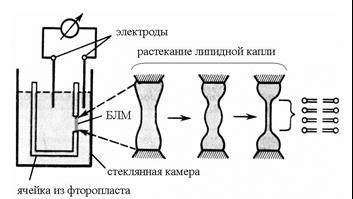
При изучении электрической активности ионных каналов очень удобно проводить опыты на модельных фосфолипидных мембранах. Как правило, в этих экспериментах используются так называемые плоские бислойные липидные мембраны (БЛМ). Используя методику фиксации электрического напряжения на БЛМ, можно регистрировать не только интегральный ионный ток, но и токи, проходящие через единичный канал. Дело в том, что в модельную мембрану можно встроить малое количество каналов, при котором, благодаря их асинхронному открыванию и закрытию, можно регистрировать токи, протекающие через единичные ионные каналы. На рис. 4 представлена схема формирования таких мембран.
|

|
| Рис. 4. Схема формирования БЛМ из липидной капли. (вид капли в стадии истончения представлен справа). В область отверстия (диаметром не более 1,3 мм) в стаканчике, изготовленном из гидрофобного материала (фторопласт, полиэтилен), впрыскивают каплю раствора фосфолипидов, как правило, в н-декане или гептане. Однако не исключено использование других растворителей. |
Формирование БЛМ начинается с истончения толстой липидной капли. Главными силами, определяющими поведение капли, являются межфазное (поверхностное) натяжение, 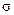 , и ван-дер-ваальсовы силы притяжения водных фаз по обе стороны от капли, сжимающие ее в поперечном направлении (расклинивающее давление).
, и ван-дер-ваальсовы силы притяжения водных фаз по обе стороны от капли, сжимающие ее в поперечном направлении (расклинивающее давление).
За процессом формирования тонкой, бислойной, плёнки можно наблюдать визуально в отражённом свете. Пока пленка толстая она выглядит, как обычное макротело. При толщине пленки, соизмеримой с длиной волны падающего света, начинается интерференция лучей, отражаемых от её передней и задней поверхностей. При использовании белого света на поверхности плёнки появляются цветные узоры. Такие пленки, содержащие линзоподобные утолщения, получили название цветных плёнок.
В отраженном свете бислойные липидные структуры выглядят черными на светлом фоне камеры, поэтому их называют «черными». Низкая отражающая способность черных пленок обусловлена тем, что отражаемые от передней и задней поверхностей пленки лучи находятся в противофазе и гасят друг друга.
Формирование черной пленки не означает полного завершения всех процессов превращения липидной фазы в бислойную мембрану (БЛМ). Параллельно с почернением пленки идут более длительные процессы растекания растворителя по стенке в области
По ряду физико-химических свойств бислойные липидные мембраны, приготовленные из природных фосфолипидов, близки к параметрам биологической мембраны (табл.1).
| Таблица 1. Сравнение биомембран и БЛМ по их физическим свойствам | ||
| Свойство | Биомембраны | БЛМ |
| Вид на снимке поперечного среза, получаемый с помощью электронного микроскопа | 3–х слойная структура | 3–х слойная структура |
| Толщина, нм | 6,0÷10 | 2,5÷8,0 |
| Межфазное натяжение, н.см | (0,03÷3,9) 10–5 | 0,2÷6,0 |
| Электрическое сопротивление, Ом/см2 | 102÷105 | 106÷109 |
| Электрическая ёмкость, мкФ/см2 | 0,5÷1,3 | 0,2÷1,0 |
| Напряжение электрического пробоя, мВ | 150÷300 | |
| Показатель преломления | 1,6 | 1,56÷1,66 |
| Проницаемость для воды, мкм/с | 0,5÷400 | 31,7 |
| Энергия активации водной проницаемости, кДж/моль | 40,3 | 53,3 |
Ионная избирательность, 
| 1÷25 | 5,4÷9,0 |
В то же время искусственные липидные плёнки отличаются от биологической мембраны низкой электрической проводимостью, лишены метаболической активности и не обладают столь высокой ионной селективностью, как биологические мембраны.
Многие из этих свойств могут быть приданы искусственным мембранам путем введения в их состав разнообразных мембраноактивных соединений и отдельных функционально важных элементов биологических мембран. В присутствии таких модификаторов электрическая проводимость мембран обычно возрастает. Все это свидетельствует о том, что бислойная липидная структура играет роль естественной матрицы для многих молекулярных компонентов биологической мембраны и что липидный бислой в той или иной степени свойственен природным мембранам.
Широкий спектр применения различных электроизмерительных методов для изучения БЛМ, возможность изменять липидный состав БЛМ и состав внешней среды, наличие методики формирования БЛМ из отличающихся монослоев фосфолипидов с целью придания мембране ассиметричности, присущей биомембранам, - обеспечило этим модельным мембранным системам одно из центральных мест в изучение функциональной активности ионных каналов. Данный метод формирования мембран относительно прост в исполнении и позволяет встраивать в мембрану необходимое для хорошего разрешения количество каналов. Вклад, который внёс данный метод в современную науку о функционировании каналов, невозможно переоценить.
1.2. Пэтч–клэмп клеточных мембран
Поскольку при фиксации потенциала на мембране можно зарегистрировать ток, проходящий через единичный канал, только в том случае, когда электропроводность канала соизмерима с электропроводностью мембраны, то при работе с биологическими мембранами, в которых одновременно работает много каналов, наблюдать за работой единичного канала не удавалось вплоть до появления методики выделения участков нативной мембраны с малым числом каналов в них. В разрешение этой методической проблемы неоценимый вклад внесли западногерманские ученые Нейер и Сакман, которые в 1976 году предложили метод обнаружения каналов в биомембранах, получивший название «пэтч–клэмп». Идея метода состояла в создании методики, позволяющей максимально уменьшить площадь изучаемого участка мембраны (рис. 5). Это существенно увеличивало соотношение «полезный сигнал–шум» и позволяло зарегистрировать ток, протекающий через один ионный канал. Окончательную завершенность метод получил в 1981 году, когда были решены проблема создания плотного контакта между небольшим участком клеточной мембраны и поверхностью регистрирующего сигнал электрода (в противном случае сигнал шунтируется на землю) и проблема анализа большого массива данных с помощью пакета программ ЭВМ.
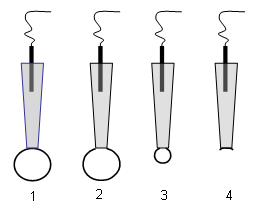
| Рис. 5. Различные конфигурации методики фиксации биологической мембраны, используемые при изучении электрической активности клеток. |
В конфигурации 1(“cell attach”) к поверхности клетки подводится стеклянная пипетка с оплавленными краями, диаметром 0,5-1 ммк. Пипетка заполняется концентрированным раствором хлорида калия и соединена с усилителем тока. К внутренней части пипетки прикладывается отрицательное давление. Между поверхностью клетки и краями кончика пипетки образуется плотный контакт, с сопротивлением утечки 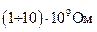 , или (1¸10) гигаОм. Конфигурация 1 позволяет исследовать нативную клетку, не разрушая её, однако она недостаточно информативна, так как не позволяет варьировать вещества, подаваемые к клеточной мембране.
, или (1¸10) гигаОм. Конфигурация 1 позволяет исследовать нативную клетку, не разрушая её, однако она недостаточно информативна, так как не позволяет варьировать вещества, подаваемые к клеточной мембране.
После разрушения участка мембраны под пипеткой можно регистрировать токи от всей клетки, как с микроэлектродами (конфигурация 2 “whole cell recording”). В этом случае можно регистрировать токи от клеток очень малых размеров (5-10 ммк).
При плавном отведении пипетки от клетки в конфигурации 2 образуется перетяжка, а затем маленькая везикула, содержащая всего несколько каналов (конфигурация 3). В данной конфигурации можно изучать работу одиночных каналов при смене фармакологических веществ у наружной части мембраны. Кроме того, в данной конфигурации система имеет хорошую устойчивость к вибрациям.
Наконец, если в конфигурации 1 резко отвести пипетку от клетки, то на кончике пипетки образуется маленький фрагмент мембраны с её внутренней частью, обращенной наружу (Конфигурация 4 “inside out”). Оторванный от клетки фрагмент мембраны может содержать всего один или несколько ионных каналов. Конфигурация 4 позволяет подавать вещества к внутренней части мембраны и регистрировать работу отдельных каналов, её характеризует высокая устойчивость к вибрациям.
Таким образом, метод «рэтч-клэмп» позволяет исследовать 1) электрическую активность отдельной клетки малых размеров, 2) регистрировать работу отдельных каналов, 3) исследовать действие фармакологических веществ при их добавлении в окружающую среду, как с внутренней, так и с наружной стороны мембраны.
2. Информация, которую можно получить при изучении электрической активности одиночных ионных каналов
2.1. Электропроводность одиночного ионного канала
Функционирование каналов проявляется в виде дискретных флуктуаций тока, характерной прямоугольной формы (рис.6,7).
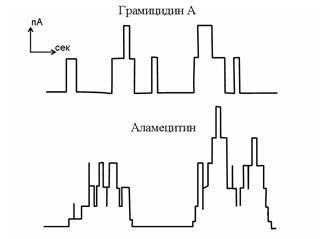
| Рис. 6. Одиночные ионные каналы, формируемые в искусственных липидных мембранах (БЛМ) пептидными антибиотиками. Схематическое изображение записи тока при фиксированном напряжении. |
На рис. 7 приводится пример типичных записей флуктуаций токов, возникающих в отрицательно заряженных БЛМ в присутствии поликатионного пептидного антибиотика полимиксина В.

| Рис. 7. Типичные флуктуации тока, индуцируемые пептидным антибиотиком полимиксином В в отрицательно заряженных липидных мембранах и гистограмма их проводимостей. Напряжение 70 мВ. |
Пропускная способность (проводимость) каналов оценивается в пико Сименс (пико = 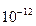 ). Сименс – величина обратная Ом. Проводимость одиночных каналов составляет, как правило, десятки пико
). Сименс – величина обратная Ом. Проводимость одиночных каналов составляет, как правило, десятки пико 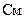 , редко – единицы или сотни пико
, редко – единицы или сотни пико  . Проводимость канала легко рассчитать, разделив ток канала на величину приложенного напряжения.
. Проводимость канала легко рассчитать, разделив ток канала на величину приложенного напряжения.
Для одного сорта каналов проводимость – величина постоянная. Однако, построив гистограмму проводимостей среди них, как правило, можно выделить минимальный импульс и импульсы, кратные минимальному импульсу. Появление импульсов тока, кратных минимальному импульсу, по-видимому, связано с одновременной работой нескольких каналов.
Возможна также ситуация, когда один тип каналов имеет несколько уровней проводимости, что обусловлено изменением конформационной структуры канала при вхождении в него ионов. Примером такого канала является пептидный антибиотик аламецитин (рис.6).
Уникальным свойством каналов является их селективностьь, то есть способность отличать определенный вид ионов, к транспорту которого они приспособлены, от всех других ионов и веществ. При этом в мембране может существовать несколько типов каналов, обладающих одинаковой селективностью, но имеющих разную проводимость. Например, в сердечной мышце есть калиевые каналы, имеющие проводимость около 10, 30, 60 и 110 пСм. Каждый из этих каналов выполняет различную физиологическую функцию в работе сердца.
2.2. Размер эффективного сечения канала
Используя гистограмму проводимостей можно рассчитать значение средней величины проводимости канала и, допуская, что канал имеет цилиндрическую форму, с помощью нехитрых вычислений оценить диаметр канала.
Полагая, что между проницаемостью мембраны и ее проводимостью в симметричном ионном окружении существует такая же зависимость как в мембране, можно написать:
 , где
, где 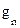 – проводимость поры в расчете на единицу площади ее просвета, а
– проводимость поры в расчете на единицу площади ее просвета, а 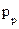 связана с коэффициентом диффузии иона в поре
связана с коэффициентом диффузии иона в поре  , коэффициентом распределения
, коэффициентом распределения 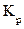 иона в системе: просвет поры – вода и длиной поры
иона в системе: просвет поры – вода и длиной поры 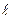 обычным соотношением
обычным соотношением
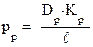 .
.
Используя дополнительные преобразования исходного уравнения, можно рассчитать диаметр канала.
В эксперименте измеряют либо проводимость мембраны в целом  , либо проводимость одиночного канала
, либо проводимость одиночного канала  . Соотношение между этими величинами очевидно:
. Соотношение между этими величинами очевидно:
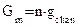 , где
, где 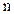 – число пор на единицу площади мембраны. Соотношение между
– число пор на единицу площади мембраны. Соотношение между  и
и 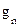 тоже достаточно ясное:
тоже достаточно ясное:
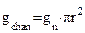 , где
, где  –площадь поры, а
–площадь поры, а  – ее радиус.
– ее радиус.
Окончательно выражение для проводимости ионного канала можно представить в виде:
 .
. 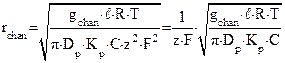
При длине канала  , коэффициенте диффузии в воде
, коэффициенте диффузии в воде 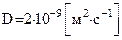 (эта цифра относится к ионам
(эта цифра относится к ионам 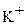 ,
,  ) и температуре
) и температуре 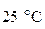 :
:
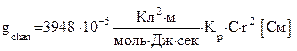 .
.
Оценить диаметр канала можно и несколько другим способом, если рассматривать канал как шунтирующее сопротивление, заполненное электролитом с удельной электропроводностью, равной удельной электропроводности электролита окружающей среды. Тогда электропроводность канала будет равна:
 , где k - удельная электропроводность электролита, которую можно рассчитать по формуле
, где k - удельная электропроводность электролита, которую можно рассчитать по формуле 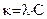 , используя табличное значение
, используя табличное значение 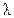 – электропроводность раствора одного грамм-эквивалента электролита, находящегося между двумя параллельными электродами площадью
– электропроводность раствора одного грамм-эквивалента электролита, находящегося между двумя параллельными электродами площадью 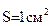 с расстоянием между ними в 1 см.
с расстоянием между ними в 1 см.
Таким образом, 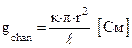 , следовательно
, следовательно 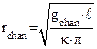 , где r – искомый радиус канала.
, где r – искомый радиус канала.
Очевидно, что оба способа оценки радиуса канала допустимы только к каналам, которым соответствуют большие амплитуды флуктуаций тока, позволяющие предположить, что канал заполнен электролитом.
Диаметр подобных больших ионных каналов по оценкам разных исследований составляет 0,5 - 0,7 нм.
2.3 Кинетика работы ионного канала
Другой важный параметр канала – кинетика его работы. Каналы открываются на времена порядка 1 – 100 мсек, иногда и на более длительное время (это зависит от природы изучаемого канала), измеряемое секундами, пропуская 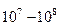 ионов в секунду. Канал открывается не всегда на одно и то же время. Закон распределения времён открытого состояния канала – экспонента, то есть канал открывается чаще на короткое время и реже – на длинное (рис. 8).
ионов в секунду. Канал открывается не всегда на одно и то же время. Закон распределения времён открытого состояния канала – экспонента, то есть канал открывается чаще на короткое время и реже – на длинное (рис. 8).
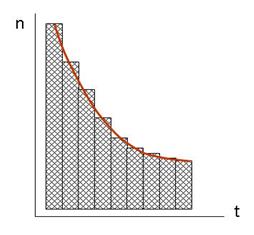
| Рис.8. Гистограмма времени нахождения каналов в открытом состоянии. |
Количественным параметром является среднее время открытого (или закрытого) состояния. Для его определения строятся временные гистограммы, в которых анализируется несколько сот срабатываний канала.
«Постоянная» спада получаемой экспоненты, 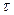 , характеризует среднее время открытого состояния ионного канала. При прочих равных условиях
, характеризует среднее время открытого состояния ионного канала. При прочих равных условиях 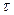 является постоянной (характеристической) величиной для данного типа каналов.
является постоянной (характеристической) величиной для данного типа каналов.
2.4.Вольт-амперная характеристика канала
Зависимость амплитуды ступенек тока от мембранного потенциала  (вольт–амперная характеристика) позволяет делать некоторые заключения о механизме проводимости каналов. В широких каналах эта характеристика линейна, что позволяет предположить, что в канале находится электролит и поэтому ток в канале описывается уравнением:
(вольт–амперная характеристика) позволяет делать некоторые заключения о механизме проводимости каналов. В широких каналах эта характеристика линейна, что позволяет предположить, что в канале находится электролит и поэтому ток в канале описывается уравнением: 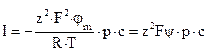 . В растворах разных ионов линейность вольт амперной характеристики такого канала сохраняется, но имеет различную крутизну (т.е. каналы имеют разную проводимость), что позволяет выявить ион, для которого канал избирательно проницаем (Рис. 9).
. В растворах разных ионов линейность вольт амперной характеристики такого канала сохраняется, но имеет различную крутизну (т.е. каналы имеют разную проводимость), что позволяет выявить ион, для которого канал избирательно проницаем (Рис. 9).
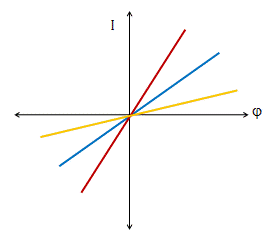
| Рис.9. Вольт-амперные характеристики широкого канала, получаемые в различных электролитах. |
В узких каналах вольт–амперная характеристика может быть нелинейной (эти случаи подробно рассматривались в предыдущей лекции). С учетом такого рода данных можно сделать ряд заключений о том, как устройство поры влияет на её ионную проводимость, а, следовательно, и на ионную проницаемость мембраны в целом.
3. Основные типы структур ионных каналов
Поскольку природные каналы в клеточных мембранах – белковые структуры, изучение их устройства осуществляется такими же методами, какими изучается структура белков: используется рентгеноструктурный анализ, ЯМР-спектроскопия высокого разрешения, компьютерное моделирование молекулярной динамики структуры. Однако изолирование, очистка, а главное, кристаллизация интегральных мембранных белков являются сложными, дорогостоящими процедурами и для воссоздания пространственной структуры белка требуются усилия многих ученых различной специализации. Не удивительно, что на сегодняшний день можно считать установленной пространственную структуру всего лишь двух каналов: водного и калиевого канала, выделенного из клеточной стенки E.coli. За открытие и воссоздание структуры этих каналов двое американских ученых, Питер Эгр и Родерик МакКиннон, в 2003 году удостоены Нобелевской премии по химии. При рассмотрении структуры ионных каналов можно выделить три основных типа каналов. Рассмотрим примеры некоторых из них.
3.1. Чисто белковые каналы
Чисто белковые каналы пронизывают мембрану, соединяя водные фазы на противоположных сторонах мембраны. В первую очередь это – каналы биологических мембран. Внутренняя поверхность такого канала выслана аминокислотными остатками молекулы белка, с которыми взаимодействуют диффундирующие ионы.

| Рис. 10. Строение белкового ионного канала (по Б. Хилле, 1981 г.) |
Биологически активные пептиды, размеры которых достаточны для того, чтобы перекрыть толщу мембраны, также формируют в мембране каналы, стенки которых покрыты аминокислотными остатками. Среди этих соединений наиболее изучены пептидный антибиотик аламецитин, меллитин, выделяемый из яда пчёл, и холерный токсин. Некоторые белки, попадая в мембрану, агрегируют, образуя группу из параллельно ориентированных друг другу, пронизывающих мембрану молекул. В центре этого агрегата располагается ионный канал (рис.11). Ассоциативно подобная структура напоминает бочонок и поэтому такую структуру канала называют бочкообразной.

|
| Рис. 11. Пора, образованная α-пороформирующим белком мелиттином и липидами (вид сбоку), изображена с использованием программы RasMol 2.6 (А) [154]. Структура гептамерной поры, образованной β-пороформирующимся белком α-гемо лизи ном S. aureus (вид сбоку) (Б). Указаны основные домены: stem – стеблевой, rim – краевой и cap –«кэп»-домен [85]. Схематичное изображение «бочкообразной» поры в липидном бислое, вид сверху (В) и сбоку (Г) и тороидальнойпоры, вид сверху (Д) и сбоку (Е). Мономеры белка изображены в виде темныхцилиндров (В, Д) [6] и в виде темных прямоугольников (Г, Е) [9]. Использован рисунок из обзора. «Пороформирующие белки и Адаптация организмов к условиям окружающей среды».Ж. И. Андреева-Ковалевская, А. С. Солонин, Е. В. Синева, В. И. Терновский. Успехи би о ло г ическ о йхимии, т. 48, 2008, с. 267–318 |
Благодаря агрегации некоторые пептиды, не имеющие размера, достаточного для того, чтобы соединить противоположные стороны мембраны, все же могут создавать каналы, которые можно отнести к чисто белковым каналам, так как их стенки выстланы аминокислотными остатками пептидных молекул. Примером такого канала служит канал, образуемый пептидным антибиотиком грамицидином А (рис.12). Грамицидин А является линейным полимером, состоящим из 15 L и D аминокислот с характерным чередованием  и
и 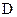 конфигурации: HCO-L-Val-Gly-L-Ala-D-Leu-L-Ala-D-Val-L-Val-D-Val-L-Trp-D-Leu-L-Trp-D-Leu-L-Trp-D-LeuL-Trp-NHCH2CH2OH.
конфигурации: HCO-L-Val-Gly-L-Ala-D-Leu-L-Ala-D-Val-L-Val-D-Val-L-Trp-D-Leu-L-Trp-D-Leu-L-Trp-D-LeuL-Trp-NHCH2CH2OH.
В липидном бислое молекула грамицидина формирует  спираль, то есть спираль, у которой на шаг приходится 6 аминокислотных остатков. При этом гидрофобные остатки располагаются на внешней стороне спирали, а гидрофильные остатки внутри (модель α-спирали по Урри, 1971 г.).
спираль, то есть спираль, у которой на шаг приходится 6 аминокислотных остатков. При этом гидрофобные остатки располагаются на внешней стороне спирали, а гидрофильные остатки внутри (модель α-спирали по Урри, 1971 г.). 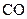 – радикалы
– радикалы  – аминокислот ориентированы вдоль спирали к
– аминокислот ориентированы вдоль спирали к 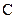 концу молекулы пептида, а соответствующие
концу молекулы пептида, а соответствующие 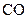 – группы
– группы 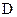 –аминокислотных остатков к
–аминокислотных остатков к 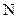 –концу. Длина такой спирали,
–концу. Длина такой спирали, 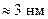 , примерно равна половине толщины мембраны, а просвет канала внутри спирали –
, примерно равна половине толщины мембраны, а просвет канала внутри спирали – 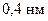 .
.

|
| Рис.12. Образование канала из двух молекул пептидного антибиотика грамицидина А. |
Две спирали, находящиеся в монослоях липидного бислоя мембран, могут соединиться вместе "голова к голове" (т.е. N-концами), образуя сквозной канал в мембране, как показано на рис. 12. Просуществовав некоторое время, канал распадается на две "полупоры" и молекулы грамицидина расходятся.
 .
.
Подтверждением такого механизма образования и распада грамицидиновых каналов является квадратичная зависимость числа каналов (а следовательно, и проводимости мембраны) от концентрации грамицидина А в мембране:
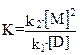 ,
,
где K – константа диссоциации канала, 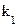 – константа скорости формирования каналов,
– константа скорости формирования каналов, 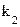 – константа скорости их распада, [M] и [D] – концентрации мономеров и димеров грамицидина в мембране, соответственно. Внутренний диаметр канала равен диаметру спирали,
– константа скорости их распада, [M] и [D] – концентрации мономеров и димеров грамицидина в мембране, соответственно. Внутренний диаметр канала равен диаметру спирали,  , достаточный для прохождения по нему ионов калия и цезия. При изучении зависимости тока в грамицидиновом канале от концентрации хлорида цезия наблюдается блокировка тока в канале при высокой концентрации соли, которая характерна для симметричного канала с двумя местами связывания.
, достаточный для прохождения по нему ионов калия и цезия. При изучении зависимости тока в грамицидиновом канале от концентрации хлорида цезия наблюдается блокировка тока в канале при высокой концентрации соли, которая характерна для симметричного канала с двумя местами связывания.
3.2. Чисто липидные каналы
Такие каналы, в первую очередь, обнаруживаются в модельных фосфолипидных мембранах (рис.13, 14).
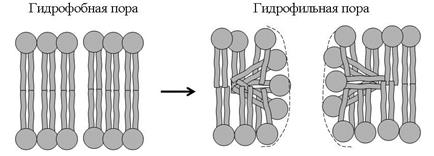
Липидные каналы принято делить на гидрофобную пору и гидрофильную пору. Полагают, что гидрофобная пора существует неопределенно долгое время в липидном бислое мембран (Рис. 13). Стенки гидрофобной поры состоят из углеводородных цепей фосфолипидных молекул, ионам энергетически невыгодно находиться в таком канале, то есть гидрофобная пора не пропускает ионов и, следовательно, её нельзя обнаружить по появлению токовых флуктуаций, обусловленных проходом ионов через канал. Под влиянием некоторых физико-химических факторов, таких как температура, электрическое поле,  ,
, 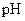 , адсорбция поликатионных молекул, может осуществиться переход из гидрофобной поры в гидрофильную пору, стенки которой выстланы уже не углеводородными радикалами, а полярными группами фосфолипидов, способными взаимодействовать с водой и понижать свободную энергию иона за счет ион-ионных и ион-дипольных взаимодействий. То есть, по сути дела гидрофобную пору можно рассматривать как зачаток гидрофильной поры.
, адсорбция поликатионных молекул, может осуществиться переход из гидрофобной поры в гидрофильную пору, стенки которой выстланы уже не углеводородными радикалами, а полярными группами фосфолипидов, способными взаимодействовать с водой и понижать свободную энергию иона за счет ион-ионных и ион-дипольных взаимодействий. То есть, по сути дела гидрофобную пору можно рассматривать как зачаток гидрофильной поры.
|
| Рис. 13. Чисто липидные поры в липидных мембранах. |
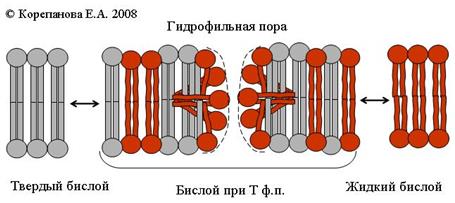
Чисто липидные ионные поры обнаруживаются в мембранах при обратимом фазовом переходе мембранных фосфолипидов из твёрдого состояния в состояние жидкого кристалла (рис.14). Размеры этих каналов, по-видимому, сильно варьируют и изменяются во времени, так как регистрируемые флуктуации тока гетерогенны по амплитуде и в большинстве случаев имеют сглаженный задний фронт, в отличие от белковых каналов, имеющих постоянную структуру.
|
| Рис. 14. Гипотетический механизм образования пор в фосфолипидной мембране при температуре их фазового перехода. |
Вероятной причиной широкой вариабельности амплитуд флуктуаций тока является отсутствие жесткой структуры у возникающих пор, в формировании которых принимают участие агрегаты молекул в твердом и жидко-кристаллическом состоянии.
Некоторые исследователи полагают, что липидные поры могут возникать при определенных условиях и в биологических мембранах.