В качестве примера подобных каналоформеров можно привести соединения из группы циклических полиеновых антибиотиков, обладающих противогрибковой активностью, нистатин, амфотерицин В, леворин и др. Особенностью химической структуры этих соединений является наличие у них большого участка углеводородной цепи с 6 двойными связями и параллельного ему участка с 6 гидроксильными группами (рис.15).
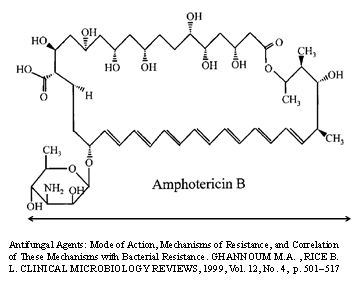
| Рис. 15. Химическая структура амфотерицина В. |
Полиеновые антибиотики имеют высокое сродство к стеринам. Полагают, что между стерином и олефиновой частью молекулы возникает сильное гидрофобное взаимодействие и образуются водородная связь, приводящие к формированию прочного стерин–полиеновый антибиотик комплекса в виде палочки. В мембране комплексы объединяются в агрегаты, в центре которых располагается сквозная пора. При этом гидроксильные группы полиеновых молекул обращены внутрь канала, облегчая движение по нему воды и ионов (рис.16).

|
| Рис. 16. Модель амфотерицин В–холестериновой полупоры. [Kidney International, Vol. 66, Supplement 91 (2004)]. |
Однако длина комплекса не всегда достаточна для того, чтобы перекрыть толщину биологической мембраны – и тогда агрегаты плавают в мембране в виде полупор. В этом случае для образования сквозной поры необходимо наличие полупоры на противоположной стороне мембраны, при встрече с которой формируется канал (Рис.17).
Несмотря на то, что амфотерицин В связывается и с другими стеринами, эффективность его связывания с эргостерином в 10 раз выше, чем с холестерином, присутствующим во всех клеточных мембранах человека. А так как мембрана грибов содержит преимущественно эргостерин, то полиеновые антибиотики оказались эффективными и малотоксичными для человека антигрибковыми препаратами. Интересно, что амфотерицин В может взаимодействовать с липидным бислоем и не содержащим стеринов (рис. 17). В этом случае способность антибиотика формировать в мембране каналы зависит от толщины образуемого бислоя, то есть от длины углеводородных цепей фосфолипидов.
 Рис.17. Взаимодействие амфотерицина В с липидным бислоем в зависимости от длины цепей фосфолипидов [Shigeru Matsuoka, Hiroki Ikeuchi, Yuichi Umegawa, Nobuaki Matsumori, MichioMurata.“Bioorganic and Medicinal Chemistry. V. 14, № 19, 2006, p.6608-6614]. a) DLPC или DMPC –дилаурил(
Рис.17. Взаимодействие амфотерицина В с липидным бислоем в зависимости от длины цепей фосфолипидов [Shigeru Matsuoka, Hiroki Ikeuchi, Yuichi Umegawa, Nobuaki Matsumori, MichioMurata.“Bioorganic and Medicinal Chemistry. V. 14, № 19, 2006, p.6608-6614]. a) DLPC или DMPC –дилаурил( ) или димиристоил ( ) или димиристоил ( )фосфатидилхолин. b) DSPC – дистеароил( )фосфатидилхолин. b) DSPC – дистеароил( ) фосфатидилхолин. ) фосфатидилхолин.
|
Если длина полупоры, образумой молекулой амфотерицина, близка к толщине бислоя, то образуется пора без участия холестерина. На рисунке 17 а, показано образование такой поры в бислое из диаурил( ) – или димиристоилфосфатидилхолина (
) – или димиристоилфосфатидилхолина ( ). В противном случае образование пор возможно только в том случае, если на противоположной стороне бислоя также присутствует амфотерицин В (рис. 17, b).
). В противном случае образование пор возможно только в том случае, если на противоположной стороне бислоя также присутствует амфотерицин В (рис. 17, b).
Биохимия и генетика устойчивости к полиенам изучена недостаточно, но имеющиеся данные в целом поддерживают гипотезу о снижении содержания эргостерола в цитоплазматической мембране устойчивых штаммов. Нистатин и амфотерицин В активны в отношении патогенных грибов, особенно грибов рода Candida. В, но не влияют на бактерии, не содержащие стеринов.
В природе широко распространены высоко активные соединения пептидной природы, так называемые поликатионные пептиды, которые также способны формировать в мембране ионные каналы смешанного типа. Поликатионные пептиды имеют сравнительно небольшую молекулярную массу, не более 30 кДа, и обязательно несут от 2 до 10 положительных зарядов. Полагают, что данные вещества являются факторами неспецифической защиты организма хозяина от чужеродных для него клеток. Поликатионные пептиды обнаружены у всех, обследованных на их наличие, представителей животного и растительного мира, а также в организме человека.
В большинстве случаев длина молекулы поликатионного пептида недостаточна для перекрывания толщины мембраны. На поверхности мембраны поликатионные пептиды взаимодействуют в первую очередь с анионными фосфолипидами, образуя молекулярные комплексы, из которых формируются стенки канала (рис. 11,Е). Широкий канал, образуемый при этом, называется тороидальной порой.
Химическая структура поликатионных пептидов весьма вариабельна, поэтому для понимания механизма действия каждого из этих соединений требуется изучение этого механизма в каждом конкретном случае.
4. Заключение. Для чего нужно изучать каналы.
4.1 Каналы и болезни.
Управляемые каналы биологических мембран "открываются" и "закрываются" под действием различных физиологически активных веществ. Ослабление или усиление ионного потока вызывает изменение мембранного потенциала, что, в свою очередь, сказывается на многих физиологических процессах: скорости проведения нервного импульса, мышечном тонусе, терморегуляции, кровообращении, чувствительности к боли и т.д.
После обнаружения водного канала появилось основание думать, что помимо ионных каналов в биологических мембранах, вероятно, существуют и другие управляемые каналы, приспособленные к транспортировке некоторых других жизненно важных молекул.
Сбои в работе ионных каналов приводят к различным недомоганиям. В настоящее время стало ясно, что ряд заболеваний человека связано с врожденными или приобретенными нарушениями структуры и функции ионных каналов. Нарушение работы ионных каналов наблюдается в различных тканях, но чаще поражается скелетная мускулатура или центральная нервная система.
Наследственная патология ионных каналов - это группа заболеваний, обусловленных мутациями генов, кодирующих ионные каналы. Выяснилось, что патология натриевых каналов скелетных мышц вызывает гиперкалемический периодический паралич, врожденную парамиотонию и миотонию, усиливающуюся приемом калия, злокачественную гипертермию и болезнь центрального стержня. Патология натриевых нейрональных каналов вызывает генерализованные фибрильные судороги. Патология нейрональных калиевых каналов может вызывать семейные неонатальные судороги и периодическую атаксию тип 1. Патология нейрональных кальциевых каналов может вызывать эпизодическую атаксию тип 2, семейную гемиплегическую мигрень и спиномозжечковую атаксию тип 6. Патология хлорных каналов скелетных мышц может вызывать миотонию Томсена и Беккера. Таким образом, наследственные нарушения ионных каналов, которые поражают нервную систему и сердце лежат в основе заболеваний, ряд из которых имеет четкие клинические признаки. Для подтверждения диагноза в большинстве случаев проводится ДНК-диагностика.
Неудивительно, что вещества, влияющие на функционирование каналов, давно используются как лекарственные препараты для лечения эпилепсии, аритмии, а также как средства для местного обезболивания.
В мире существует большая проблема, особенно ярко выраженная в развивающихся странах, так называемая злокачественная трёхдневная лихорадка (злокачественная трёхдневная малярия, молниеносная трёхдневная малярия, римская лихорадка), обусловленная заражением малярийным плазмодием Plasmodium falciparum. По данным ВОЗ от этой болезни ежегодно умирает 1 миллион человек. Несмотря на громадный ущерб, приносимый этой инфекцией, вакцина от нее до сих пор не найдена. Проблема в том, что малярийный плазмодий относится к внутриклеточным паразитам. Он развивается и размножается внутри эритроцитов. Мембрана эритроцита защищает плазмодий от антибиотиков и других антибактериальных препаратов. Однако для развития паразита необходимы питательные вещества, присутствующие в плазме крови, для которых мембрана эритроцита малопроницаема, а их содержание внутри эритроцита недостаточно для развития плазмодия. Для устранения этого препятствия паразит увеличивает проницаемость мембраны хозяина для небольших органических молекул, необходимых для его жизнедеятельности, встраивая в мембрану эритроцитов собственный канал. Свойства этого анион селективного канала (PSAC: plasmodial surface anion channel) необычны и не укладываются в обычно используемую модель молекулярного сита. Дело в том, что канал пропускает необходимые для питания плазмодия органические молекулы, как заряженные, так и незаряженные, и не пропускает очень маленький по сравнению с ними неорганический ион натрия. Полученные данные позволяют предположить, что канал содержит два прохода: один широкий для органических молекул и второй, узкий, не пропускающий ион натрия (по расчетам отношение проницаемостей  ). При этом в изотоническом растворе хлорида натрия проводимость канала для ионов
). При этом в изотоническом растворе хлорида натрия проводимость канала для ионов  также неожиданно маленькая < 3 пСм. Такой уровень исключения ионов из транспортного потока беспрецедентен для широких ионных каналов. Вероятно, он продиктован тем, что более высокая проницаемость для ионов натрия приведет к поглощению хлорида натрия, что в свою очередь приведет к осмотическому лизису инфицированных эритроцитов.
также неожиданно маленькая < 3 пСм. Такой уровень исключения ионов из транспортного потока беспрецедентен для широких ионных каналов. Вероятно, он продиктован тем, что более высокая проницаемость для ионов натрия приведет к поглощению хлорида натрия, что в свою очередь приведет к осмотическому лизису инфицированных эритроцитов.
Присутствие данного канала обнаруживается в геноме и других видов малярийного плазмодия. Очевидно, что PSAC, является селективной молекулярной мишенью в мембране эритроцитов для создания эффективных антималярийного препаратов, ингибирующих активность этого канала. И действительно в модельных опытах с эритроцитами, инфицированными плазмодием, найдены эффективные ингибиторы, в присутствии которых инфицированные эритроциты подвержены гемолизу при их помещении в среду, вызывающей гемолиз неинфицированных эритроцитов. В настоящее время ведутся поиски ингибиторов PSAC, которые можно бы было использовать при лечении людей.
4.2. Каналы как антибиотики
К каждому антибиотику микроорганизмы рано или поздно приобретают резистентность, используя различные хитроумные пути. Поэтому ученые вынуждены непрерывно вести весьма трудоемкие и дорогостоящие исследования, создавая все новые препараты, способные преодолевать или обходить известные факторы резистентности. И этим поискам не видно конца. В этой связи вещества, которые образуют каналы и способны буквально за секунды устранить жизненно важные градиенты вещества и ионов, необходимые для сохранения баланса веществ и ионов в клетке, чрезвычайно интересны как потенциальные антибактериальные и противоопухолевые препараты. Дело в том, что мишенью действия каналообразующих соединений являются структурные элементы клеточной мембраны, а не отдельные ферменты, поэтому при формировании устойчивости к ним должны произойти сложные генетические процессы, приводящие к изменению биосинтеза компонентов мембраны. На осуществление этих изменений требуется некоторое время, сравнимое со временем деления клетки (например, на деление E.Coli уходит около 20 минут). В то время как простой расчет показывает, что для устранения ионных градиентов на мембране клетки среднего размера достаточно секунды и одной поры нм диаметра. В связи с этим вероятность генетически приобретенной устойчивости к антибиотикам, формирующим каналы, относительно невелика, чем, по-видимому, и обусловлена низкая частота появления устойчивости к таким антибиотикам при их использовании в клинике.
Практически все организмы, включая микроорганизмы, синтезируют антимикробные пептиды (например, бактериоцины), которые подавляют или убивают отдельные виды микроорганизмов, обеспечивая тем самым определенное преимущество хозяину. Так, в случае перенаселенности каналоформеры используются микроорганизмами в процессах внутри- и межвидовой конкуренции в качестве антибиотиков. По своей структуре каналоформирующие белки и пептиды достаточно разнообразны, но их можно подразделить на два основных класса – α-спиральные и β-слойные. Причем, каналоформеры обоих классов синтезируются как про- так и эукариотами. Как правило, это – амфифильные молекулы, содержащие выраженный гидрофобный фрагмент, который непосредственно пронизывает мембрану. Зачастую полярная часть молекулы несёт положительно заряженные аминокислотные остатки от 2 до 11. Первый этап взаимодействия таких молекул с мембраной осуществляется за счет их электростатического взаимодействия с отрицательно заряженными головками группировками на поверхности мембраны или высоко аффинного связывания со своими рецепторами. Затем, многие из них проходят стадию олигомеризации, процесс, который сопровождается структурными перестройками всего комплекса, усиливающими его гидрофобность.
После этого происходит проникновение гидрофобной части олигомера в гидрофобную область мембраны и открывается пора. Образуемые поры можно разделить на два основных вида: бочкообразные, у которых внутренняя полость сформирована только белковыми мономерами, и тороидальные, у которых в выстилке проводящего пути дополнительно участвуют липидные молекулы мембраны (рис. 11). Внешний и внутренний диаметры сформированной подобным образом поры могут колебаться в широких пределах (1–200 нм), в зависимости от природы и числа образующих его мономеров. Поры сравнительно небольшого диаметра проницаемы преимущественно для ионов и низкомолекулярных компонентов. Основой их токсического действия является нарушение ионного гомеостаза клетки и ее осмотического баланса. В простейшем случае это приводит к лизису клеток и некрозу тканей. Однако даже если клетка способна противостоять осмотическому дисбалансу, увеличение в цитоплазме концентрации некоторых ионов, например  , способно приводить к другим драматическим последствиям – запуску процессов экзоцитоза, эндоцитоза или апоптоза. Поры большого диаметра, проницаемые для белков, также используются не только для прямого лизиса клеток-мишеней, но и для транспорта в ее цитоплазму ферментов, что приводит, например, к нарушению синтеза белка в клетке или инициации апоптотических реакций. Однако молекулярная структура подобных соединений весьма вариабельна и поэтому вариабелен механизм их мембранной активности.
, способно приводить к другим драматическим последствиям – запуску процессов экзоцитоза, эндоцитоза или апоптоза. Поры большого диаметра, проницаемые для белков, также используются не только для прямого лизиса клеток-мишеней, но и для транспорта в ее цитоплазму ферментов, что приводит, например, к нарушению синтеза белка в клетке или инициации апоптотических реакций. Однако молекулярная структура подобных соединений весьма вариабельна и поэтому вариабелен механизм их мембранной активности.
Избирательность действия пороформирующих токсинов может варьировать в широких пределах: от полного ее отсутствия до высокой специфичности, связанной с наличием имеющих различную природу рецепторных структур. Ими могут быть липиды (холестерин, фосфатидилхолин и др.), мембранные белки (гликолипопротеины) или высокоспецифические белковые рецепторы. В зависимости от этого токсин может повреждать только прокариотические клетки либо только клетки эукариот, или же клетки определенных тканей. В связи с этим семейство белков, образующих каналы большого диаметра, является очень хорошим материалом для нано технологических конструкций.
Таким образом, совершенно очевидно, что создание новых антибиотиков не может быть успешным без сведений о характере их действия на клетки, с одной стороны, и их возможным токсическим действием, с другой стороны. Выяснение детальных механизмов избирательности того или иного каналоформера позволит, с применением методов генной инженерии, создавать токсины направленного действия, поражающие клетки-мишени преимущественно одного типа, что особенно актуально в отношении раковых клеток.
Кроме того, знание механизмов действия антибиотиков облегчает врачу понимание полезного и токсического влияния на организм и позволяет прогнозировать эффективность терапии. Неудивительно, что соединения, способные создавать в мембране, несвойственные ей каналы, привлекают внимание учёных как потенциальные антибиотики нового поколения, которые помогут разрешить или снизить остроту проблемы, обусловленной ростом числа устойчивых клинических штаммов бактерий.
4.3. Каналы и нано технологии
В настоящее время усилилось внимание к природным и синтетическим соединениям, способным формировать каналы нано метрового размера (нанопоры) в различных технологических приложениях. В частности, как стохастические сенсоры для биомолекул и ионов металлов [141].
Принципы функционирования таких устройств кажутся простыми, молекулы, несущие электрический заряд, под действием электрического поля проходят через пору и блокируют ее физически, что приводит к регистрируемому изменению ее проводимости. Прохождение каждой молекулы может регистрироваться индивидуально. На этом принципе базируются широко известные счетчики Коултера [142]. Примером подобной поры может быть пора, сформированная из α-гемолизина S. aureus [143]. Эти поры, сформированные в модельных мембранах, практически постоянно находятся в высоко проводящем состоянии в широком диапазоне экспериментальных условий. Оказалось, что их можно успешно использовать для детектирования одно и двухцепочных молекул ДНК [144], поскольку они характеризуются разным временем прохождения через пору.
Нанопоры также могут быть использованы для контроля качества ДНК: короткие и длинные фрагменты ДНК при своем прохождении через канал по-разному модулируют его проводимость. На основании полученных данных несколько групп исследователей пытаются создать искусственные нанопоры, которые могут быть приспособлены для de novo автоматического определения последовательности нуклеотидов молекул ДНК и РНК. Однако, в то время как поры, образованные стафилококковым альфа-гемолизином обладают практически идеальными свойствами для детекции одноцепочечной ДНК, создание синтетических нано пор все еще сталкивается с большими трудностями.
Используя одиночный альфа-гемолизиновый канал, группе авторов удалось создать «масс-спектрометр», достаточно достоверно определяющий молекулярную массу проходящих через пору молекул. Устройство основано на зависимости уровня проводимости одиночного канала от молекулярной массы транслоцируемых молекул (в том числе и не заряженных) [145].
Альфа-гемолизиновые поры были применены для создании везикулярного клетко-подобного биореактора, что позволило значительно увеличить количество экспрессированных белков [146]. Клетко-подобным биореактором называют фосфолипидную везикулу (липосому), внутри которой находится система экспресси E. Coli: раствор рибонуклеотидов и аминокислот. Однако работа такого биологического реактора останавливается через пару часов из-за исчерпания необходимых для синтеза соединений. Пороформирующий белок α-гемо лизин S. aureus, экспрессируемый внутри везикул, сделал возможным поступление внутрь реактора через поры дополнительного количества необходимых для осуществления синтеза белка веществ и реактор продуцировал белок в течение до 4 дней и тем самым существенно увеличил выход белка.
Недавно нанопоры на основе модифицированного стафилококкового гемолизина были использованы для создания устройств, способных быстро обнаруживать азотистый иприт в концентрации менее 50 мкМ [149].
В качестве нано пор также пробовали использовать менее изученные порины из E. coli и ионный канал из B. subtilis, обладающие отличными от α-гемолизина свойствами [150]. Так, например, бактериальный ионный канал из B. sub tilis имеет значительно больший диаметр, что позволило использовать его для транслокации двухцепочечной ДНК плазмиды 4.2 kb и регистрации изменения сопротивления канала в результате её транслокации. Белок наружной мембраны E. coli порин OmpF, образующий тримерную пору диаметром 1.0–1.2 нм был использован для детекции водорастворимых полимеров типа полиэтилен гликоля [150]. Интересным представляется также использование механо-чувствительных каналов E. Coli:MscL и MscS, которые обладают рядом свойств, позволяющих повысить чувствительность биосенсоров в будущем [151].
Антимикробные пептиды уже используются в медицине в качестве антибиотических препаратов.
Также предполагается использование в медицине термочувствительных пор, которые были получены путем введения эластин подобного полипептида в структуру гептамера («β-сэндвич»домен), образованного стафилококковым альфа-гемолизином. Петля эластин подобного полипептида выступает внутрь канала, и в зависимости от температуры либо не блокирует ионный поток, так как свернута, либо разворачивается и полностью блокирует проводимость канала. Этот процесс обратимый. Температура перехода петли из одного конформационного состояния в другое приблизительно 40°С. При температуре ниже температуры перехода полипептид развернут, а выше – свернут. Такие поры могут быть встроены в липосомы и использоваться для контролируемого температурой высвобождения лекарств из липосом или встроены в клетки для контролируемого введения веществ в них.
Активное исследование свойств белков, образующих поры, может в будущем привести к созданию совершенно новых устройств с принципиально новыми свойствами.