Министерство образования Республики Беларусь
Учреждение образования
«Могилевский государственный университет продовольствия»
Кафедра химии
Потенциометрическое определение константы диссоциации слабого электролита
Лабораторная работа №1
по дисциплине «Физическая и коллоидная химия»
Специальность
___________________________________________________________________________________
Специализация
___________________________________________________________________________________
| Проверил | Выполнили |
| _________________________________ | студенты группы ______________ |
| ____________________________________ | |
| ____________________________________ | |
| «____» _______________ 20____ г | «____»__________________ 20____ г |
Могилев 20____ г
Лабораторная работа №1
Потенциометрическое определение константы диссоциации слабой кислоты
1. Цель работы – познакомиться с основными физико-химическими величинами, характеризующими поведение слабых кислот в водных растворах: их концентрацией, рН раствора, степенью диссоциации, константой равновесия; научиться выполнять расчеты для перехода от одних характеристик к другим. Исследовать влияние концентрации кислоты на ее степень диссоциации и константу равновесия.
2.Работа выполняется на ЭВМ по имеющейся программе в соответствии с указаниями, которые появляются на экране монитора.
3. Теоретическое введение.
Слабые электролиты диссоциируют в растворе не полностью, т.е. их степень диссоциации меньше 100%. Для равновесия диссоциации слабой кислоты HA имеем:
HA ↔ H+ + A–, (1)
C0 – x x x
 . (2)
. (2)
Константу равновесия (2), выраженную через концентрации, можно считать постоянной и не зависящей от концентрации как самой кислоты, так и других ионов и молекул, присутствующих в растворе. Это – основное свойство константы равновесия (2), на котором основаны все расчеты равновесий с участием слабых электролитов.
В выражение (2) входят равновесные концентрации ионов и исходных молекул HA, т.е. такие, которые получились после установления равновесия в системе (1) и уже не изменяются со временем. Поэтому величина C(HA) меньше C0 на величину C(диссоц.), которую мы примем за x. Здесь C0 – начальная (аналитическая) концентрация HA, которая была бы, если бы кислота не диссоциировала в растворе; C(диссоц.) – концентрация продиссоциировавшей кислоты.
Как следует из уравнения (1), 1 моль HA образует при диссоциации по одному молю ионов H+ и A–. Поэтому для чистой кислоты имеем:
C(диссоц.) = x = C(H+) = C(A–). (3)
Таким образом, константа равновесия (2) может быть определена по уравнению
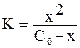 . (4)
. (4)
Степень диссоциации HA, т.е. доля продиссоциировавших молекул, равна:
 . (5)
. (5)
В отличие от константы равновесия, степень диссоциации слабого электролита зависит от его концентрации – характер этой зависимости можно получить, выразив x в уравнении (5) через α и C0 и подставив его в уравнение (4). При α << 1 получаем ее простую зависимость от C0.
4. Методика выполнения (ход работы).
До начала выполнения лабораторной работы необходимо получить от преподавателя название слабой кислоты HA и концентрацию ее раствора C1 (раствор 1), который необходимо «приготовить» в мерной колбе на 100 мл из имеющегося 1,5 М раствора этой кислоты.
Расчет объема исходного раствора кислоты (Vисх) с концентрацией 1,5 М (Cисх), который необходимо взять для приготовления в мерной колбе на 100 мл (V1) раствора кислоты заданной концентрации (C1) основан на том, что при разбавлении водой исходной кислоты количество вещества (n молей или миллимолей) в мерной колбе не изменяется:
n = Cисх·Vисх = C1·V1. (6)
Требующийся объем кислоты вычисляется с обычной в аналитической практике точностью ± 0,01 мл. Правильность полученной величины Vисх может быть проверена на ЭВМ.
______________________________________________________________________
Ход выполнения работы изложен в [2].
5. Результаты работы.
После ввода всех исходных данных в ЭВМ она выдает величину рН приготовленного раствора 1: рН1 = – lg C(H+) = – lg x. Расчеты константы равновесия и степени диссоциации производятся по уравнениям (4) и (5). Правильность полученной величины K может быть проверена по справочнику [5], а α – на ЭВМ.
Выполнение работы повторяется ещё 2 раза, каждый раз уменьшая объем исходного раствора кислоты (Vисх) в 3–5 раз.
Полученные результаты необходимо представить в форме таблицы 1.
Таблица 1 – Результаты измерений и расчетов для растворов уксусной кислоты
| № | Концентрация кислоты, моль/л | рН раствора | С(Н+), моль/л | Степень диссоциации | Константа диссоциации |
| 0,05 | |||||
| 0,10 | |||||
| 0,15 | |||||
| 0,20 | |||||
| 0,25 | |||||
| 0,30 |
6. Заключение (выводы):
– проведено ознакомление с основными физико-химическими величинами, характеризующими поведение слабых кислот в водных растворах: их концентрацией, рН раствора, степенью диссоциации, константой равновесия;
– освоено выполнение расчетов для перехода от одних характеристик к другим;
– установлено, что константа равновесия не зависит от концентрации кислоты;
– установлено, что степень диссоциации слабой кислоты с уменьшением ее концентрации возрастает.
7. Вопросы для зачета лабораторных работ.
1) Сильные и слабые электролиты – чем они различаются по своему поведению в растворах?
2) Константа диссоциации, степень диссоциации (α) слабых электролитов – что это такое, их запись через концентрации. Свойства константы диссоциации.
3) Как и почему изменяется α при изменении концентрации раствора слабого электролита?
4*) Как и почему изменяется α при введении в раствор одноименных ионов? Поясните принцип Ле-Шателье.
5*) Как и почему изменяется α при частичной нейтрализации слабой кислоты? Ответ поясните химическими реакциями. Поясните принцип Ле-Шателье.
6) Как определяется степень диссоциации и константа диссоциации слабой кислоты потенциометрическим методом?
8. Список литературы:
1) Общие требования и правила оформления текстовых документов: СТП 15-06-2004. – Могилев: МГУП, 2004. – 41 с.
2) Методические указания для выполнения лабораторных работ на ЭВМ: «Кинетика химических реакций. Адсорбция». Для студентов технологических, химико-технологических и химических специальностей вузов / Могилевский государственный университет продовольствия; О.Г. Поляченок, Л.Д. Поляченок. – Могилев, 2005. – 40 с.
3) Поляченок, О.Г. Физическая и коллоидная химия. Практикум: Учебное пособие / О.Г. Поляченок, Л.Д. Поляченок. – Минск: Лаб. полиграфии УО БГТУ, 2006. – 380 с. – С.245–267.
4) Поляченок, О.Г. Физическая и коллоидная химия. Конспект лекций: / О.Г. Поляченок, Л.Д. Поляченок. – Могилев: МГУП, 2008. – 196 с. – С. 131–147.
5) Краткий справочник физико-химических величин / под ред. А.А. Равделя, А.М. Пономаревой. – 8-е изд. – Л.: Химия, 1983. – 252 с.