МЕТОДИЧЕСКИЕ УКАЗАНИЯ К ЛАБОРАТОРНЫМ РАБОТАМ ПО ВИЗУАЛЬНОЙ ОЦЕНКЕ РЕАКЦИИ ПРИРОДНЫХ ВОД И ПОЧВ ДЛЯ СТУДЕНТОВ ВСЕХ СПЕЦИАЛЬНОСТЕЙ
Магнитогорск - 2017
Составитель: д.т.н., к.б.н. Коробова Н.Л.
Визуальная оценка реакции снега и хвойного опада в связи с задачами зелёного строительства. Приведены методические указания по визуальной оценке рН природных вод и суспензии хвойного опада с помощью универсальной индикаторной бумаги. Методические указания могут использоваться для визуальной оценки реакции различных сред в полевых и лабораторных условиях.
Методические указанияпредназначаются для студентовочной и заочной форм обучения всех специальностей, изучающих экологию.
Рецензент: зав. каф. ПЭиБЖД, к.т.н.,
доц Перятинский А.Ю.
© Коробова Н.Л., 2017
Химические свойства природных вод обуславливаются их химическим составом и оцениваются различными показателями. Важнейшими свойствами являются общая минерализация, отрицательный десятичный логарифм концентрации ионов водорода (рН), окислительно-восстановительный потенциал (Еh), жесткость и агрессивность (способность воды разрушать строительные конструкции).
Показатель рН природных вод зависит, главным образом, от гидролиза солей, растворенных в воде, количества угольной кислоты и состава различных органических кислот. Значения рН природных вод могут, составлять диапазон от 2 до 11 и более. Однако крайние значения рН для природных вод не характерны, поскольку сильнощелочные и сильнокислые воды имеют локальное развитие. Наиболее часто встречающиеся значения рН природных вод составляют 5,5 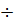 8,5. Наличие в воде СО2 и органических кислот не изменяет этого интервала.
8,5. Наличие в воде СО2 и органических кислот не изменяет этого интервала.
Практическое значение оценки рН природных вод:
1) используется для контроля химического анализа воды, поскольку ряд присутствующих в воде компонентов является рН - задающим или рН - определяющим. Например, если реакция воды нейтральная, то в ней не может быть повышенных количеств Fe 3+ или Аl 3+и т.д.;
2) от величины рН природных вод зависят интенсивность миграции большинства микроэлементов, а также формы их миграции;
3) в зонах окисления сульфидных месторождений величина рН имеет поисковое значение.
4) является санитарным показателем, определяющим пригодность воды для использования человеком
рН природных вод определяется присутствием в них различных соединений. Так, осадки городов с чёрной металлургией характеризуются, как правило, щелочными значениями рН. Подобная аномальная реакция метеорных вод объясняется присутствием в атмосферном воздухе этих городов щелочного аэрозоля, выбрасываемого предприятиями чёрной металлургии: доменным и агломерационным производствами, в ряде случаев, также сталеплавильными.
Источниками промышленной щелочной пыли также являются производства строительных материалов, поверхность известняковых, доломитовых и магнезитовых карьеров.
Природные воды со щелочной реакцией, как правило, характеризуются повышенными значениями жёсткости, в ряде случаев, повышенными значениями магнезиальной агрессивности. Повышенные значения жёсткости и магнезиальной агрессивности объясняются взаимодействием атмосферных осадков с карбонатами кальция и магния, поступающими в атмосферный воздух с выбросами выше указываемых предприятий. Повышенная жёсткость и магнезиальная агрессивность подземных вод, в том числе, используемых для питьевых целей, может быть обусловлена также взаимодействием воды с карбонатами кальция и магния в момент дренажа известняковых, доломитовых и магнезитовых отложений.
Жесткость природных вод связана с содержанием в них солей кальция и магния. Жесткость проявляется в образовании накипи на стенках паровых котлов, в поглощении мыла и т.д. Повышенная жёсткость питьевой воды значительно повышает риск камнеобразования.
Различают формы жесткости: 
1) общую, вызванную суммарным содержанием солей Са и Mg;
2) карбонатную, связанную с кальциево-магниевыми солями угольной кислоты;
3) устранимую (гидрокарбонатную), образующуюся за счёт гидрокарбонатов Са и Mg; этот вид жесткости легко удалить простым кипячением воды, так как Мg(НСО3)2 и Са(НСО3)2 разлагаются при кипячении на СО2 и выпадающие в осадок карбонаты Са и Mg;
4) постоянную, которая не разрушается кипячением и обязана кальциево-магниевыми солями всех присутcтвующих в воде анионов, за исключением гидрокарбонатного.
Согласно ГОСТ 6055-86 и ГОСТ 2874-72 величина общей жесткости питьевой воды, не должна превышать 7 ммоль/л (в некоторых случаях по согласованию с санитарно-эпидемиологической службой - 10 ммоль/л).
Под агрессивностью природных вод в технике понимают способность их разрушать строительные конструкции из различных материалов. Например, вода определенного состава может разрушать основу бетона (его вяжущее вещество) - цемент - даже после полного затвердевания бетона. Различают несколько форм агрессивности природных вод. В том числе общекислотную и магнезиальную формы,
Общекислотная агрессивность обусловлена низким значением рН природных вод, вследствие чего происходит растворение СаСО3. Вода считается агрессивной, если pH 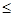 5,7 (иногда < 7,0).
5,7 (иногда < 7,0).
Магнезиальная агрессивность обусловлена обменными реакциями между ионами Mg 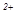 метеорных вод и ионами Са
метеорных вод и ионами Са 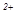 бетона. Согласно мнению Самариной В.С. разрушение защитной корки бетона, представленной карбонатом кальция, происходит в результате обменных реакций между кальцием поверхности твёрдой фазы бетона и магнием взаимодействующего с бетоном раствора. Воды считаются агрессивными при концентрации магния
бетона. Согласно мнению Самариной В.С. разрушение защитной корки бетона, представленной карбонатом кальция, происходит в результате обменных реакций между кальцием поверхности твёрдой фазы бетона и магнием взаимодействующего с бетоном раствора. Воды считаются агрессивными при концентрации магния  1000 мг/л.
1000 мг/л.
Значения рН природных вод определяются потенциометрически, а также визуально с помощью индикаторной бумаги. Наиболее удобна для этих целей универсальная индикаторная бумага.
Ход выполнения работы:
Подготовка проб для анализа (с 1 по 3 пункты): 1. В трёхкратной повторности следует взять навеску 2 г с каждого образца хвойного опада, предельно аккуратно пересыпать в пластиковые контейнеры или стаканчики (желательно типа РР), залить 50 мл дистиллированной воды, чтобы соотношение хвойный опад: вода составило как 1:25. Тщательно перемешать суспензию и через 3-10 минут измерить рН с помощью универсальной индикаторной бумаги.
2. Пробы снега отбирают в пластиковые контейнеры или стаканчики типа РР в момент обильного снегопада непосредственно с поверхности снежного покрова на глубину не более 1-1,5 см и не ранее, чем через 2 часа после начала снегопада. В случае, когда снегопада нет, пробы отбирают после предварительного среза мощностью 1-2 см поверхностного слоя снежного покрова. Пробы отбирают в трёхкратной повторности с подкроновой зоны вечнозелёных пород деревьев (ели канадской, ели обыкновенной, сосны обыкновенной и т.д.) и также в трёхкратной повторности со свободного пространства (между деревьями). Пробы несут в лабораторию и после таяния снега при температуре ≤ 15-18 Сº измеряют рН с помощью универсальной индикаторной бумаги.
3. Пробы сырой водопроводной воды берут также в пластиковые стаканчики типа РР. Кипячёную воду спрашивают у лаборантов.
4. Измерение рН с помощью универсальной индикаторной бумаги проводят следующим образом. Из туба берут одну полоску индикаторной бумаги, затем опускают её в исследуемый раствор (суспензию, талую воду) и быстро вытаскивают на белый лист бумаги. Цвет используемой полоски сравнивают с цветовой шкалой, указываемой на этикетке туба.
5. Обязательно объясните полученные результаты. Дайте рекомендации с целью снижения жёсткости и магнезиальной агрессивности исследуемой воды.
6. Полученные результаты запишите и зарисуйте.
7. После выполнения лабораторной работы обязательно приберитесь на своём рабочем месте.
Контрольные вопросы:
1) Актуальность и практическое значение изучения рН природных вод.
2) Чем обусловлена щёлочность подземных и метеорных вод?
3) Назовите формы жёсткости природных воды.
4) Что представляет собой агрессивность природных вод и чем она обусловлена?
5) Какой реакцией характеризуется хвойный опад фоновых территорий?
6) Чем обусловлена щелочная реакция хвойного опада городов с чёрной металлургией и производством стройматериалов?
7) Чем может быть обусловлена повышенная жёсткость, магнезиальная агрессивность и щелочная реакция питьевой воды?
Рекомендуемая литература:
1. Никаноров А.М., Посохов Е.В. Гидрохимия. – М.: Гидрометеоиздат, 1985.
2. Коробова Н.Л. Экология и горное производство. – Магнитогорск: МГТУ, 2001.
3. Коробова Н.Л. Мониторинг кислотно-основного состояния почв. – Магнитогорск: МГТУ, 2000.