Примерное время выполнения задания – 2 - 3 минуты
Уровень сложности задания – базовый
Максимальный балл за выполнение задания - 2
Задание № 7 рассчитано на проверку знаний о неорганических соединениях и их химических свойствах, умений определять, какое соединение задано в условииикаково его взаимодействие с другими веществами (кислота, основание, соль или амфотерный гидроксид), составлять уравнения электролитической диссоциации, ионного обмена, окислительно – восстановительных реакций.
Задание содержит краткое описание опыта, в котором происходит взаимодействие двух неизвестных веществ Х и Y с описанием визуальных эффектов, по которым надо определить формулы или названия неизвестных веществ Х и Y. В ответе надо записать цифры, под которыми указаны выбранные вещества.
| Перед выполнением предложенных заданий повторите: |
Кислоты – это электролиты, при диссоциации которых в водных растворах в качестве катионов образуются ионы водорода. Именно наличие ионов водорода обуславливает общие свойства всех кислот.
Рассмотрим свойства, характерные для всех кислот.
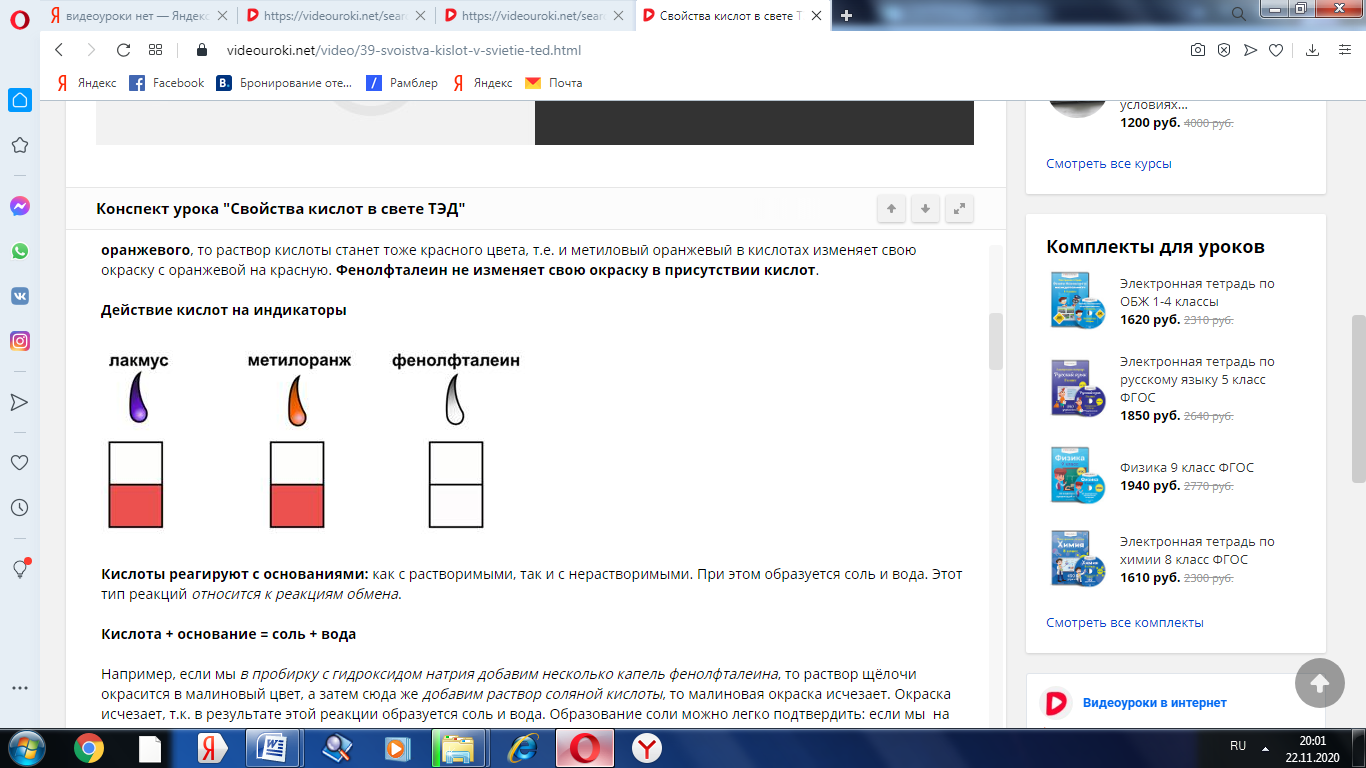
Все растворы кислот изменяют окраску индикаторов. Изменение окраски индикаторов связано с наличием у кислот ионов водорода, образующихся при диссоциации кислот.
HCl = H+ + Cl-
HNO3 = H+ + NO3-
HNO2 ⇆ H+ + NO2-
Если мы в раствор кислоты добавим несколько капель лакмуса, то раствор окрасится в красный цвет, т.е. в кислотах лакмус изменяет окраску с фиолетовой на красную, если мы в раствор кислоты добавим несколько капель метилового оранжевого, то раствор кислоты станет тоже красного цвета, т.е. и метиловый оранжевый в кислотах изменяет свою окраску с оранжевой на красную. Фенолфталеин не изменяет свою окраску в присутствии кислот.
Действие кислот на индикаторы
Кислоты реагируют с основаниями: как с растворимыми, так и с нерастворимыми. При этом образуется соль и вода. Этот тип реакций относится к реакциям обмена.
Кислота + основание = соль + вода
Например, если мы в пробирку с гидроксидом натрия добавим несколько капель фенолфталеина, то раствор щёлочи окрасится в малиновый цвет, а затем сюда же добавим раствор соляной кислоты, то малиновая окраска исчезает. Окраска исчезает, т.к. в результате этой реакции образуется соль и вода. Образование соли можно легко подтвердить: если мы на предметное стекло капнем несколько капель раствора и выпарим, то на стекле появятся кристаллы соли.
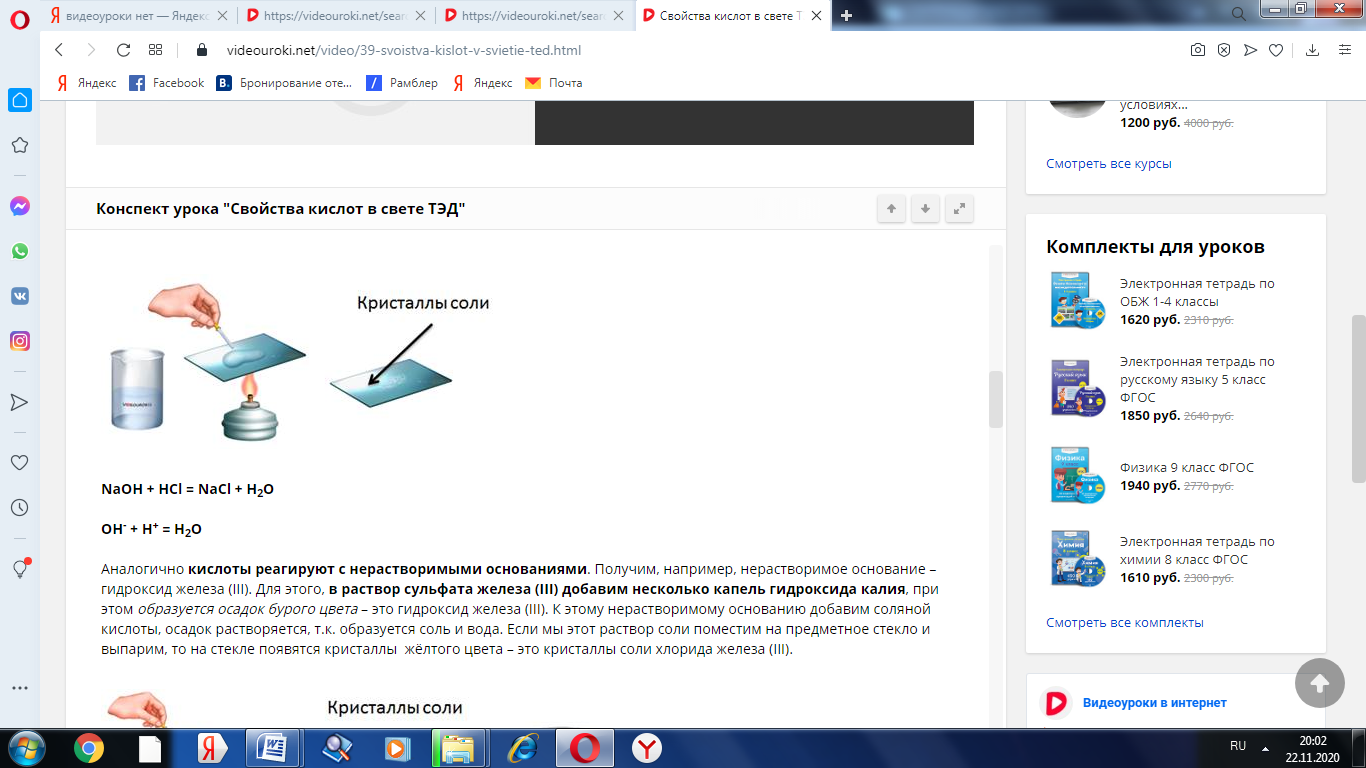
NaOH + HCl = NaCl + H2O
ОН- + Н+ = Н2О
Аналогично кислоты реагируют с нерастворимыми основаниями. Получим, например, нерастворимое основание – гидроксид железа (III). Для этого, в раствор сульфата железа (III) добавим несколько капель гидроксида калия, при этом образуется осадок бурого цвета – это гидроксид железа (III). К этому нерастворимому основанию добавим соляной кислоты, осадок растворяется, т.к. образуется соль и вода. Если мы этот раствор соли поместим на предметное стекло и выпарим, то на стекле появятся кристаллы жёлтого цвета – это кристаллы соли хлорида железа (III).
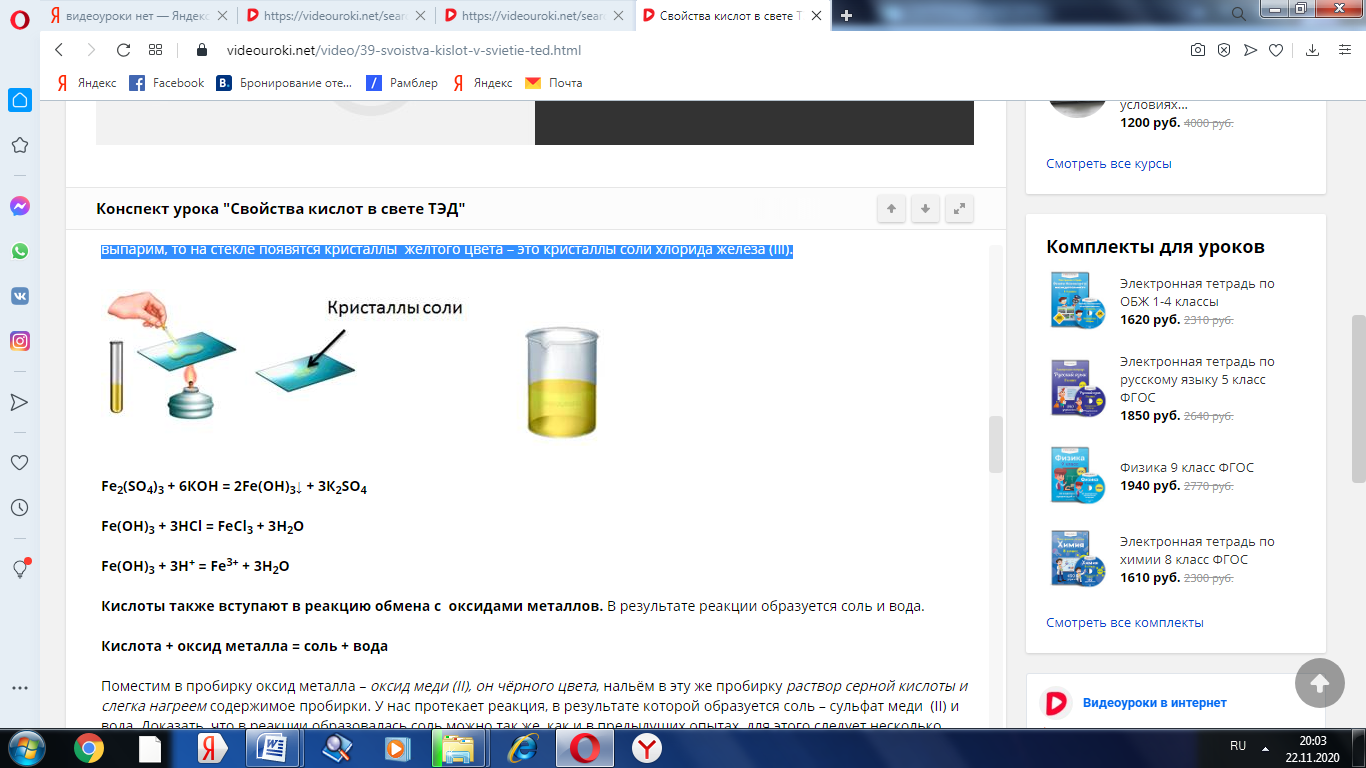
Fe2(SO4)3 + 6КOH = 2Fe(OH)3↓ + 3К2SO4
Fe(OH)3 + 3HCl = FeCl3 + 3H2O
Fe(OH)3 + 3H+ = Fe3+ + 3H2O
Кислоты также вступают в реакцию обмена с оксидами металлов. В результате реакции образуется соль и вода.
Кислота + оксид металла = соль + вода
Поместим в пробирку оксид металла – оксид меди (II), он чёрного цвета, нальём в эту же пробирку раствор серной кислоты и слегка нагреем содержимое пробирки. У нас протекает реакция, в результате которой образуется соль – сульфат меди (II) и вода. Доказать, что в реакции образовалась соль можно так же, как и в предыдущих опытах, для этого следует несколько капель раствора поместить на предметное стекло и выпарить.
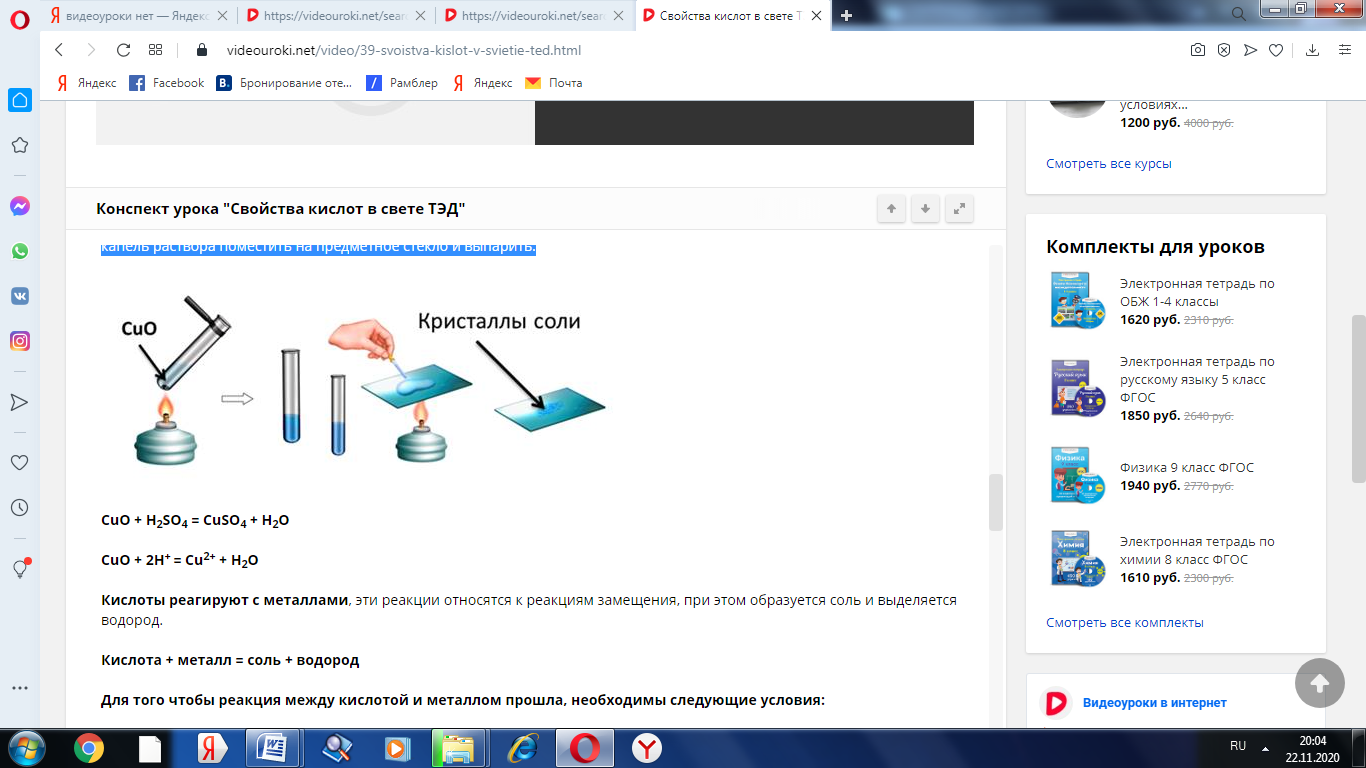
CuO + H2SO4 = CuSO4 + H2O
CuO + 2H+ = Cu2+ + H2O
Кислоты реагируют с металлами, эти реакции относятся к реакциям замещения, при этом образуется соль и выделяется водород.
Кислота + металл = соль + водород
Для того чтобы реакция между кислотой и металлом прошла, необходимы следующие условия:
· Металл должен находиться в ряду напряжений до водорода.
· Должна получиться растворимая соль.
· Нерастворимые кислоты не вступают в реакцию с металлами.
· Концентрированный раствор серной и растворы азотной кислоты иначе реагируют с металлами.
Для этого подтверждения поместим в четыре пробирки металлы: в первую пробирку – цинк, во вторую – алюминий, в третью – свинец, четвёртую – медь. В первую и третью пробирку нальём раствора серной кислоты, во вторую и четвёртую – раствора соляной кислоты. Понаблюдаем за изменениями. В первой и второй пробирке наблюдается выделение водорода, в третьей и четвёртой – нет. В пробирке со свинцом и серной кислотой реакция не пошла, т.к. в результате образуется нерастворимая соль, которая покрывает всю поверхность металла защитной плёнкой. В четвёртой пробирке также изменений нет, т.к. медь стоит в ряду напряжений металлов после водорода.
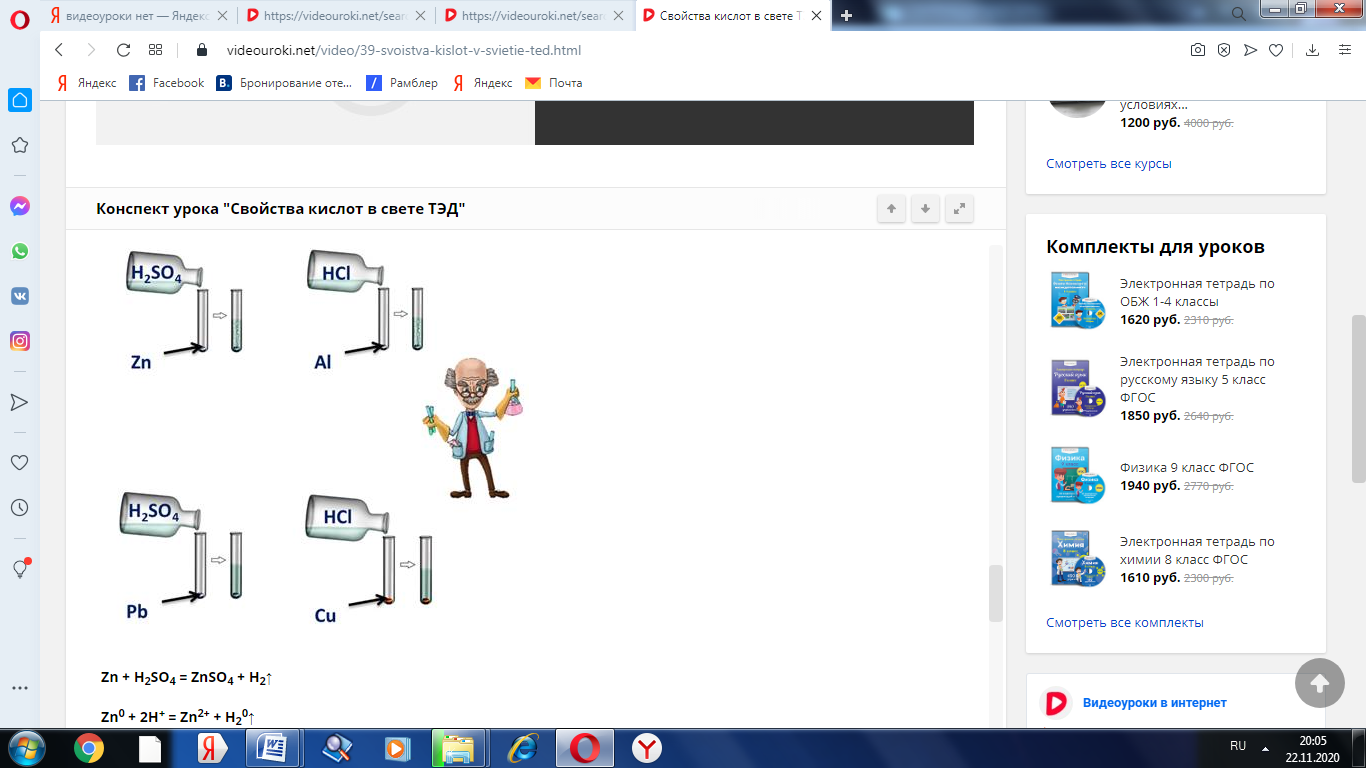
Zn + H2SO4 = ZnSO4 + H2↑
Zn0 + 2H+ = Zn2+ + H20↑
2Al + 6HCl = 2AlCl3 + 3H2↑
2Al0 + 6H+ = 2Al3+ + 3H20↑
Pb + H2SO4 ≠
Cu + HCl ≠
Реакция кислот с солями относится к реакциям обмена, при этом образуется новая кислота и новая соль. Эти реакции протекают в том случае, если образуется осадок или газ.
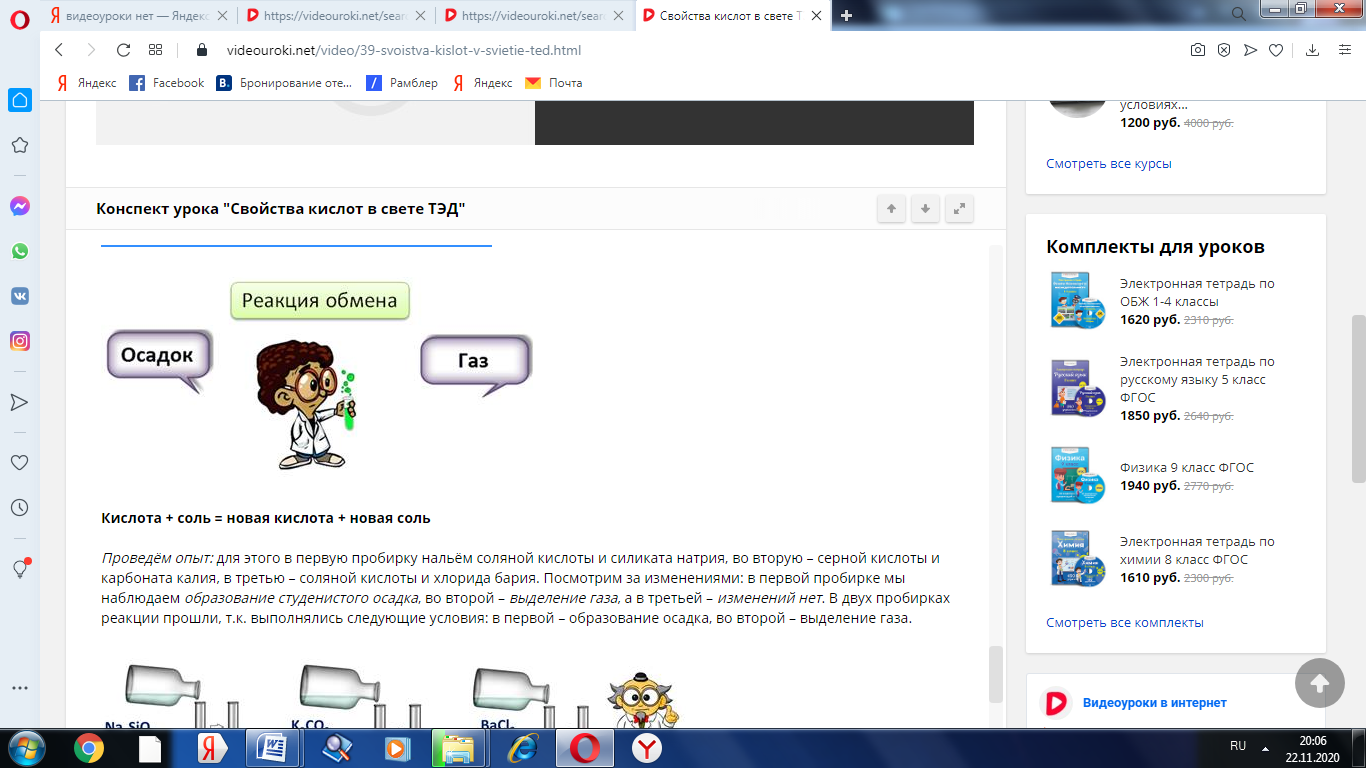
Кислота + соль = новая кислота + новая соль
Проведём опыт: для этого в первую пробирку нальём соляной кислоты и силиката натрия, во вторую – серной кислоты и карбоната калия, в третью – соляной кислоты и хлорида бария. Посмотрим за изменениями: в первой пробирке мы наблюдаем образование студенистого осадка, во второй – выделение газа, а в третьей – изменений нет. В двух пробирках реакции прошли, т.к. выполнялись следующие условия: в первой – образование осадка, во второй – выделение газа.
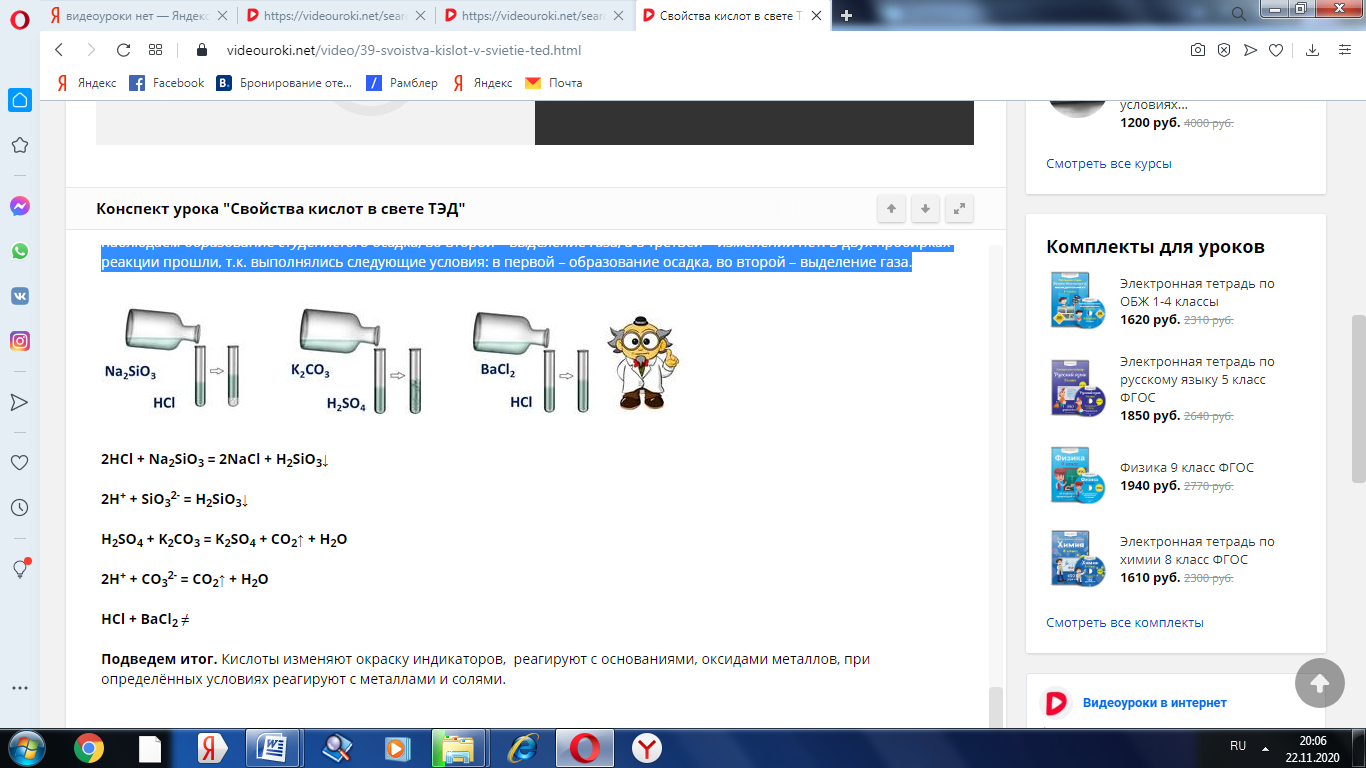
2HCl + Na2SiO3 = 2NaCl + H2SiO3↓
2H+ + SiO32- = H2SiO3↓
H2SO4 + K2CO3 = K2SO4 + CO2↑ + H2O
2H+ + CO32- = CO2↑ + H2O
HCl + BaCl2 ≠
Вывод:
Кислоты изменяют окраску индикаторов, реагируют с основаниями, оксидами металлов, при определённых условиях реагируют с металлами и солями.
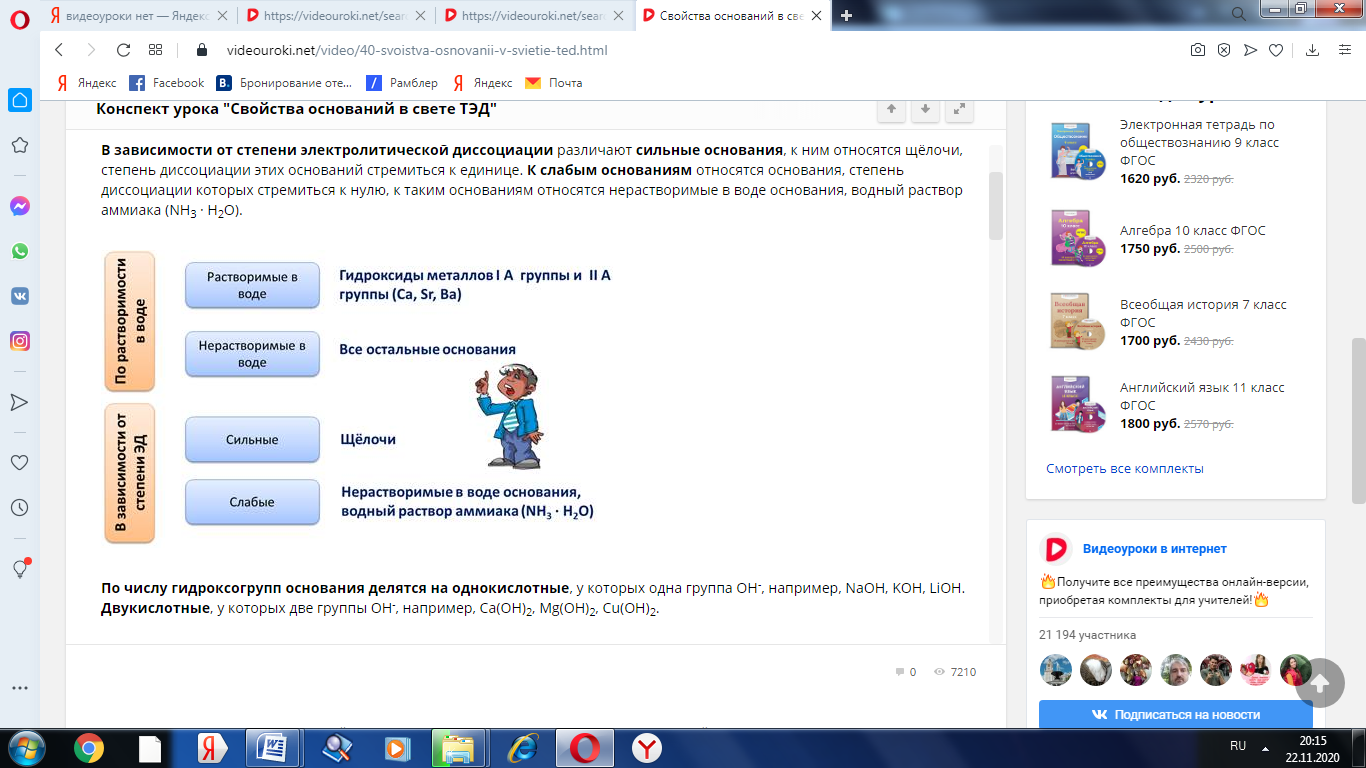
Классификация оснований
По растворимости в воде основания делятся на растворимые в воде, или щёлочи, к ним относятся гидроксиды металлов I A группы главной подгруппы и гидроксиды металлов II A группы главной подгруппы, таких как Ca, Sr, Ba. Все остальные основания являются нерастворимыми в воде.
В зависимости от степени электролитической диссоциации различают сильные основания, к ним относятся щёлочи, степень диссоциации этих оснований стремиться к единице. К слабым основаниям относятся основания, степень диссоциации которых стремиться к нулю, к таким основаниям относятся нерастворимые в воде основания, водный раствор аммиака (NH3 · H2O).
Все основания по агрегатному состоянию являются твёрдыми веществами, имеющими различную окраску. Исключение составляет только раствор аммиака в воде, представляющий собой всем известный нашатырный спирт. Это основание, в отличие от других, содержит не катион металла, а катион аммония (NH4+) и существует только в растворе. Он легко разлагается на аммиак и воду.
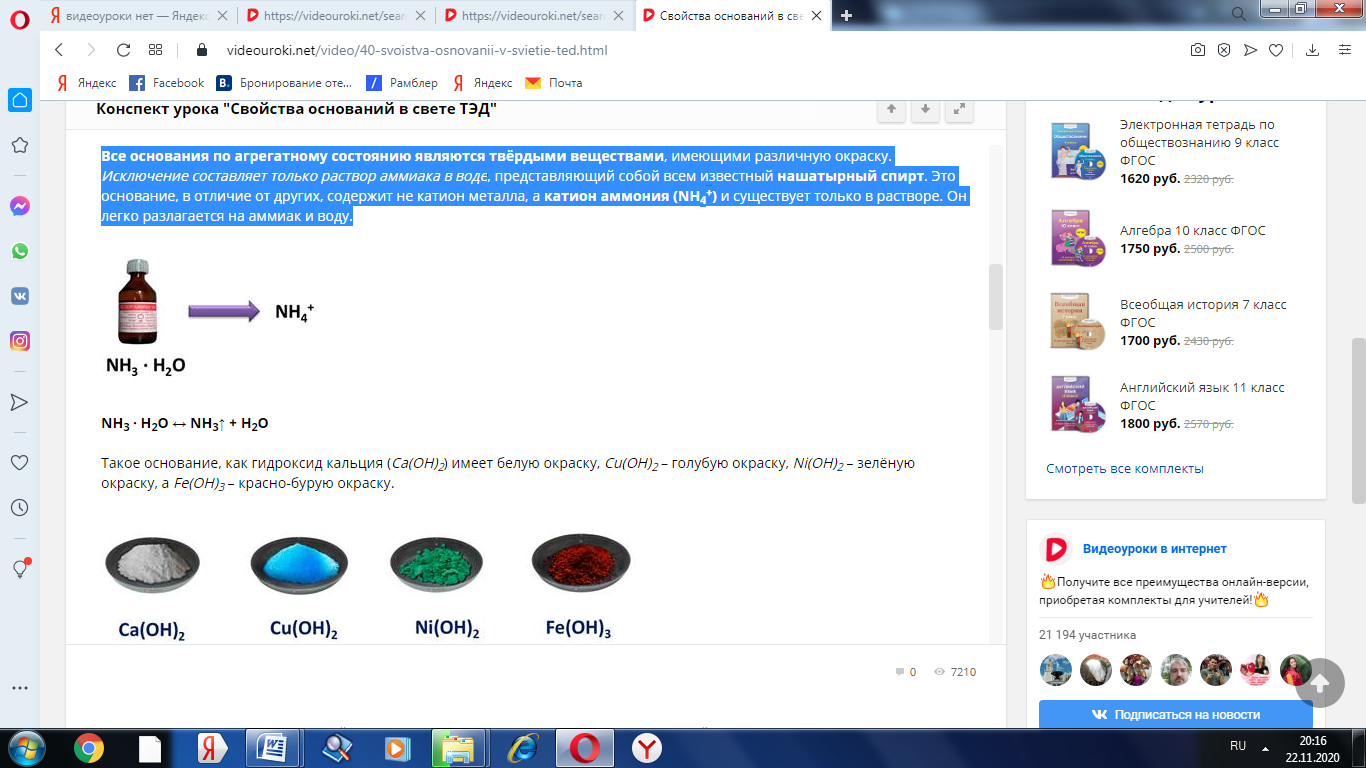
NH3 · H2O ↔ NH3↑ + H2O
Такое основание, как гидроксид кальция (Са(ОН)2) имеет белую окраску, Cu(OH)2 – голубую окраску, Ni(OH)2 – зелёную окраску, а Fe(OH)3 – красно-бурую окраску.
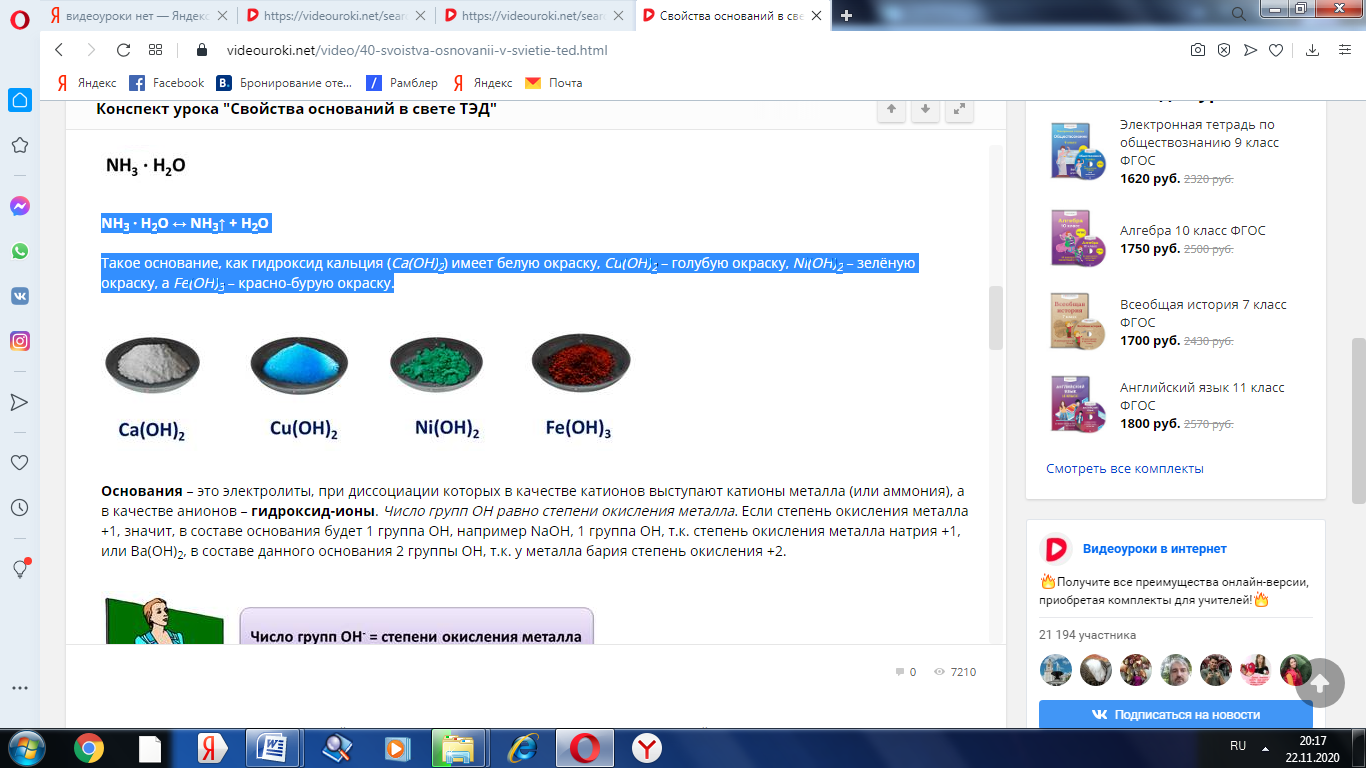
Основания – это электролиты, при диссоциации которых в качестве катионов выступают катионы металла (или аммония), а в качестве анионов – гидроксид-ионы. Число групп ОН равно степени окисления металла. Если степень окисления металла +1, значит, в составе основания будет 1 группа ОН, например NaOH, 1 группа ОН, т.к. степень окисления металла натрия +1, или Ba(OH)2, в составе данного основания 2 группы ОН, т.к. у металла бария степень окисления +2.
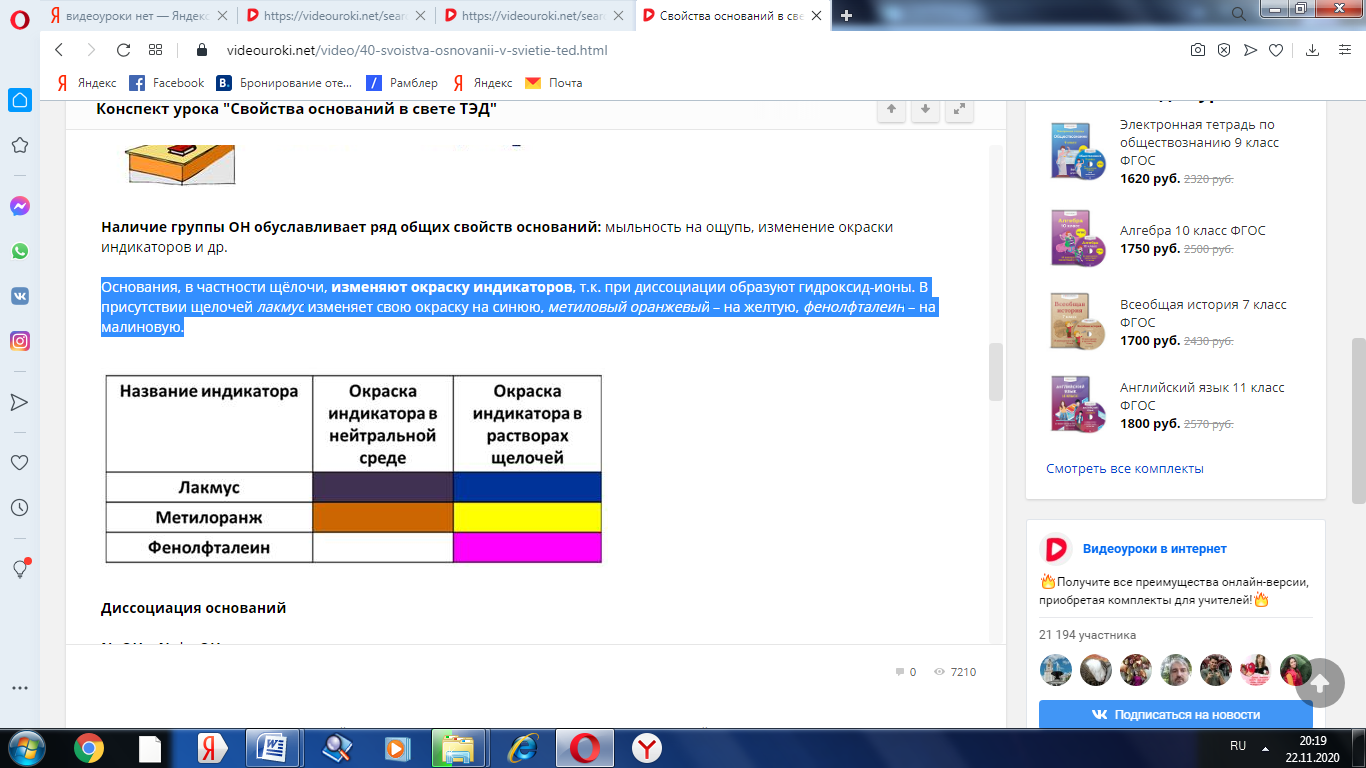
Основания, в частности щёлочи, изменяют окраску индикаторов, т.к. при диссоциации образуют гидроксид-ионы. В присутствии щелочей лакмус изменяет свою окраску на синюю, метиловый оранжевый – на желтую, фенолфталеин – на малиновую.
Диссоциация оснований
NaOH = Na+ + OH-
Основания вступают в реакцию с кислотами. Эти реакции относятся к реакциям обмена. В результате чего образуется соль и вода. Вспомните, если мы в стакан с гидроксидом натрия добавим несколько капель фенолфталеина, то раствор щёлочи окрасится в малиновый цвет, а затем сюда же добавим раствор соляной кислоты, то малиновая окраска исчезает. Окраска исчезает, т.к. в результате этой реакции образуется соль и вода. Образование соли можно легко подтвердить: если мы на предметное стекло капнем несколько капель раствора и выпарим, то на стекле появятся кристаллы соли.
NaOH + HCl = NaCl + H2O
ОН- + Н+ = Н2О
Аналогично, и нерастворимые основания реагируют с кислотами. Получим, например, нерастворимое основание – гидроксид железа (III). Для этого, в раствор сульфата железа (III) добавим несколько капель гидроксида калия, при этом образуется осадок бурого цвета – это гидроксид железа (III). К этому нерастворимому основанию добавим соляной кислоты, осадок растворяется, т.к. образуется соль и вода. Если мы этот раствор соли поместим на предметное стекло и выпарим, то на стекле появятся кристаллы жёлтого цвета – это кристаллы соли хлорида железа (III).
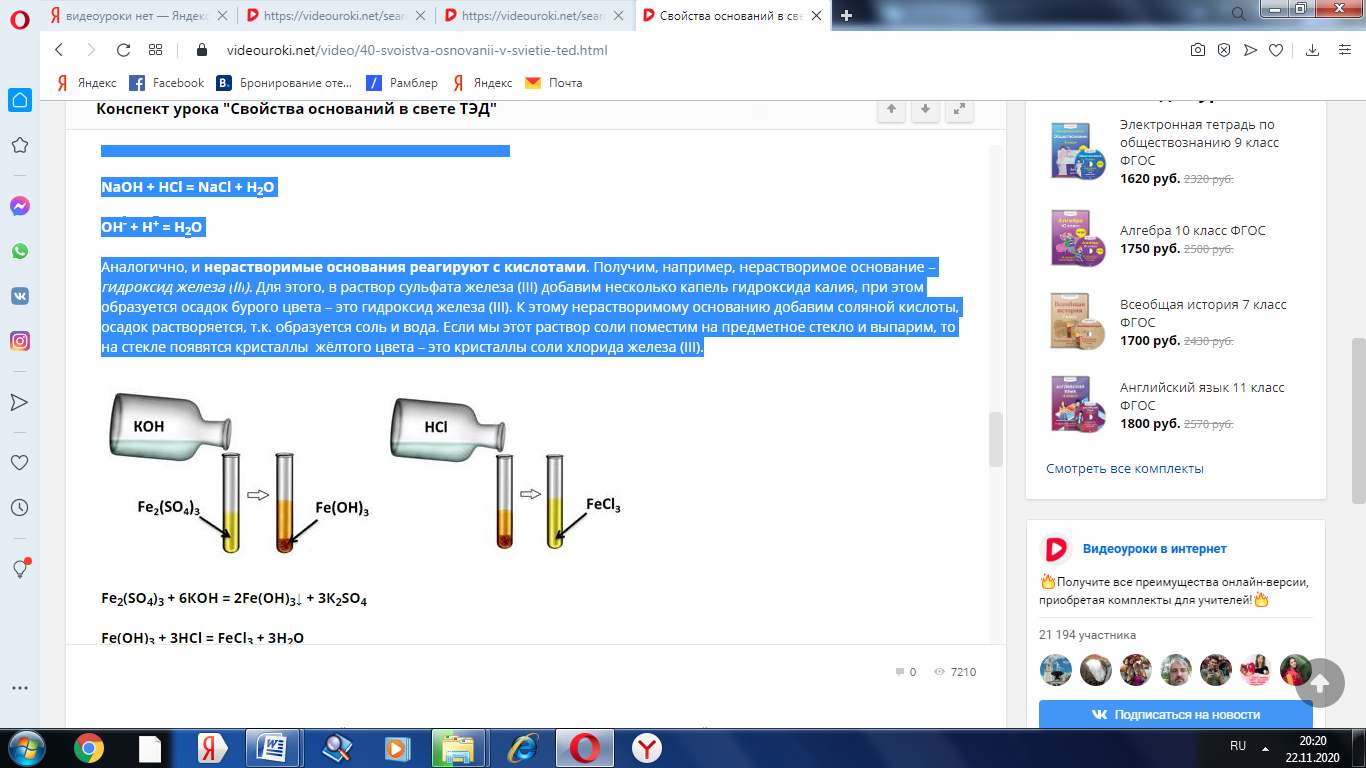
Fe2(SO4)3 + 6КOH = 2Fe(OH)3↓ + 3К2SO4
Fe(OH)3 + 3HCl = FeCl3 + 3H2O
Fe(OH)3 + 3H+ = Fe3+ + 3H2O
Щёлочи реагируют и с оксидами неметаллов. Каждому оксиду неметалла соответствует своя кислота, так оксиду азота (V) соответствует азотная кислота (N2O5 → HNO3), оксиду серы (IV) – сернистая кислота (SO2 → H2SO3), оксиду серы (VI) соответствует серная кислота (SO3 → H2SO4), оксиду фосфора (V) – фосфорная кислота (P2O5 → H3PO4), оксиду углерода (IV) – угольная кислота (CO2 → H2CO3) и т.д.
Поэтому в реакциях щелочей с оксидами неметаллов образуются соли соответствующих кислот и вода. Вспомните качественную реакцию на углекислый газ: известковая вода реагирует с углекислым газом, в результате чего происходит помутнение известковой воды, вследствие образования карбоната кальция.
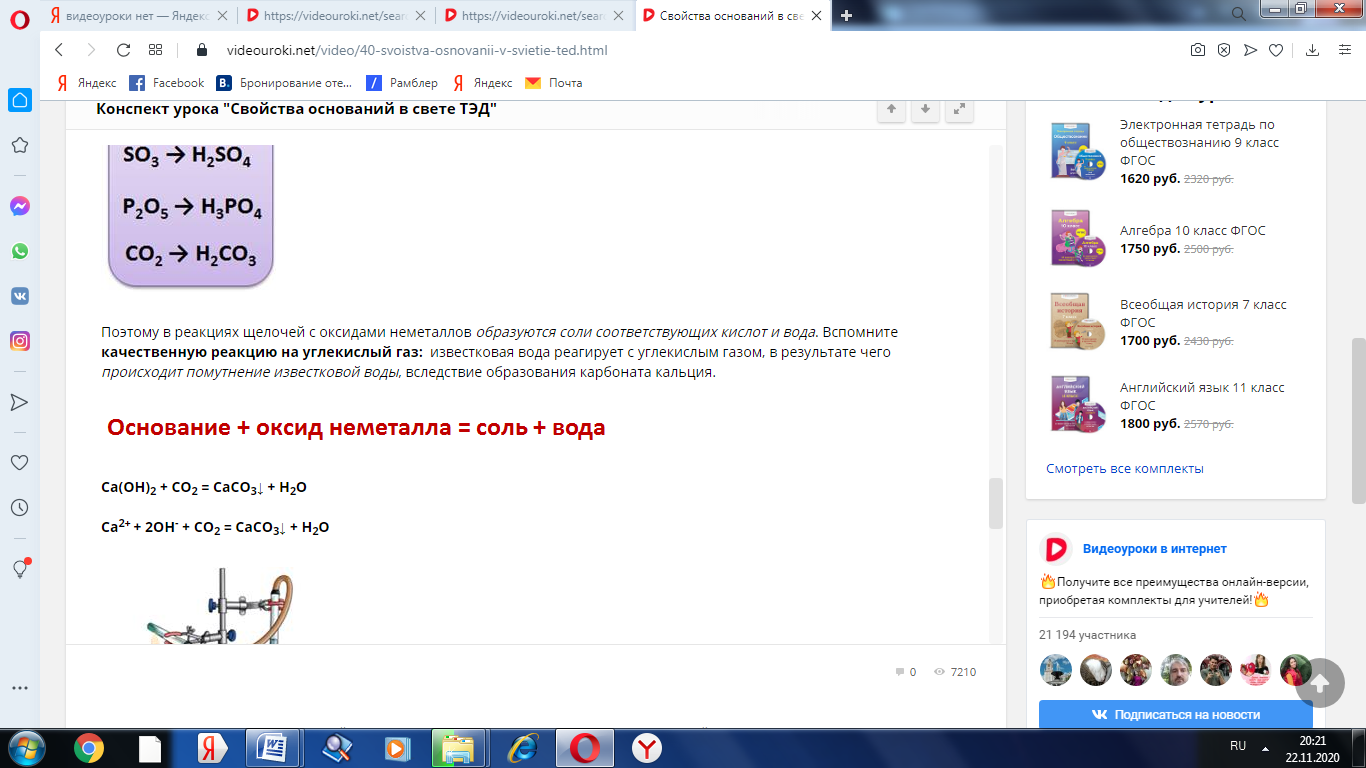
Са(ОН)2 + СО2 = СаСО3↓ + Н2О
Са2+ + 2ОН- + СО2 = СаСО3↓ + Н2О
Эта реакция относится к реакциям обмена.
Щёлочи вступают в реакцию обмена с солями, при этом образуется новая соль и новое основание, но при этом, должны выполняться определённые условия, т.е. должен образоваться осадок или слабый электролит.
Проведём эксперимент, для этого нальём в первую пробирку гидроксида натрия и хлорида аммония, во вторую – гидроксида калия и сульфата железа (III), а в третью – гидроксида натрия и хлорида бария. Содержимое первой пробирки нагреем. В результате появляется резкий запах аммиака. Во второй пробирке образуется осадок бурого цвета, а в третьей пробирке изменений не произошло. Т.о. в двух пробирках реакция прошла, т.к. выполнялись условия: образуется осадок или слабый электролит.
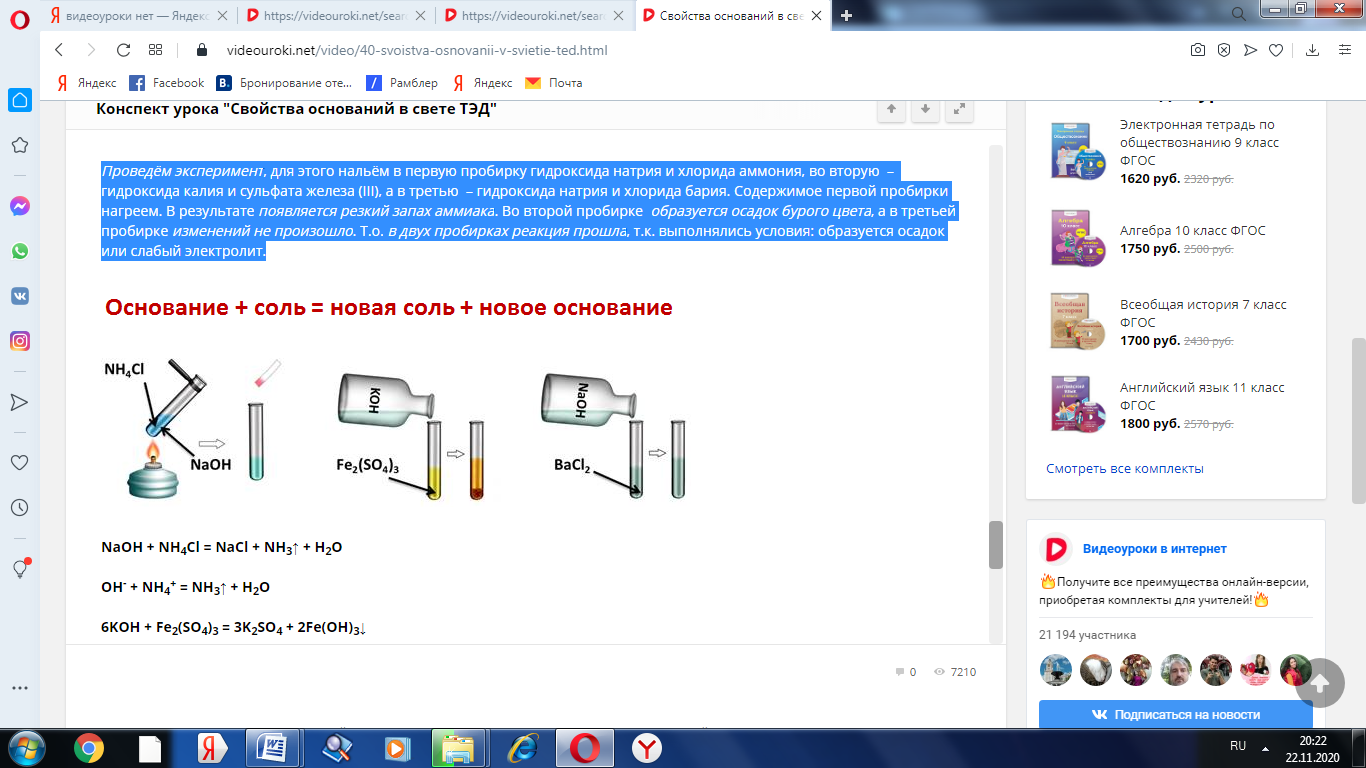
NaOH + NH4Cl = NaCl + NH3↑ + H2O
OH- + NH4+ = NH3↑ + H2O
6KOH + Fe2(SO4)3 = 3K2SO4 + 2Fe(OH)3↓
6OH- + 2Fe3+ = 2Fe(OH)3↓
NaOH + BaCl2 ≠
Все нерастворимые основания при нагревании разлагаются на оксид металла и воду. Щёлочи этой способностью не обладают. Например, гидроксид железа (II) разлагается на оксид железа (II) и воду.
Для подтверждения этого свойства получим нерастворимое основание гидроксида меди (II), а затем нагреем его. Для этого, в две пробирки нальём раствора сульфата меди (II), затем сюда же добавим несколько капель гидроксида натрия. У нас образуется осадок голубого цвета. Это гидроксид меди (II).
CuSO4 + 2NaOH = Cu(OH)2↓ + Na2SO4
Cu2+ + 2OH- = Cu(OH)2↓
Если в одну из пробирок с осадком гидроксида меди (II) добавить раствора соляной кислоты, то осадок растворяется. В результате образуется соль и вода. В этом можно убедиться, если несколько капель раствора капнуть на предметное стекло и выпарить, то на стекле появляются кристаллы соли.
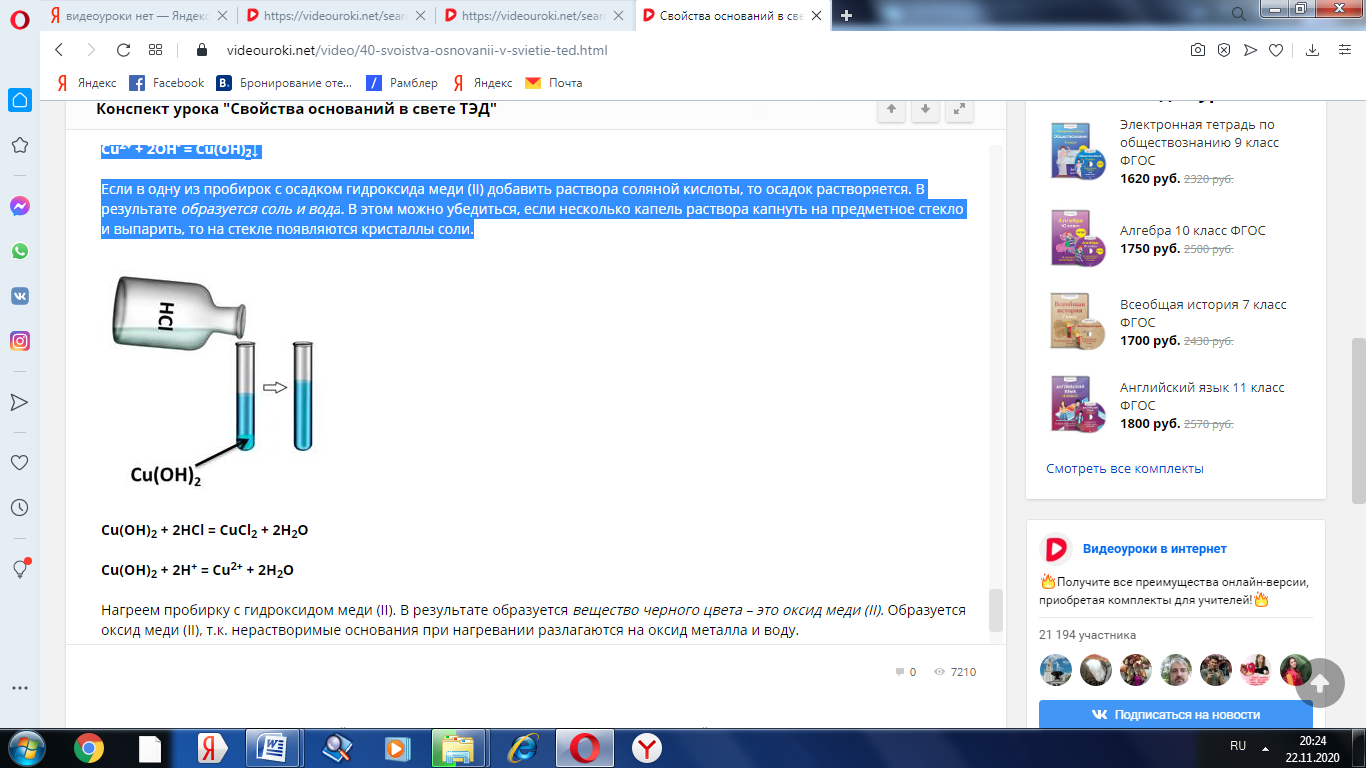
Cu(OH)2 + 2HCl = CuCl2 + 2H2O
Cu(OH)2 + 2H+ = Cu2+ + 2H2O
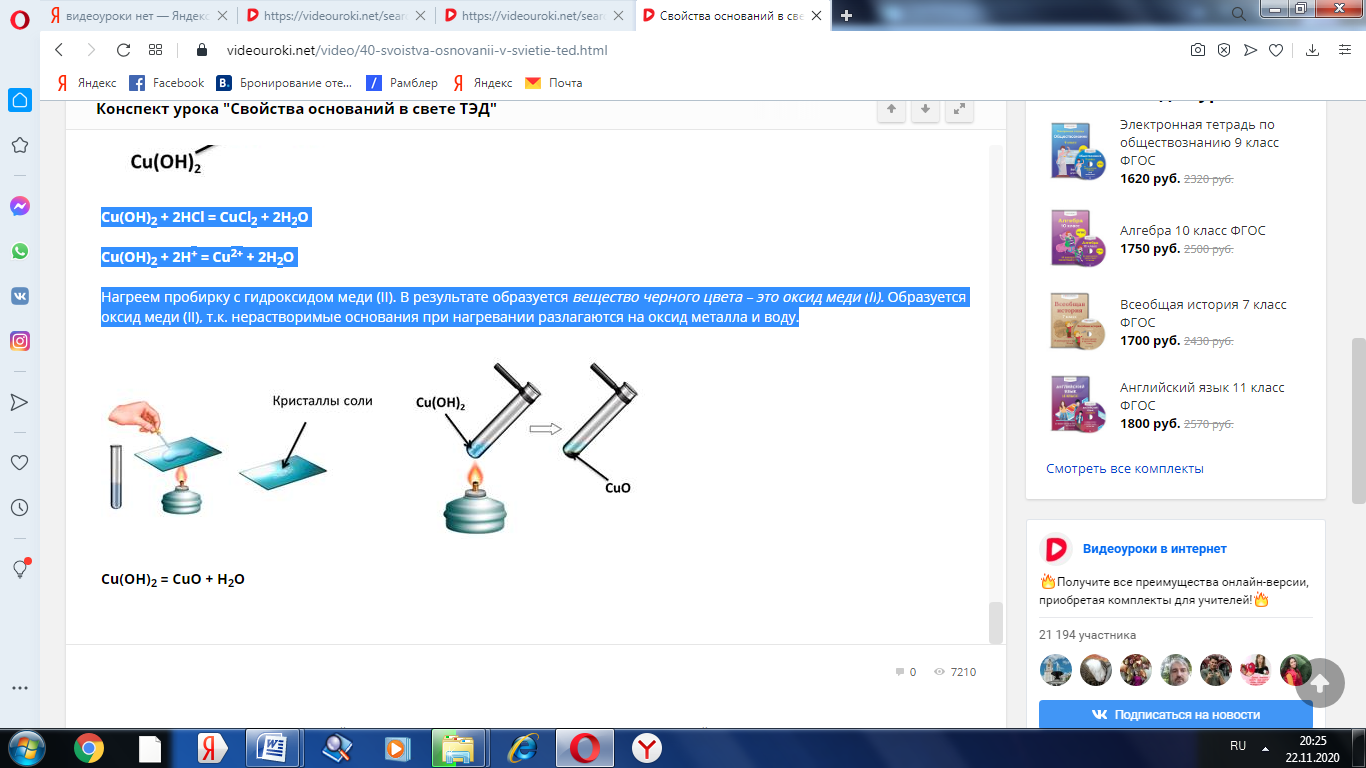
Нагреем пробирку с гидроксидом меди (II). В результате образуется вещество черного цвета – это оксид меди (II). Образуется оксид меди (II), т.к. нерастворимые основания при нагревании разлагаются на оксид металла и воду.
Соли – это сложные вещества, состоящие из ионов металла и ионов кислотного остатка. Соли – это твёрдые вещества, они отличаются между собой окраской и растворимость в воде.
Ещё в начале XIX в. шведский химик Й. Берцелиус сформулировал определение солей как продуктов реакций кислот с основаниями, или соединений, полученных заменой атомов водорода в кислоте на металл. По этим признакам соли делят на средние, кислые и основные.
Соли реагируют с кислотами, но только в том случае, если образуется осадок, или выделяется газ. Этот тип реакций относится к реакциям обмена. Проведём эксперимент. В одну пробирку нальем силиката натрия и серной кислоты, во вторую – карбонат натрия и азотную кислоту, а в третью нитрат натрия и серную кислоту. В результате у нас получается, что в первой пробирке выпал студенистый осадок, во второй пробирке мы можем наблюдать выделение газа, а в третьей изменений нет. Следовательно, химические реакции прошли только в двух пробирках.
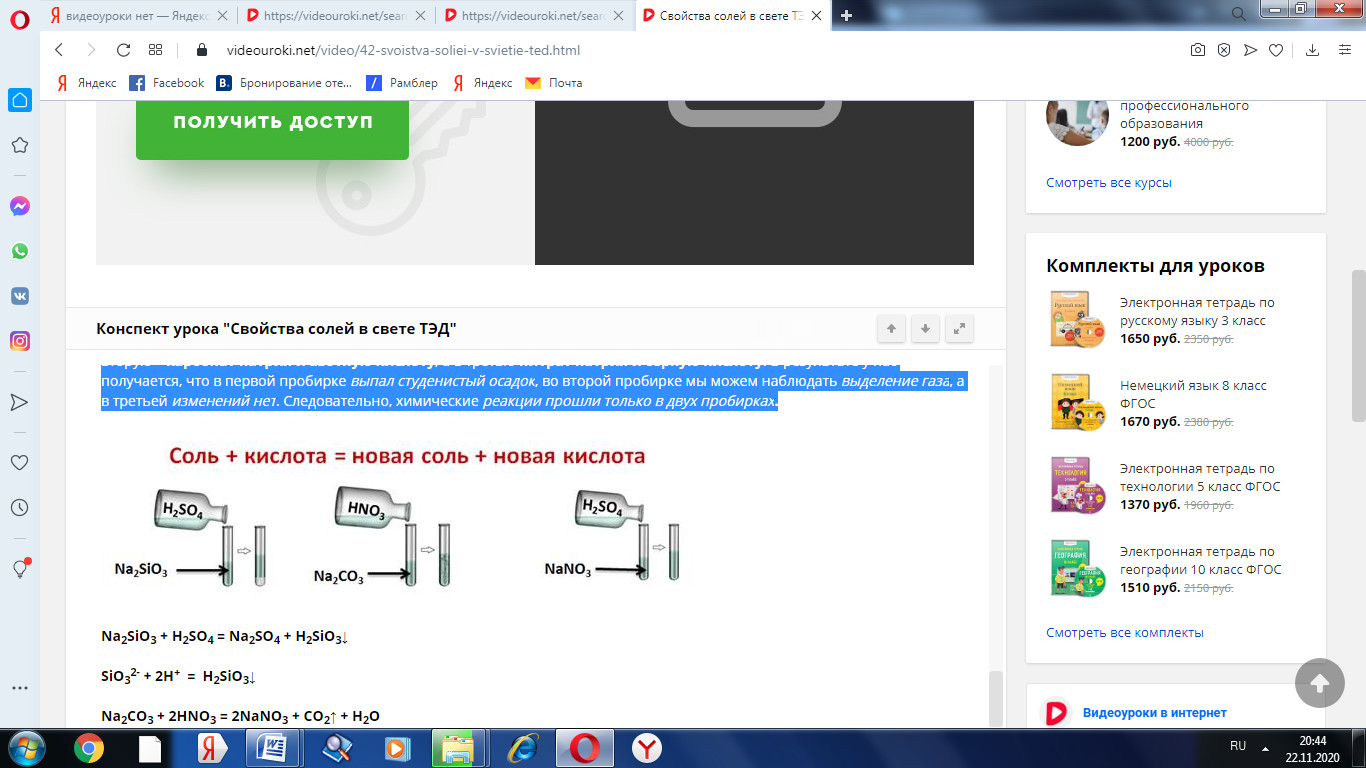
Na2SiO3 + H2SO4 = Na2SO4 + H2SiO3↓
SiO32- + 2H+ = H2SiO3↓
Na2CO3 + 2HNO3 = 2NaNO3 + CO2↑ + H2O
CO32- + 2H+ = CO2↑ + H2O
NaNO3 + H2SO4 ≠
Соли вступают в реакции обмена со щелочами, при этом образуется новая соль и новое основание. Для этого нальём в первую пробирку раствор сульфата железа (III) и добавим гидроксида натрия, во вторую сульфата аммония и гидроксида калия, слегка нагреем содержимое пробирки, а в третью нальём раствор нитрата бария и добавим гидроксида калия. В первой пробирке мы наблюдаем осадок бурого цвета, во второй пробирке образуется газ с резким запахом, в третьей пробирке изменений не наблюдаем. Поэтому, можно говорить о том, что соли реагируют с основаниями в том случае, если образуется слабое основание или нерастворимое в воде основание.
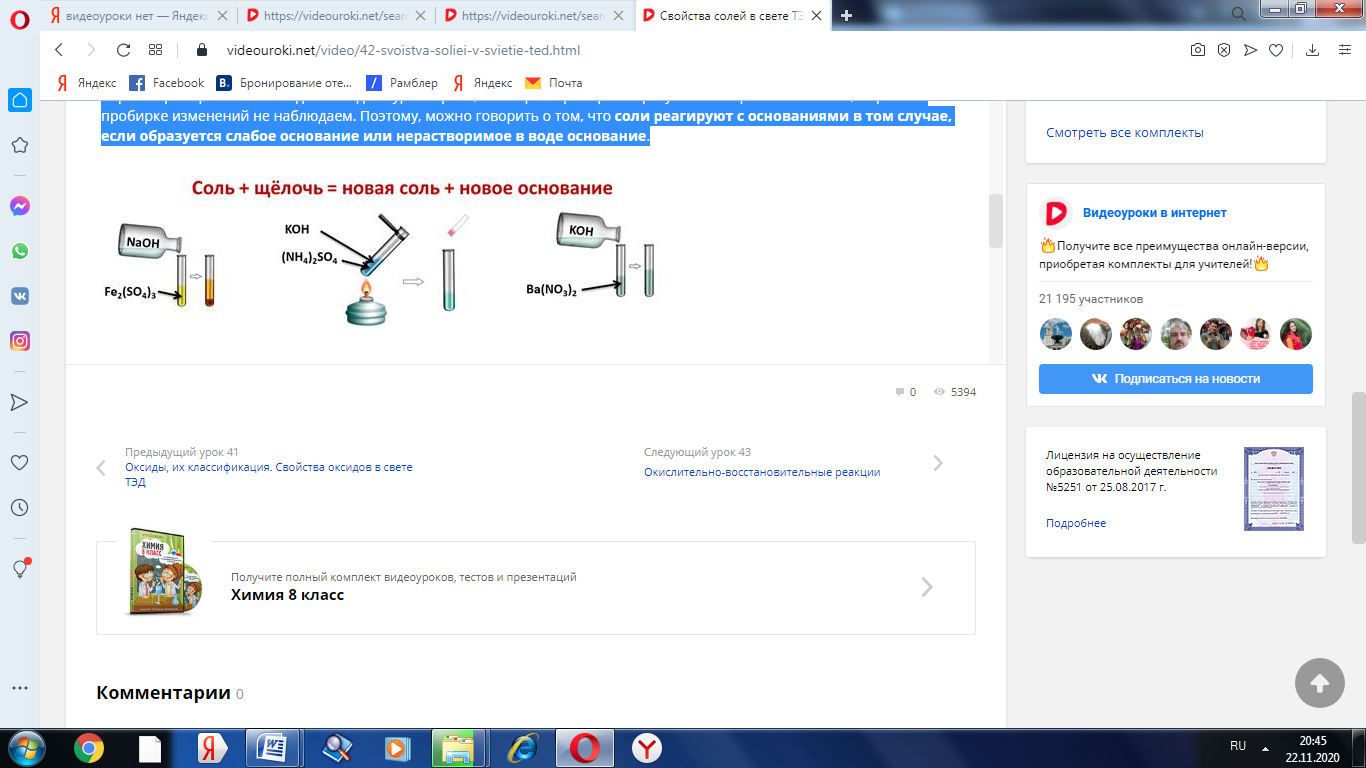
Fe2(SO4)3 + 6NaOH = 2Fe(OH)3↓ + 3Na2SO4
Fe3+ + 3OH- = Fe(OH)3↓
(NH4)2SO4 + 2KOH = K2SO4 + 2NH3↑ + 2H2O
NH4+ + OH- = NH3↑ + H2O
Ba(NO3)2 + KOH ≠
Соли могут реагировать между собой. Эти реакции относятся к реакциям обмена. При этом образуется две новые соли, одна из них должна быть нерастворимой. Например, если мы к раствору хлорида бария добавим раствор сульфата натрия, то у нас образуется осадок белого цвета. Т.о. в результате данной реакции образовалось две соли, причём одна выпадает в виде осадка.
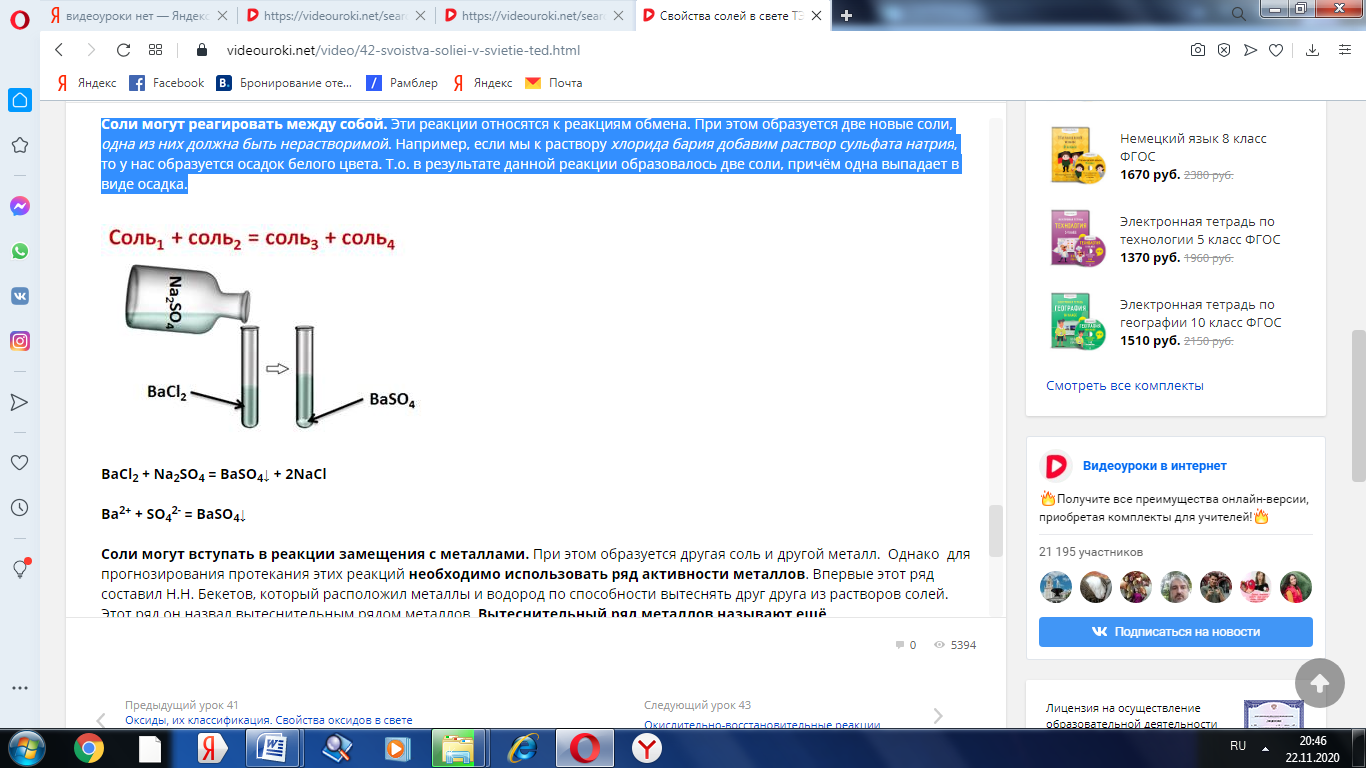
Соли могут вступать в реакции замещения с металлами. При этом образуется другая соль и другой металл. Однако для прогнозирования протекания этих реакций необходимо использовать ряд активности металлов. Впервые этот ряд составил Н.Н. Бекетов, который расположил металлы и водород по способности вытеснять друг друга из растворов солей. Этот ряд он назвал вытеснительным рядом металлов. Вытеснительный ряд металлов называют ещё электрохимическим рядом напряжений металлов. Более активные металлы находятся вначале ряда, а неактивные – в конце. Поэтому, этот вытеснительный ряд металлов используют для определения протекания реакций между солями и металлами. Каждый металл вытесняет из раствора соли металлы, расположенные правее его в ряду напряжений. При этом должны соблюдаться условия: обе соли (и реагирующая, и образующаяся) должны быть растворимыми, металлы не должны реагировать с водой (т.е. щелочные и щелочноземельные металлы, которые реагируют с водой с образованием щелочей).
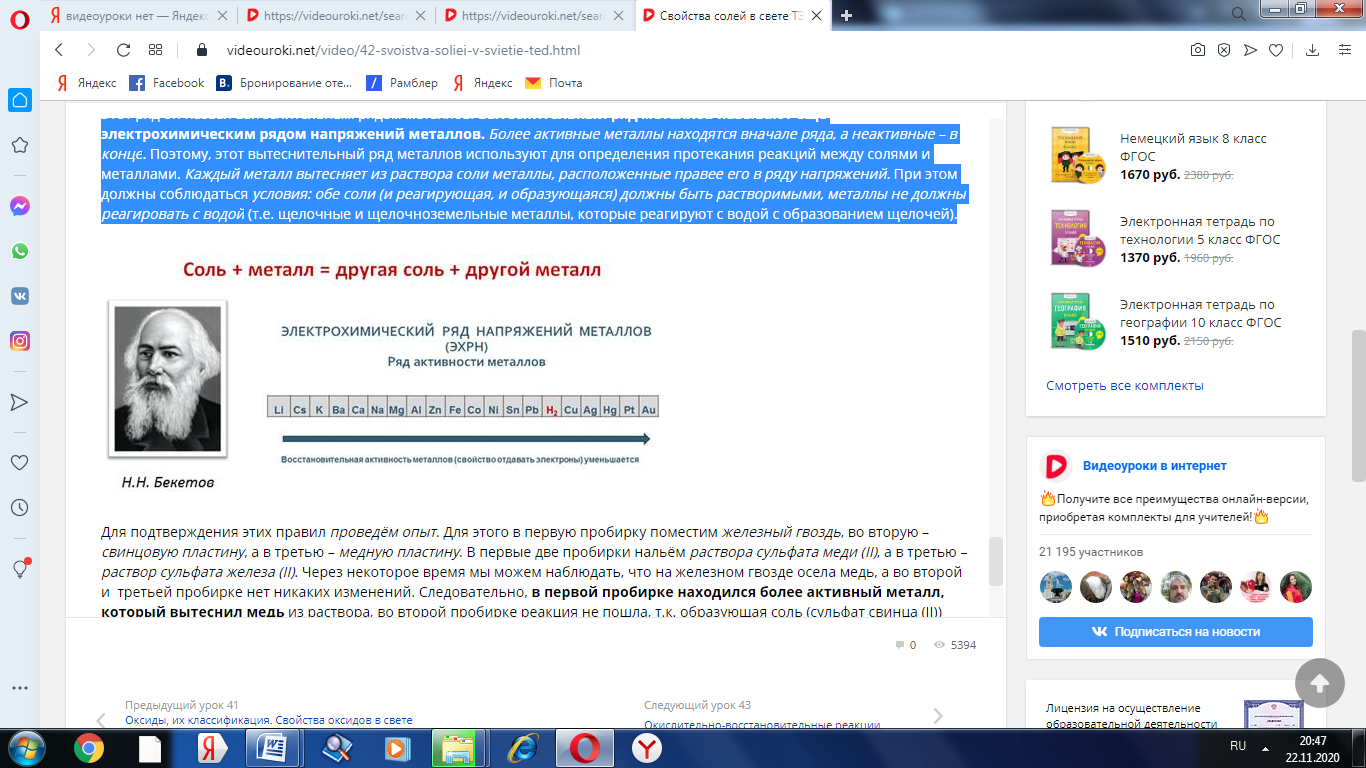
Для подтверждения этих правил проведём опыт. Для этого в первую пробирку поместим железный гвоздь, во вторую – свинцовую пластину, а в третью – медную пластину. В первые две пробирки нальём раствора сульфата меди (II), а в третью – раствор сульфата железа (II). Через некоторое время мы можем наблюдать, что на железном гвозде осела медь, а во второй и третьей пробирке нет никаких изменений. Следовательно, в первой пробирке находился более активный металл, который вытеснил медь из раствора, во второй пробирке реакция не пошла, т.к. образующая соль (сульфат свинца (II)) является нерастворимой, в третьей пробирке реакция не прошла, т.к. медь стоит правее железа в ряду напряжений и не может вытеснить его из раствора соли.
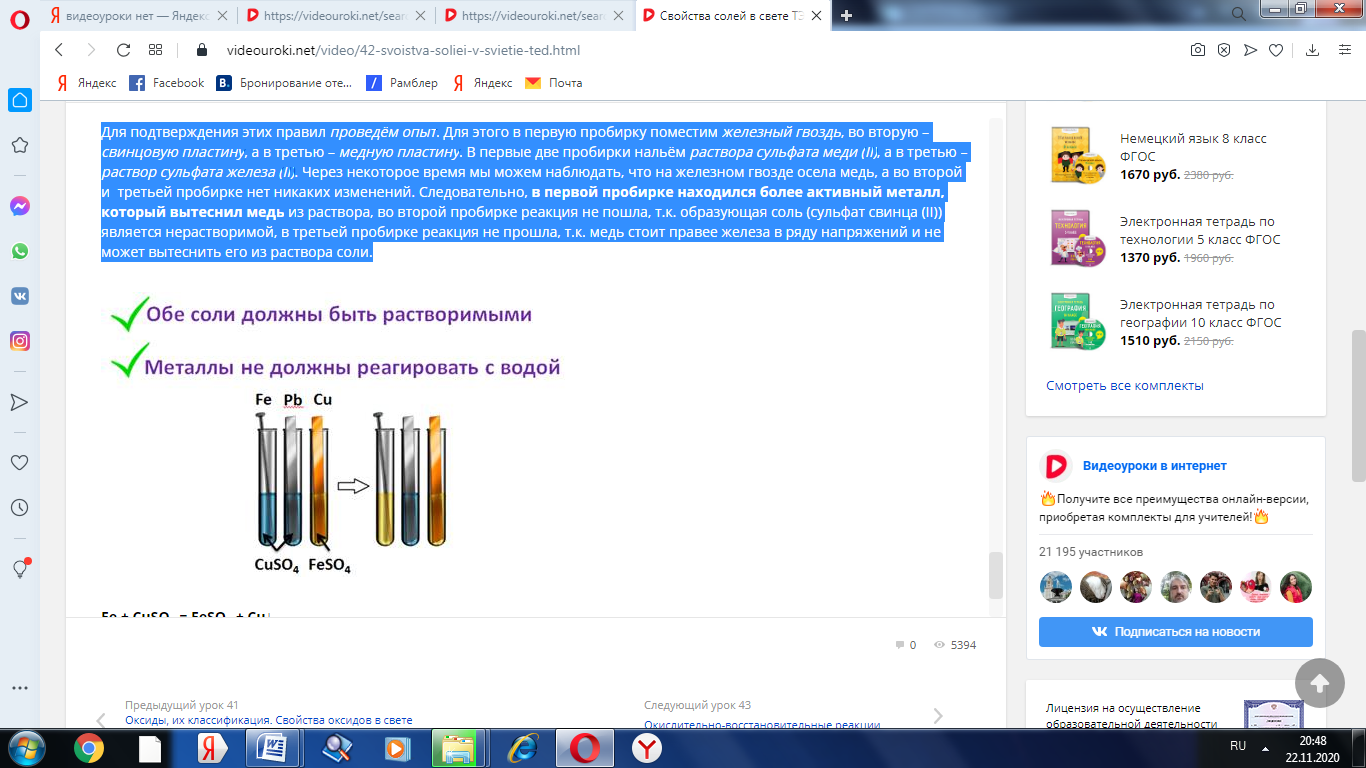
Fe + CuSO4 = FeSO4 + Cu↓
Fe0 + Cu2+ = Fe2+ + Cu0↓
Pb + CuSO4 ≠
Cu + FeSO4 ≠
| Тренировочные задания |
Задание 1. В пробирку с раствором соли Х добавили несколько капель раствора вещества Y. В результате реакции наблюдали выделение бесцветного газа. Из предложенного перечня выберите вещества X и Y, которые могут вступать в описанную реакцию.
1) KOH 2) HCl 3) Cu(NO3)2 4) K2SO3 5) Na2SiO3
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам:
| X | Y |
Решение.
Указанные вещества вступают в реакцию
K2SO3 + 2HCl = KCl + H2O + SO2↑
Здесь Х — K2SO3, а Y — HCl.
Задание 2. В пробирку с раствором соли Х добавили несколько кусочков металла Y. В результате реакции наблюдали растворение кусочков металла Y и выделение другого металла. Из предложенного перечня выберите вещества X и Y, которые могут вступать в описанную реакцию.
1) 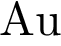 2)
2) 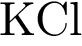 3)
3) 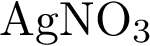 4)
4) 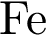 5)
5) 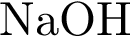
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам:
| X | Y |
Решение.
Указанные вещества вступают в реакцию
2AgNO3 + Fe = Fe(NO3)2 +2Ag↓
Здесь Х — AgNO3, а Y — Fe.
Задания
1. В пробирку с раствором соли Х добавили несколько капель раствора вещества Y. В результате реакции наблюдали выделение бесцветного газа.Из предложенного перечня выберите вещества X и Y, которые могут вступать в описанную реакцию.
1) KOH 2) HCl 3) Cu(NO3)2 4) K2SO3 5) Na2SiO3
2. В пробирку с раствором соли Х добавили несколько кусочков металла Y. В результате реакции наблюдали растворение кусочков металла Y и выделение другого металла. Из предложенного перечня выберите вещества X и Y, которые могут вступать в описанную реакцию.
1) 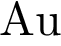 2)
2) 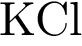 3)
3) 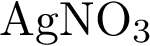 4)
4) 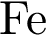 5)
5) 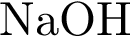
3. В пробирку с раствором соли Х добавили несколько кусочков металла Y. В результате реакции наблюдали растворение кусочков металла Y и выделение другого металла. Из предложенного перечня выберите вещества X и Y, которые могут вступать в описанную реакцию.
1) 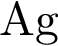 2)
2) 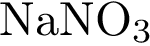 3)
3) 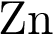 4)
4) 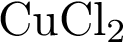 5)
5) 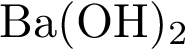
4. В пробирку с раствором соли Х добавили несколько кусочков металла Y. В результате реакции наблюдали растворение кусочков металла Y и выделение другого металла. Из предложенного перечня выберите вещества X и Y, которые могут вступать в описанную реакцию.
1) 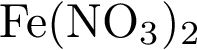 2)
2) 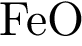 3)
3) 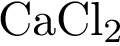 4)
4) 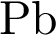 5)
5) 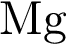
5. В пробирку с раствором соли Х добавили несколько кусочков металла Y. В результате реакции наблюдали растворение кусочков металла Y и выделение другого металла. Из предложенного перечня выберите вещества X и Y, которые могут вступать в описанную реакцию.
1) 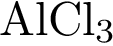 2)
2) 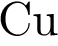 3)
3) 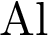 4)
4) 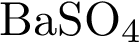 5)
5) 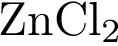
6. В пробирку с раствором соли соляной кислоты Х добавили раствор соли Y. В результате реакции наблюдали выпадение осадка. Из предложенного перечня выберите вещества X и Y, которые могут вступать в описанную реакцию. 1) 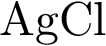 2)
2) 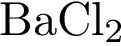 3)
3) 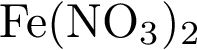 4)
4) 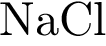 5)
5) 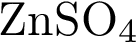
7. В пробирку с раствором соли Х добавили раствор Y. В результате реакции наблюдали выпадение осадка. Из предложенного перечня выберите вещества X и Y, которые могут вступать в описанную реакцию.
1) 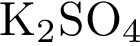 2)
2)  3)
3) 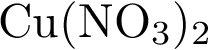 4)
4) 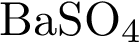 5)
5) 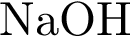
8. В пробирку с раствором соли серной кислоты Х добавили раствор соли Y. В результате реакции наблюдали выпадение осадка. Из предложенного перечня выберите вещества X и Y, которые могут вступать в описанную реакцию. 1) 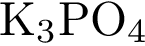 2)
2) 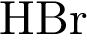 3)
3) 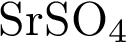 4)
4) 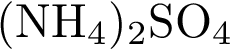 5)
5) 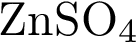
9. В пробирку с раствором кислоты Х добавили раствор Y. В результате реакции наблюдали выпадение осадка. Из предложенного перечня выберите вещества X и Y, которые могут вступать в описанную реакцию.
1) 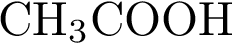 2)
2) 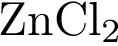 3)
3) 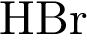 4)
4) 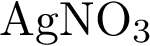 5)
5) 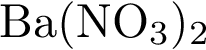
10. В пробирку с раствором галогенида Х добавили раствор Y. В результате реакции наблюдали выпадение осадка. Из предложенного перечня выберите вещества X и Y, которые могут вступать в описанную реакцию.
1) 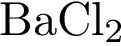 2)
2) 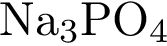 3)
3) 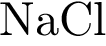 4)
4) 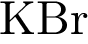 5)
5) 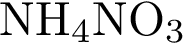
11. В пробирку с раствором соли Х добавили раствор Y. В результате реакции наблюдали выпадение осадка. Из предложенного перечня выберите вещества X и Y, которые могут вступать в описанную реакцию.
1) 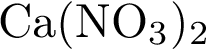 2)
2) 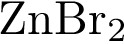 3)
3)  4)
4) 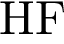 5)
5) 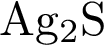
12. В пробирку с нерастворимым соединением Х добавили раствор Y. В результате реакции наблюдали растворение осадка. Из предложенного перечня выберите вещества X и Y, которые могут вступать в описанную реакцию. 1) 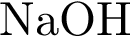 2)
2) 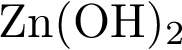 3)
3) 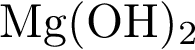 4)
4) 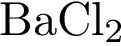 5)
5) 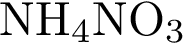
13. В пробирку с раствором соли Х добавили раствор Y. В результате реакции наблюдали выделение газа с резким запахом. Из предложенного перечня выберите вещества X и Y, которые могут вступать в описанную реакцию. 1) 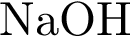 2)
2) 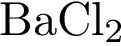 3)
3) 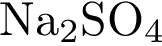 4)
4) 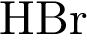 5)
5) 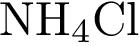
14. В пробирку с раствором соли Х добавили небольшое количество раствора Y. В результате реакции наблюдали образование осадка. Из предложенного перечня выберите вещества X и Y, которые могут вступать в описанную реакцию. 1) 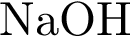 2)
2)  3)
3) 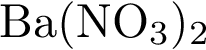 4)
4) 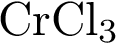 5)
5) 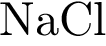
15. В пробирку с солью Х добавили раствор Y. В результате реакции наблюдали растворение Х и выделение газа. Из предложенного перечня выберите вещества X и Y, которые могут вступать в описанную реакцию.
1) 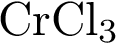 2)
2) 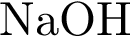 3)
3) 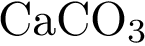 4)
4)  5)
5) 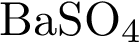
16. В пробирку с раствором кислоты Х добавили раствор Y. В результате реакции наблюдали выпадение осадка. Из предложенного перечня выберите вещества X и Y, которые могут вступать в описанную реакцию.
1) 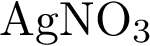 2)
2) 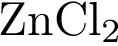 3)
3) 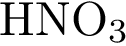 4)
4)  5)
5) 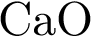
17. В пробирку с раствором соли Х добавили раствор Y. В результате реакции наблюдали выпадение осадка. Из предложенного перечня выберите вещества X и Y, которые могут вступать в описанную реакцию.
1)  2)
2) 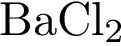 3)
3) 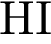 4)
4) 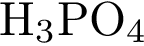 5)
5) 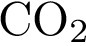
18. В пробирку с раствором основного гидроксида Х добавили раствор Y. В результате реакции наблюдали выпадение осадка. Из предложенного перечня выберите вещества X и Y, которые могут вступать в описанную реакцию.
1)  2)
2) 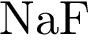 3)
3) 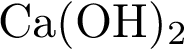 4)
4) 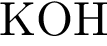 5)
5) 
19. В пробирку с нерастворимым соединением Х добавили раствор Y. В результате реакции наблюдали растворение осадка. Из предложенного перечня выберите вещества X и Y, которые могут вступать в описанную реакцию. 1) 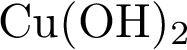 2)
2) 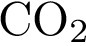 3)
3) 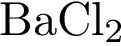 4)
4) 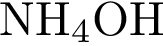 5)
5) 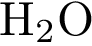
20. В пробирку с раствором соли Х добавили раствор Y. В результате реакции наблюдали выделение газа с резким запахом. Из предложенного перечня выберите вещества X и Y, которые могут вступать в описанную реакцию. 1) 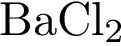 2)
2) 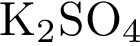 3)
3) 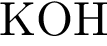 4)
4) 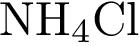 5)
5) 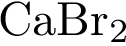
21. В пробирку с раствором соли Х добавили небольшое количество раствора Y. В результате реакции наблюдали образование осадка. Из предложенного перечня выберите вещества X и Y, которые могут вступать в описанную реакцию. 1)  2)
2) 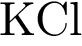 3)
3) 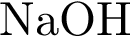 4)
4) 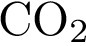 5)
5) 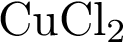
22. В пробирку с солью Х добавили раствор Y. В результате реакции наблюдали растворение Х и выделение газа. Из предложенного перечня выберите вещества X и Y, которые могут вступать в описанную реакцию.
1) 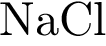 2)
2) 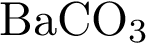 3)
3) 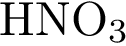 4)
4) 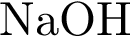 5)
5) 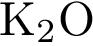
23. В пробирку с солью Х добавили несколько капель раствора вещества Y. В результате реакции наблюдали выделение бесцветного газа. Из предложенного перечня выберите вещества X и Y, которые могут вступать в описанную реакцию. 1) 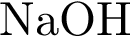 2)
2)  3)
3) 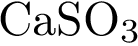 4)
4) 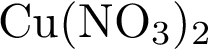 5)
5) 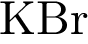
24. В пробирку с раствором соли Х добавили несколько кусочков металла Y. В результате реакции наблюдали растворение кусочков металла Y и выделение другого металла. Из предложенного перечня выберите вещества X и Y, которые могут вступать в описанную реакцию.
1) 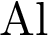 2)
2) 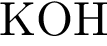 3)
3) 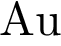 4)
4) 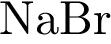 5)
5) 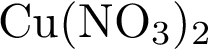
25. В пробирку с раствором соли Х добавили несколько кусочков металла Y. В результате реакции наблюдали растворение кусочков металла Y и выделение другого металла. Из предложенного перечня выберите вещества X и Y, которые могут вступать в описанную реакцию.
1) 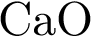 2)
2) 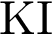 3)
3) 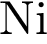 4)
4) 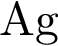 5)
5) 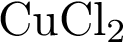
26. В пробирку с раствором соли Х добавили несколько кусочков металла Y. В результате реакции наблюдали растворение кусочков металла Y и выделение другого металла. Из предложенного перечня выберите вещества X и Y, которые могут вступать в описанную реакцию.
1) 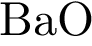 2)
2) 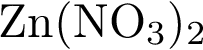 3)
3) 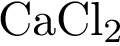 4)
4) 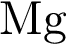 5)
5) 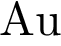
27. В пробирку с раствором соли Х добавили несколько кусочков металла Y. В результате реакции наблюдали растворение кусочков металла Y и выделение другого металла. Из предложенного перечня выберите вещества X и Y, которые могут вступать в описанную реакцию.
1) 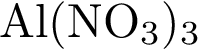 2)
2) 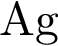 3)
3) 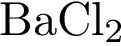 4)
4) 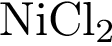 5)
5) 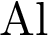
28. В пробирку с раствором соли соляной кислоты Х добавили раствор соли Y. В результате реакции наблюдали выпадение осадка.Из предложенного перечня выберите вещества X и Y, которые могут вступать в описанную реакцию.1) 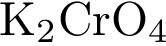 2)
2) 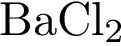 3)
3) 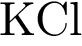 4)
4) 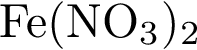 5)
5) 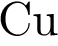
29. В пробирку с раствором соли Х добавили раствор Y. В результате реакции наблюдали выпадение осадка. Из предложенного перечня выберите вещества X и Y, которые могут вступать в описанную реакцию.
1) 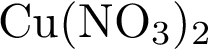 2)
2)  3)
3) 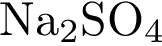 4)
4) 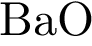 5)
5) 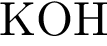
30. В пробирку с раствором соли серной кислоты Х добавили раствор соли Y. В результате реакции наблюдали выпадение осадка. Из предложенного перечня выберите вещества X и Y, которые могут вступать в описанную реакцию. 1) 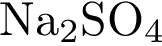 2)
2) 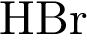 3)
3)  4)
4) 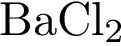 5)
5) 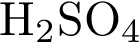
31. В пробирку с раствором кислоты Х добавили соль Y. В результате реакции наблюдали выпадение осадка и выделение газа. Из предложенного перечня выберите вещества X и Y, которые могут вступать в описанную реакцию. 1) 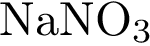 2)
2) 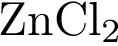 3)
3) 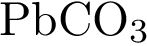 4)
4)  5)
5) 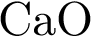
32. В пробирку с раствором кислоты Х добавили соль Y. В результате реакции наблюдали выпадение осадка и выделение газа. Из предложенного перечня выберите вещества X и Y, которые могут вступать в описанную реакцию. 1)  2)
2) 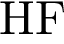 3)
3) 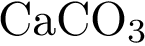 4)
4) 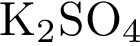 5)
5) 
33. В пробирку с нерастворимым соединением Х добавили раствор Y. В результате реакции наб