Задание
1. Конспект по теме «Алкены»
2. Практическая работа № 3
Алкены
Цель: изучить строение, номенклатуру, способы получения, физические и химические свойства, применение алкенов
План лекции
1. Строение алкенов
2. Способы получения
3. Физические свойства
4. Химические свойства
5. Применение
Алкены (непредельные углеводороды, этиленовые углеводороды, олефины) – непредельные алифатические углеводороды, молекулы которых содержат двойную связь. Общая формула ряда алкенов CnH2n.
По систематической номенклатуре названия алкенов производят от названий соответствующих алканов (с тем же числом атомов углерода) путем замены суффикса –ан на – ен: этан (СН3-СН3) – эт ен (СН2=СН2); пропан (СН3-СН2-СН3) - проп ен (СН2=СН-СН3) и т.д. Главная цепь выбирается таким образом, чтобы она обязательно включала в себя двойную связь (т.е. она может быть не самой длинной). Нумерацию углеродных атомов начинают с ближнего к двойной связи конца цепи. Цифра, обозначающая положение двойной связи, ставится обычно после суффикса –ен.
В молекуле алкена ненасыщенные атомы углерода находятся в sp2 -гибридизации, а двойная связь между ними образована s- и p-связью, sp2 -гибридные орбитали направлены друг к другу под углом 120°, и одна негибридизованная 2р-орбиталь расположена под углом 90° к плоскости гибридных атомных орбиталей.
Пространственное строение этилена:
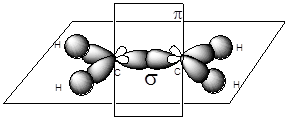
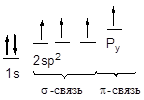
Длина связи С=С 0,134 нм,
энергия связи С=С ЕС=С = 611 кДж/моль, энергия p-связи Еp = 260 кДж/моль.
Виды изомерии: а) изомерия цепи; б) изомерия положения двойной связи; в) межклассовая изомерия с циклоалканами; г) геометрическая (цис-, транс-изомерия)
Способы получения
1. CH3-CH3 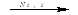 CH2=CH2 + H2 (дегидрирование алканов)
CH2=CH2 + H2 (дегидрирование алканов)
2. C2H5OH 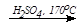 CH2=CH2 + H2O (дегидратация спиртов)
CH2=CH2 + H2O (дегидратация спиртов)
Физические свойства
Низшие члены гомологического ряда алкенов с С2Н4 до С4Н8 – газы, начиная с С5Н10 – жидкости, с С18Н36 – твёрдые вещества. Алкены практически нерастворимы в воде, но хорошо растворяются в органических растворителях.
Химические свойства
Для алкенов характерны, главным образом, реакции присоединения, приводящие к разрыву двойной связи. Большинство реакций протекает при 200С
Качественные реакции: обесцвечивание растворов Br2 и KMnO4 при 200С
1. CH2=CH2 + Br2 ®CH2Br-CH2Br (присоединение галогенов, качественная реакция)
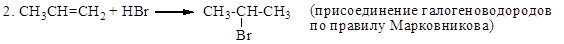
3. CH2=CH2 + H2 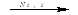 CH3-CH3 (гидрирование)
CH3-CH3 (гидрирование)
4. СH2=CH2 + H2O 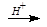 CH3СН2OH (гидратация)
CH3СН2OH (гидратация)
5. 3CH2=CH2 + 2KMnO4 + 4H2O ® 3CH2OH-CH2OH + 2MnO2¯ + 2KOH
(мягкое окисление, качественная реакция)
6. СН2=СН-СН2-СН3 + KMnO4 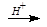 CO2 + C2H5COOH (жёсткое окисление)
CO2 + C2H5COOH (жёсткое окисление)
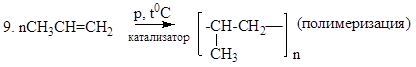
Применение
Алкены применяются в качестве исходных продуктов в производстве полимерных материалов (пластмасс, каучуков, плёнок) и других органических веществ.
Этилен (этен) Н2С=СН2 используется для получения полиэтилена, политетрафторэтилена (тефлона), этилового спирта, уксусного альдегида, галогенопроизводных и многих других органических соединений.
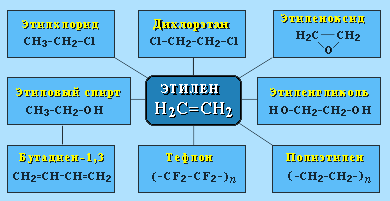
Применяется как средство для ускоренного созревания фруктов
Практическая работа № 3 «Изомерия, генетическая связь алканов, алкенов»
Цель: закрепить теоретический материал о изомерии, химических свойствах алканов, алкенов
Методические указания
Алканы – это предельные углеводороды с простыми δ – связями. У алканов один вид изомерии – структурная изомерия (разветвление углеродной цепочки). Для алканов характерны реакции замещения, разложения, изомеризации, горения, окисления.
Алкены – это непредельные углеводороды с одной двойной связью У алкенов несколько видов изомерии: структурная изомерия (разветвление углеродной цепочки, разное положение двойной связи), геометрическая (цис-, транс-изомерия), межклассовая изомерия с циклоалканами. Для алкенов характерны реакции присоединения, полимеризации, горения
Пример 1: составить структурные формулы изомеров для вещества состава С4Н10 и назвать их по систематической номенклатуре.
1) СН3 – СН2 – СН3 н – бутан
2) СН3 – СН – СН3 2-метилпропан
|
СН3
Пример 2: составить структурные формулы изомеров для вещества состава С4Н8 и назвать их по систематической номенклатуре
1) СН2 = СН – СН2 – СН3 бутен – 1 2) СН3 – СН = СН – СН3 бутен - 2
3) СН2 = С – СН3 2-метилпропен-1
|
СН3
Возможны ещё геометрические и межклассовые изомеры
Пример 3: осуществить превращения:
СН4 → СН3Сl → C2H6 → C2H4 → C2H5OH
1) CH4 + Cl2 → СН3Сl + HCl
2) СН3Сl + СН3Сl + 2Na → C2H6 + 2NaCl
3) C2H6 → C2H4 + H2
4) C2H4 + H2O → C2H5OH