Вопрос
Массовая доля вещества
Массовая доля обозначается греческой буквой "омега" и равна отношению массы растворенного вещества к общей массе раствора
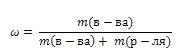
Выражают обычно в массовых долях или процентах (для этого в формуле правую часть домножают на 100%).
Молярная концентрация
показывает, сколько моль вещества содержится в 1 литре (1000 мл.) раствора. Обозначается См. Единица измерения - [моль/л] (часто пишут просто М) 
где n - количество вещества в молях, V - объём раствора, m - масса вещества, Mr - молярная масса вещества.
Моляльная концентрация
число молей растворенного вещества в 1 килограмме (1000 г.) расторителя. Единица измерения - [моль/кг]

Нормальная концентрация
это число эквивалентов в 1 литре раствора. Обозначают символом Сн
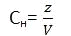
0,1 нормальный раствор - децинормальный.
Титр
количество вещества (в граммах), растворённое в 1 мл. раствора. Различают титр по растворённому веществу (например, титр раствора соляной кислоты — THCl) или титр по определяемому веществу (например, титр раствора соляной кислоты по едкому натру — THCl/NaOH)

где Т - титр в г/мл, Р - масса навески, V - объём мерной колбы.
Вопрос
Приготовление раствора
· Используя фиксоналы
· разбавлением концентрированного раствора до нужной концентрации
· Приготовление раствора по навеске вещества
В этом случаи возможны 2 вариант:
если вещество по своему составу отвечает своей формуле, устойчиво при хранении(как в сухом виде, так и в растворе), то из такого вещества готовят раствор методом точной навески. Раствор приготовленный по точной навеске называется первичным стандартом
если вещество химически активное, поглощающее из вохдуха влагу и газы, то она всегда имеет примеси и готовить по методу стандартной навески нельзя. НА практике поступают так, берут навеску вещества несколько больше рассчитанной, после этого раствор готовят как указано выше. Далее такой раствор титруют стандартным раствором, приготовленным по точной навеске. По данным титрования определяют точную концентрацию вещества в исследуемом растворе. После этого раствор становится вторичным стандартом.
Вопрос
Теория электролитической диссоциации – при расстворении в воде электролиты распадаются на положительные и отрицательные ионы. Положительные – катионы, отрицательные – аноны
HCL = H+ + Cl-
Электролиты являются те вещества, которые проводят электрический ток
Молекулы электронов в водном растворе диссоциирует на ионы. Ионы – это атомы или группы атомов, несущих заряд. Процесс диссоциации электролитов идет по-разному. Количественной характеристикой этого процесса является степень р диссоциации a (альфа).
Степень электролитической диссоциации – это отношение числа молекул распавшихся в данном растворе на ионы, к общему числу молекул электролита.
Принято считать, что если a больше 30% - сильный электролит, если a меньше 3%, то слабый. К сильным электродитам относятся соли, сильные кислоты, щелочи. Э ти вещества распадаются на ионы полностью. К слабым электролитам относят органические кислоты, некоторые неорганические вещества(H2Co3, H2S)
Вопрос
Слабые электролиты — химические соединения, молекулы которых даже в сильно разбавленных растворах незначительно диссоциированны на ионы, которые находятся в динамическом равновесии с недиссоциированными молекулами. К слабым электролитам относится большинство органических кислот и многие органические основания в водных и неводных растворах.
Слабыми электролитами являются:
· почти все органические кислоты и вода;
· некоторые неорганические кислоты: HF, HClO, HClO2, HNO2, HCN, H2S, HBrO, H2CO3, H2SiO3, H2SO3 и др.;
· некоторые малорастворимые гидроксиды металлов: Fe(OH)3, Zn(OH)2 и др.
Вопрос 5
Закон разбавления Оствальда — соотношение, выражающее зависимость эквивалентной электропроводности разбавленного раствора бинарного слабого электролита от концентрации раствора:

Здесь 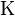 — константа диссоциации электролита,
— константа диссоциации электролита,  — концентрация,
— концентрация,  и
и  — значения эквивалентной электропроводности при концентрации
— значения эквивалентной электропроводности при концентрации  и при бесконечном разбавлении соответственно. Соотношение является следствием закона действующих масс и равенства
и при бесконечном разбавлении соответственно. Соотношение является следствием закона действующих масс и равенства

где  — степень диссоциации.
— степень диссоциации.
Закон разбавления Оствальда выведен В.Оствальдом в 1888 году и им же подтвержден опытным путём. Экспериментальное установление правильности закона разбавления Оствальда имело большое значение для обоснования теории электролитической диссоциации.
Вопрос 6
Диссоциация слабых растворов – обратимый процесс, к которому применим закон действия масс:
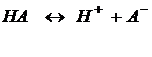

Константу равновесия процесса диссоциации называют константой диссоциации.
Если диссоциация слабого электролита протекает по ступеням, то каждая ступень диссоциации характеризуется своей константой:
1-я ступень: 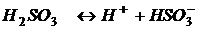
2-я ступень: 

При этом K1>K2, а Kсум = K1·K2
Константа диссоциации не зависит от концентрации и является строгой характеристикой электролита при данной температуре. Для слабых электролитов Kдисс< 104.
Рассмотрим процесс диссоциации электролита НА с концентрацией с
и степенью диссоциации  :
:

Согласно уравнению диссоциации:

Тогда

После подстановки полученных выражений в уравнение для константы диссоциации получим:

Так как  <<1, то её величиной в знаменателе можно пренебречь:
<<1, то её величиной в знаменателе можно пренебречь:
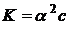
или

Полученное соотношение является математическим выражением закона разбавления Оствальда: степень диссоциации электролита возрастает при разбавлении раствора.
Вопрос
Ионное произведение воды. Водородный показатель. Согласно протолитической теории Брэнстеда и Лоури, вода не нейтральный растворитель. Ее молекула может быть донором и акцептором протонов, т.е. является амфолитом. Явление, когда молекулы одного и того же вещества одновременно выступают в качестве кислоты и основания, называются автопротолизом. Сокращенно автопротолиз воды можно записать как процесс ее диссоциации на ионы. Н2О↔Н + +ОН- 3 Применяя закон действующих масс, запишем константу диссоциации воды, значение которой можно вычислить по данным измерения электрической проводимости воды. Кд=[Н+ ]· [ОН- ]/[Н2О]=1,8·10-16 (при 22ºС) В знаменателе дроби - концентрация недиссоциированных молекул воды, которую можно считать постоянной и определить в 1 л, приняв массу 1л воды за 1000г. [Н2О]=1000/18=55,56молей, тогда Кд=([Н+ ]· [ОН- ])/55,56=1,8·10-16 Или [Н+ ]· [ОН- ]=1·10-14 моль-ион/л (ионное произведение воды или константа автопротолиза). Ионное произведение воды - произведение равновесных концентраций катионов водорода и гидроксид ионов, величина постоянная и равна 10-14 моль-ион/л. Кислотность растворов обычно выражают через концентрацию ионов Н +. В нейтральных растворах [Н+ ]=[ОН- ]=√10-14=10-7моль-ион/л. В кислых растворах [Н+ ]>10-7моль-ион/л, в щелочных [Н+ ]7.
Вопрос
Буфернымирастворами называются растворы, сохраняющиенеизменнымизначениярНприразбавленииилидобавлениинебольшогоколичествасильнойкислотыилиоснования. Протолитическиебуферныерастворыпредставляютсмесиэлектролитов, содержащиеодноимённыеионы.
Различают в основномпротолитическиебуферныерастворы двух типов:
Кислотные т.е. состоящие из слабой кислоты и избытка сопряженного с ней основания (соли, образованной сильным основанием и анионом этой кислоты). Например: СН3СООН и СН3СООNa - ацетатный буфер
СН3СООН + Н2О ↔ Н3О+ + СН3СОО- избытоксопряженного
Кислота основания
СН3СООNa → Na+ + CH3COO-(основания)
Основные, т.е. состоящиеизслабогооснования и избыткасопряженной с нимкислоты (т.е. соли, образованнойсильнойкислотой и катиономэтогооснования). Например: NH4OH и NH4Cl – аммиачныйбуфер.
NH3 + H2O ↔ OH- + NH4+ избыток сопряженной кислоты
Основание
NH4Cl → Cl- + NH4+(кислоты)
Вопрос
Это способность буферной системы противодействовать изменению рН среды.
Интервал значений рН, выше и ниже которого буферное действие прекращается, называется зоной буферного действия.
Она равна рН = рК ± 1
Буферная ѐмкость (В) выражается количеством моль-эквивалентов сильной кислоты или щелочи, которое следует добавить к одному литру буфера, чтобы сместить рН на единицу.
В = рН n рН pH n Э н к э
В – буферная ѐмкость,
nЭ – количество моль-эквивалента сильной кислоты или щелочи,
рНН – начальное значение рН (до добавления кислоты или щелочи)
рНК – конечное значение рН (после добавления кислоты или щелочи)
ΔрН – изменение рН.
На практике буферная ѐмкость рассчитывается по формуле:
В = рН V N V буф.
V – объѐм кислоты или щелочи,
N – эквивалентная концентрация кислоты или щелочи,
Vбуф.-объѐм буферного раствора,
Δ рН – изменение рН.
Буферная ѐмкость зависит от: концентрации электролитов и соотношения компонентов буфера.
Наибольшей буферной ѐмкостью обладают растворы с большей концентрацией компонентов и соотношением компонентов, равным единице.
Вопрос
Механизм действия буферных растворовкислотного типа рассмотрим на примереацетатной буферной системы СНЗСОО'/СН3СООН‚ в основе действия которой лежиткислотно-основное равновесие СНЗСООН нн" + снзсоа (ки = 115—105). Главныйисточник ацетат-ионов - сильный электролитСНЗСООМа. При добавлении сильной кислотысопряженное основание СНЗСОО' связываетдобавленные катионы водорода, превращаясьв слабую кислоту: СНЗСОО' + + Н+ ‹—›СН3СООН (кислотно-основное равновесиесмещается влево). Уменьшение концентрацииСН3СОО' уравновешивается повышениемконцентрации слабой кислоты и указывает напроцесс гидролиза. Согласно законуразведения Оствальда, увеличениеконцентрации кислоты несколько понижает еестепень электролитической диссоциации икислота практически не ионизирует.Следовательно, в системе: Ск увеличивается,Сс и о уменьшается, [Н+] - солей, Ск/Ссувеличивается, где Ск - концентрация кислоты,СС - концентрация соли, 0 – степеньэлектролитической ДИССОЦИЦИИ.
При добавлении щелочи катионы водородауксусной кислоты высвобождаются инейтрализуются добавленными ионами ОН",связываясь в молекулы воды: СН3СООН + ОН'—› СНЗСОО' + Н2О(кислотно-основное равновесие смещаетсявправо). Следовательно, Ск увеличивается, Сси о уменьшается, [Н+] - сопзт, Ск/Ссуменьшается.
11 вопрос
Механизм действия буферной системы рассмотрим напримере аммиачной буферной системы: МН4ОН (МНЗ х
Н2О) + МН4С1.Гидроксид аммония - слабый электролит, в растворечастично диссоциирует на ионы:МН40Н <=> МН4+ + ОН-
При добавлении к раствору гидроксида аммония хлоридааммония, соль как сильный электролит практически
полностью диссоциирует на ионы МН4С1 > МН4+ + С1- иподавляет диссоциацию основания, равновесие которогосмещается в сторону обратной реакции. Поэтому С (МН40Н)? С (основания); а С (МН4+)? С (соли).Если в буферном растворе С (МН4ОН) = С (МН4С1), то рН =14 - рКосн. = 14 + |9 1,8.10-5 = 9,25.
Способность буферных смесей поддерживать практическипостоянное значение рН раствора основана на том, чтовходящие в них компоненты связывают ионы Н+ и ОН-,вводимые в раствор или образующиеся в результатереакции, протекающей в этом растворе. При добавлении каммиачной буферной смеси сильной кислоты, ионы Н+будут связываться молекулами аммиака или гидроксидааммония, а не увеличивать концентрацию ионов Н+ иуменьшать рН раствора.При добавлении щелочи ионы ОН - будут связывать ионыМН4 +, образуя при этом малодиссоциированноесоединение, а не увеличивать рН раствора.Буферное действие прекращается, как только одна изсоставных частей буферного раствора (сопряженноеоснование или сопряженная кислота) полностьюизрасходуется.
12 вопрос
Бикарбонатный буфер. (относится к буферным растворам кислотного типа)
Он составляет 53 % буферной ѐмкости и представлен:
Н2СО3
NaHCO3 Соотношение 1: 20
Бикарбонатный буфер представляет собой основную буферную систему плазмы крови; он является системой быстрого реагирования, так как продукт его взаимодействия с кислотами СО2 – быстро выводится через легкие. Помимо плазмы, эта буферная система содержится в эритроцитах, интерстициальной жидкости, почечной ткани.
Механизм действия.
1. В случае накопления кислот в крови уменьшается количество НСО3- и происходит реакция: НСО3- + Н+ ↔ Н2СО3 ↔ Н2О + СО2↑. Избыток удаляется лѐгкими. Однако значение рН крови остаѐтся постоянным, так как увеличивается объѐмлѐгочной вентиляции, что приводит к уменьшению объѐма СО2
2.При увеличении щелочности крови концентрация НСО3- увеличивается: Н2СО3 + ОН- ↔ НСО3- + Н2О.
Это приводит к замедлению вентиляции лѐгких, поэтому СО2 накапливается в организме и буферное соотношение остаѐтся неизменным.
Вопрос
Гемоглобиновый буфер
Составляет 35 % буферной ёмкости.
Главная буферная система эритроцитов, на долю которой приходится около 75% всей буферной ёмкости крови. Участие гемоглобина в регуляции рН крови связано с его ролью в транспорте кислорода и СО2. Гемоглобиновая буферная система крови играет значительную роль сразу в нескольких физиологических процессах: дыхании, транспорте кислорода в ткани и в поддержании постоянства рН внутри эритроцитов, а в конечном итоге – в крови.
Она представлена двумя слабыми кислотами – гемоглобином и оксигемоглобином и сопряженными им основаниями – соответственно гемоглобинат- и оксигемоглобинат-ионами:
HHb ↔ H+ + Hb-
HHbO2 ↔ H+ HbO2-
Оксигемоглобин – более сильная кислота (рКа = 6,95), чем гемоглобин (рКа = 8,2). При рН = 7,25 (внутри эритроцитов) оксигемоглобин ионизирован на 65%, а гемоглобин – на 10%, поэтому присоединение кислорода к гемоглобину уменьшает значение рН крови, так как при этом образуется более сильная кислота. С другой стороны, по мере отдачи кислорода оксигемоглобином в тканях значение рН крови вновь увеличивается.
Буферные свойства ННb прежде всего обусловлены возможностью взаимодействия кислореагирующих соединений с калиевой солью гемоглобина с образованием эквивалентного количества соответствующей калийной соли кислоты и свободного гемоглобина:
КНb + Н2СО3 ↔ КНСО3 + ННb.
Образующийся гидрокарбонат (КНСО3) уравновешивает количество поступающей Н2СО3, рН сохраняется, так как происходит диссоциация потенциальных молекул Н2СО3 и образовавшихся гемоглобиновых кислот.
Именно таким образом поддерживается рН крови в пределах нормы, несмотря на поступление в венозную кровь огромного количества СО2 и других кислореагирующих продуктов обмена.
В капиллярах лёгких гемоглобин (ННb) поглощает кислород и превращается в HHbO2, что приводит к некоторому подкислению крови, вытеснению некоторого количества Н2СО3 из бикарбонатов и понижению щелочного резерва крови, а в тканях отдает его и поглощает СО2.
В лёгких: ННb + O2 ↔ HHbO2;
HHbO2 + HCO3- ↔ HbO2 + H2O + CO2 ↑
В тканях: HbO2 ↔ Hb- + O2; Hb- + Н2СО3 ↔ ННb + HCO3-
Кроме того, гемоглобиновый буфер является сложным белком и действует как белковый буфер.
14 вопрос
Фосфатный буфер (относится к буферным растворам кислотного типа)
Составляет 5 % буферной ѐмкости. Содержится как в крови, так и в клеточной жидкости других тканей, особенно почек. В клетках он представлен солями К2НРО4 и КН2РО4, а в плазме крови и в межклеточной жидкости Na2HPO4 и NaH2PO4. Функционирует в основном в плазме и включает: дигидрофосфат ион Н2РО4- и гидрофосфат ион НРО42-.
Отношение [HPO4 2- ]/[H2PO4-] в плазме крови (при рН = 7,4) равно 4: 1. Следовательно, эта система имеет буферную ѐмкость по кислоте больше, чем по основанию.
Например, при увеличении концентрации катионов Н+ во внутриклеточной жидкости, например, в результате переработки мясной пищи, происходит их нейтрализация ионами НРО4 2-:
Н + + НРО4 2- ↔ Н2РО4 1-
Образующийся избыточный дигидрофосфат выводится почками, что приводит к снижению величины рН мочи.
При увеличении концентрации оснований в организме, например при употреблении растительной пищи, они нейтрализуются ионами Н2РО4 1-:
ОН ‾ + Н2РО4 1- ↔ НРО4 2- + Н2О
Образующийся избыточный гидрофосфат выводится почками, при этом рН мочи повышается.
Выведение тех или иных компонентов фосфатной буферной системы с мочой, в зависимости от перерабатываемой пищи, объясняет широкий интервал значений рН мочи – от 4,8 до 7,5. Фосфатная буферная система крови характеризуется меньшей буферной ѐмкостью, чем гидрокарбонатная, из-за малой концентрации компонентов крови. Однако эта система играет решающую роль не только в моче, но и в других биологических средах – в клетке, в соках пищеварительных желез, в моче.
Вопрос
Белковый буфер
Белковая буферная система — главный внутриклеточный буфер. Он составляет примерно три четверти буферной ёмкости внутриклеточной жидкости.
Составляет 5% буферной ёмкости. Он состоит из белка-кислоты и его соли, образованной сильным основанием.
Pt-COOH-белок-кислота
Pt-COONa-белок-соль
1.При образовании в организме сильных кислот они взаимодействуют с солью белка. При этом получается эквивалентное количество булок-кислоты: HCl+Pt-COONaßàPt-COOH +NaCl.По закону разбавления В. Освальда увеличение концентрации слабого электролита уменьшает его диссоциацию, pH практически не меняется.
2. При увеличении щелочных продуктов они взаимодействуют с Pt-COOH:
NaOH+Pt-COOHßà Pt-Coona+H2O
Количество кислоты уменьшается. Однако концентрация ионов Н+ увеличивается за счёт потенциальной кислотности белок-кислоты, поэтому практически рН не меняется.
Белок-это амфотерный электролит и поэтому собственное буферное действие.
Вопрос

17 вопрос
Комплексными называются определенные молекулярные соединения, при сочетании компонентов которых образуются положительно или отрицательно заряженные ионы, способные к существованию, как в кристалле, так и в растворе. По Вернеру главной валентностью называется валентность посредством которой соединяются атомы с образованием простых соединений, подчиняющихся теории
валентности. Но, исчерпав главную валентность, атом способен, как правило, к дальнейшему присоединению за счет побочной валентности, в результате проявления которой и образуется комплексное соединение.
Под действием сил главной и побочной валентности атомы стремятся равномерно окружить себя ионами или молекулами и являются таким образом центром притяжения. Такие атомы называются центральными или комплексообразователями. Ионы или молекулы, непосредственно связанные с комплексообразователем, называются лигандами.
Посредством главной валентности присоединяются лиганды ионы, а посредством побочной валентности – ионы и молекулы.
Притяжение лиганд к комплексообразователю называется координацией, а число лиганд – координационным числом комплексообразователя.
Можно сказать, что комплексные соединения это соединения, молекулы которых состоят из центрального атома (или иона) непосредственно связанного с определённым числом других молекул или ионов, называемых лигандами.
В роли комплексообразователей чаще всего выступают катионы металлов (Со+3, Рt+4, Cr+3, Cu+2Au+3 и др.)
В качестве лигандов могут выступать ионы Cl-, CN-, NCS-, NO2-, OH-, SO42- так и нейтральные молекулы NH3, H2O, амины, аминокислоты, спирты, тиоспирты, РН3, эфиры.
Число координационных мест, занимаемых лигандом около комплексообразователя, называется его координационной ёмкостью или дентатностью.
Лиганды, присоединенные к комплексообразователю одной связью, занимают одно координационное месть и называются монодентатнымия (Cl-, CN-, NCS-). Если же лиганд присоединён к комплексообразователю посредством нескольких связей, то он является полидентатным. Например: SO42- , СО32-являются бидентатными.
Комплексообразователь и лиганды составляют внутреннюю сферу соединения или комплекс (в формулах комплекс заключают в квадратные скобки). Ионы, не связанные непосредственно с комплексообразвателем, составляют внешнюю координационную сферу.
Ионы внешней сферы связаны менее прочно по сравнению с лигандами и пространственно удалены от комплексообразователя. Они легко замещаются другими ионами в водных растворах.
Например, в соединении К3[Fe(CN)6] комплексообразователем является Fe+2, лигандами - CN-. Два лиганда присоединены за счет главной валентности, а 4 – за счет побочной валентности, следовательно координационное число равно 6.
Ион Fe+2 с лигандами CN- составляют внутреннюю сферу или комплекс, а ионы К+ внешнюю координационную сферу:
Как правило координационное число равно удвоенному заряду катиона металла, например: однозарядные катионы имеют координационное число равное 2, 2-х зарядные – 4, а 3-х зарядные – 6. если элемент проявляет переменную степень окисления, то с увеличением её координационное число растет. Для некоторых комплексообразователей координационное число является постоянным, например: Со+3, Рt+4, Cr+3 имеют координационное число равное 6, у ионов В+3, Ве+2, Сu+2 , Au+3 координационное число равно 4. для большинства ионов координационное число является переменным и зависит от природы ионов внешней сферы и от условий образования комплексов.
Вопрос
Комплексообразующая способность катионов определяется следующими факторами:
Заряд катиона, радиус катиона и электронная конфигурация катиона.
Чем больше заряд катиона и меньше радиус, тем прочнее связь комплексообразователя с лигандами. Поэтому катионы s- элементов (К+, Nа+, Са+2, Мg+2 и др.) обладающие относительно большим радиусом и малым зарядом, имеют низкую комплексообразующую способность. Катионы d-элементов (Со+3, Рt+4, Сr+3и др.), имеющие, как правило небольшой радиус и высокий заряд, являются хорошими комплексообразователями.
d-элементы имеют большое количество валентных орбиталей, среди которых имеются свободные орбитали и с неподелёнными электронными парами. Поэтому они одновременно могут быть и донорами и акцепторами. Если аналогичной возможностью обладает и лиганд, то одновременно с σ- связью (лиганд донор, а комплексообразователь является акцептором), образуюется и π-связь (лиганд акцептор, а комплексообразователь – донор). При этом происходит увеличение кратности связи, что обуславливает высокую прочность d- элементов со многими лигандами. Эта связь называется дативной связью.
Вопрос
Классификация и номенклатура комплексных соединений.
Классификация комплексных соединений проводится по различным признакам.
1. По заряду комплексного иона различают:
катионные [Cu(NH3)4]2
анионные [Co(NO3)6]3-
нейтральные [Pt(NH3)Cl2]0
2. По характеру лигандов различают:
акво- [Сu(H2O)4]SO4
аммино-[Cu(NH3)4]SO4
ацидо- К2[Cu(Cl)4]
гидроксо-K2[Cu(OH)4]
По структуре внутренней сферы различают внутрикомплексные(циклические) соединения. Например, в живом организме встречаются клешневидные (хелатные) пятичленные циклы. Они образуются катионом металла и ɑ-аминокислотами. К ним относятся гемоглобин, хлорофилл, витамин В12.
При составлении названия комплексных соединений руководствуются следующими правилами:
· Сначала называют внутреннюю сферу.
· Составные части её называют в следующей последовательности: лиганды анионы, лиганды – молекулы, комплексообразователь. Записывают формулу в обратной последовательности.
· К названиям лигандов – ионов добавляют окончание «о» (Сl—хлоро-, СN—циано-). Нейтральные молекулы сохраняют свои названия, за исключением Н2О – акво, NН3 – амин.
· Число лигандов указывают греческими числительными: ди, три-, тетра-, пента-, гекса- и т.д.
· В последнюю очередь называют ионы внешней сферы.
Пример: катионные –[Cu(NH3)4 ]SO4 – тетраамминокупрат (II) сульфат; анионные – Na3[Co(NO2)6] –гексанитрокобольтат (III) натрия; нейтральные [Pt(NH3)]Cl2 - дихлородиамминоплатина.
20 вопрос
1)Комплексные соли называются также как обычные - анион, потом катион
[Cr(NH3)6](NO3)3 - нитрат гексамминхрома(III)
2) Лиганды называются следующим образом:
нейтральные - как молекулы, кроме H2O - аква, NH3 - ам м ин;
анионы - суффикс “o” - хлор о, нитр о; сульфито; сульфато
катионы - суффикс “иум” - гидразиниум.
3) Порядок лигандов: сначала анионы, потом нейтральные молекулы, и наконец, катионы. Внутри каждой группы в порядке увеличения сложности.
[Pt(NH3)4(NO2)Cl]SO4 - сульфат хлоронитротетрамминплатины (IV) (NH4)[Cr(NH3)2(NCS)4] – тетраизотиоцианатодиамминхромат (III) аммония.
4) Числовые приставки - ди-,три-,тетра-,пента-,гекса- … Но если в названии лиганда присутствует уже диилитри-,(этилендиамин), для благозвучия договорились количество лигандов обозначатьбис-,трис-,тетракис-.
K3[Al(C2O4)3] - триоксалатоалюминат(III) калия, но
[Co(en)2Cl]SO4 - сульфатхлоро-бис-этилендиаминкобальта(III)
5) Окончания - анионные комплексы кончаются на -ат,как обычные анионы, катионные - как обычные катионы, нейтральные - как металл.
Сa2[Fe(CN)6] - гексацианоферрат(II) кальция,
[Fe(H2O)6]SO4 - сульфат гексаакважелеза(II),
[Ni(СО)4] - тетрокарбонилникель(II)
6) Степень окисления металла (высчитывается из общей электронейтральности всей молекулы комплексного соединения) - римские цифры в скобках. Но в комплексах бывают и необычные степени окисления металлов - 0, -1.Они пишутся арабскими цифрами.
Na[Co(CO)4] -тетракарбонилкобальтат(-1)натрия.
В зависимости от того сколько связей образует лиганд с центральным атомом различают монодентантные, би и полидентантые лиганды. Многие многоатомные лиганды способны образовывать координационную связь с комплексообразователем разными атомами. Такие лиганды получили названия амбидентантных. Например: анион NCS- способен образовывать связь азотом и серой.
Существует еще одна разновидность лигандов – мостиковые К таким лигандам могут относится частицы, имеющие несколько атомов доноров, либо
несколько донорных электронных пар в одном атоме: NCS-,I-,OH-,NH2- Такие лиганды связывают комплоексообразователи между собой.
Вопрос 21
В водных растворах комплексные соединения подвергаются диссоциации
[Cr(H2O)6]Cl3 = [Cr(H2O)6]3+ + Cl-
Наряду с этим комплексный ион так же подвергается распаду на составные части
[Cr(H2O)6]3+ = Сr3+ + 6H2O
Так как в этой системе наступает состояние динамического равновесия, то к нейприменим закон действующих масс:
| К р | Сr 3 H | O 6 | К нест 9.8 109 | ||
| Cr (H | 2 | ||||
| O) | |||||
Чем меньше значение константы нестойкости, тем прочнее комплекс.
Величина обратная константе нестойкости, называется константой устойчивости. Для большинства комплексов этих параметры определены и отображены в химических справочниках.
Осмос- процесс односторонней диффузии через полупроницаемую мембрану молекул растворителя в сторону большей концентрации растворенного вещества из объёма с меньшей концентрацией растворенного вещества.
Диффузия- процесс взаимного проникновения молекул или атомов одного вещества между молекулами или атомами другого, приводящий к самопроизвольному выравниванию их концентраций по всему занимаемому объёму.
По Вант-Гоффу осмотическое давление раствора численно равно тому газовому давлению, которое имело бы растворенное вещество, будучи переведенным в газообразное состояние в том же объеме и при той же температуре. Поскольку объем (разбавление) обратно пропорционален концентрации, то закон Вант-Гоффа можно записать в виде:
ЭНДОСМОС
просачивание более плотной жидкости в менее плотную через пористую перегородку; обратное явление - эксосмос.
РОЛЬ ОСМОСА В БИОСИСТЕМАХ
Плазмолиз- отделение протопласта от клеточной стенки в гипертоническом растворе.
Гемолиз-разрушение эритроцитов с выходом гемоглобина в окружающую эритроциты среду.
Тургор- внутреннее гидростатическое давление в живой клетке, вызывающее напряжение клеточной оболочки.
Гипотонический раствор- раствор, имеющий более низкое осмотическое давление, чем клеточный сок. Всасывание воды клеткой возможно только из гипотонических растворов. При погружении клетки в гипотонический раствор, происходит осмотическое проникновение воды внутрь клетки с развитием её гипергидратации — набухания с последующим цитолизом. Растительные клетки в данной ситуации повреждаются не всегда; при погружении в гипотонический раствор, клетка будет повышать тургорное давление, возобновляя своё нормальное функционирование.
Гипертонический раствор- раствор, имеющий бо́льшую концентрацию вещества по отношению к внутриклеточной. При погружении клетки в гипертонический раствор, происходит её дегидратация — внутриклеточная вода выходит наружу, что приводит к высыханию и сморщиванию клетки. Гипертонические растворы применяются при осмотерапии для лечения внутримозгового кровоизлияния.
Изотонический раствор- равенство осмотического давления в жидких средах и тканях организма, которое обеспечивается поддержанием осмотическиэквивалентных концентраций содержащихся в них веществ. Изотония — одна из важнейших физиологических констант организма, обеспечиваемых механизмами саморегуляции. Изотонический раствор — раствор, имеющий осмотическое давление, равное внутриклеточному. Клетка, погружённая в изотонический раствор, находится в равновесном состоянии — молекулы воды диффундируют через клеточную мембрану в равном количестве внутрь и наружу, не накапливаясь и не теряясь клеткой. Отклонение осмотического давления от нормального физиологического уровня влечёт за собой нарушение обменных процессов между кровью, тканевой жидкостью и клетками организма. Сильное отклонение может нарушить структуру и целостность клеточных мембран.
вопрос 16 (кратко)
Первый закон Рауля (1887 г). Выражает зависимость относительного понижения давления насыщенного пара растворителя от концентрации раствора неэлектролита. Относительное понижение давления насыщенного пара растворителя над раствором нелетучих веществ равно мольной доле растворенного вещества.
Сm(х) = P(z) - Р(y) = Δ Р(y)
P(z) P(z)
Жидкость закипает, кода давление насыщенного пара этой жидкости становится равным внешнему атмосферному давлению, и кристаллизуется, когда давление насыщенного пара жидкости становится равным давлению насыщенного пара твердой фазы этой жидкости (для воды – лед). Исходя из первого закона Рауля, становится очевидным, что присутствие растворенного вещества понижает температуру кристаллизации раствора и повышает температуру кипения раствора по сравнению с tкp и tкип чистого растворителя.
Второй закон Рауля определяет зависимость температуры кристаллизации и кипения раствора от концентрации растворенного вещества: Повышение температуры кипения и понижение температуры кристаллизации разбавленных идеальных растворов пропорциональны моляльной концентрации растворенного вещества. Δtкип = Ккип·Сm, Δtкp = Ккр·Сm.
Здесь Сm -моляльная концентрация раствора (моль/кг); Ккип - эбуллиоскопическая константа или константа кипения растворителя; Ккр - криоскопическая константа или константа кристаллизации растворителя.