План.
1) Общее представление о неметаллах. Инертные газы.
2) Особенности строения атомов галогенов, характерные валентности и степени окисления.
3) Особенности физических свойств
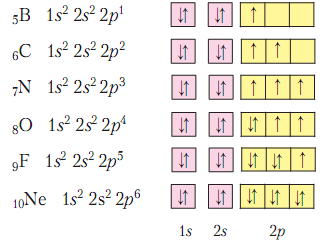 4) Особенности химических свойств (на примере хлора)
4) Особенности химических свойств (на примере хлора)
4) Нахождение в природе
5) Получение
6) Применение
7) Соединения хлора, их свойства и применение.
1. Общее представление о неметаллах. Все неметаллы относятся к р-элементам (кроме s-элементов водорода и гелия) и имеют наполовину или более заполненный внешний электронный слой (бор имеет три электрона, это исключение). Они обладают достаточно высокой ЭО и могут завершать внешний электронный слой за счет чужих электронов, т.е. у них в отличии от металлов может быть отрицательная степень окисления. В простых веществах между атомами неметалловза счет общих электронных пар образуются ковалентные неполярныесвязи. И вещества-неметаллы обычно имеют молекулярное строение. А если решетка молекулярная – то агрегатное состояние хотя и может быть разное, но температура плавления будет невысокая. Неметаллы имеют разнообразную окраску, разную плотность, в воде обычно плохо растворимы или практически не растворимы. Но нельзя забывать, что некоторые неметаллысклонны образовывать атомнуюкристаллическую решетку.И тогда это будут очень тугоплавкие и нерастворимые ни в чем вещества. Таких веществ с атомной решеткой очень немного. Особое положение среди неметаллов занимают инертные газы. Так называют элементы восьмой главной подгруппы. Они имеют завершенный внешний слой и не желают его терять, т.е. в химические реакции либо вступают при очень жестких условиях (ксенон, криптон, аргон) либо вообще не вступают (гелий и неон). Эти вещества обычно существуют в виде отдельных атомов, и имеют очень низкую температуру кипения и плаления. В небольшом количестве инертные газы входят в состав атмосферы и используются в технике в основном именно благодаря своей химической инертности.
2. Элементы – F, Cl, Br и I носят общее название галогены (рождающие соли). К ним же следует отнести и элемент № 85 – астат (At). Как видно из приводимых электронных структур, атомыгалогенов имеют 7 электронов во внешнем слое.
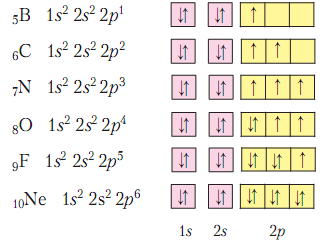
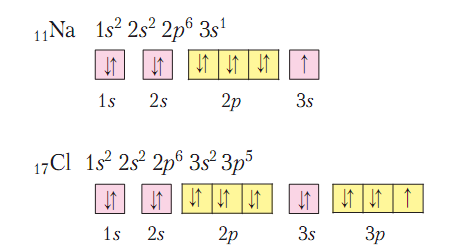
Основываясь на этом, можно наметить некоторые черты их химической характеристики: так как до устойчивой конфигурации внешнего слоя не хватает лишь по одному электрону, они обладают очень высокой ЭО, наиболее типичными для галогенов должны быть соединения с металлами и водородом, в которых они имеют степень окисления (-1) и одновалентны. Для фтора это единственно возможная степень окисления, т.к. он имеет максимальную электроотрицательность среди элементов, а значит никому свои электроны никогда не отдает. С другой стороны, у остальных галогенов (хлора, брома и иода) максимальная положительная степень окисления (+7), возможны и более низкие положительные степени окисления: +1, +3, +5. и валентность можно ожидать равной не только I, но и III, V, VII. Окислительные свойства у галогенов уменьшаются сверху вниз, т.к. увеличивается радиус атомов и ЭО тоже уменьшается.
2. Простые вещества, образованные элементами – галогенами имеют молекулярную кристаллическую решетку. Их молекулы двухатомны. Все галогены летучи и обладают резким запахом, ядовиты. В качестве средства первой помощи при острых отравлениях ими применяется вдыхание паров смеси спирта с эфиром. Полезно также вдыхание паров нашатырного спирта.Иод при нагревании обычно не плавится, а возгоняется. Так называют переход вещества из твердого состояния в газообразное. Пары галогенов тяжелее воздуха (см. молекулярную массу) и плохо растворимы в воде. Один объем воды растворяет около двух объемов хлора (или 0,7 г).Образующийся раствор часто называют «хлорной водой». Растворимостьброма в воде составляет около 3,5 г, а иода–0,03 г на литр. Гораздо лучше галогены растворяются в различных  органических растворителях.
органических растворителях.
| формула | молекулярная масса | агрегатное состояние и цвет | температура плавления | температура кипения |
| F2 | газ бесцветный | - 218 | -187 | |
| Cl2 | газ желто-зеленый | -101 | -34 | |
| Br2 | жидкость красно-бурая | -6 | ||
| I2 | кристаллы черно-фиолетовые |
4. Химические свойства.
Галогены обладают высокой ЭО и не очень прочной одинарной связью в молекуле.Поэтому для них характерны окислительные свойства. Эти окислительные свойства проявляются в реакциях с металлами и водородом.
Сl2 + Na → NaCl
Br2 + Mg → MgBr2
I2 + Al → AlI3
H2 + F2 = 2HF + 128 ккал
Н2 + Cl2 = 2HCl + 44 ккал
Н2 + I2 = 2HI - 53 ккал
Обратите внимание на тепловые эффекты реакций галогенов с водородом. Взаимодействиефтора с водородом сопровождается выделением очень большого количества тепла. Реакция протекает даже при сильном охлаждении газов и в темноте,обычно сопровождаетсявзрывом. Взаимодействие хлора с водородом при обычных условиях протекает крайне медленно, но при нагревании смеси газов или освещении прямым солнечным светом скорость взаимодействия увеличивается иреакция сопровождается взрывом. Взаимодействие иода с водородомпроисходит только при постоянном сильном нагревании и является обратимой (так как начинает идти обратная реакция – разложение иодоводорода).
Детальное изучение реакции образования хлороводорода позволило выяснить характер протекания ее отдельных стадий (т. н. механизм химической реакции). Прежде всего, за счет энергии ультрафиолетовых лучей (или нагревания) молекулахлора диссоциирует на атомы. Атомы хлора (свободные радикалы) реагируют с молекуламиводорода, образуется НСl и атомыводорода. Эти атомы водорода, в свою очередь, реагируютт с молекулойхлора, образуя НСl и атомхлора, и т. д. Весь процесс может быть изображен следующей схемой:
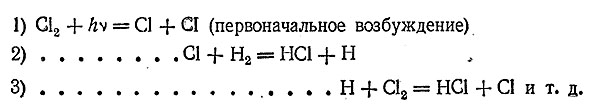
Таким образом получается, как бы цепь последовательных реакций, причем за счет каждой первоначально возбужденной молекулы Сl2 образуется до миллиона молекулНСl. Реакции подобного типа называются цепными. Они играют большую роль при протекании многих химических процессов.
Итак, окислительные способности хлора меньше, чем у фтора. Тем не менее химическая активность хлора очень велика - он непосредственно соединяется почти со всеми обычными металлами и со всеми неметаллами, кроме углерода, азота и кислорода. Бром и иод тоже являются весьма активными окислителями. Со многими металлами и некоторыми неметаллами (например, фосфором) они способны взаимодействовать при обычных температурах. При этом бром по активности не очень сильно уступает хлору, тогда как иод отличается от него уже очень значительно. Эта разница в окислительной способности галогенов используется для получения менее активных галогенов из их соединений. Например:
Cl2 + KI → KCl +I2 (т.е. более активные галогены вытесняют менее активные из их соединений)
Так как непосредственно с кислородомхлор (и другие галогены) не взаимодействует, его кислородные соединения могут быть получены лишь косвенными методами. Например, при растворении хлора в воде происходит реакция:
Сl2 + Н2О = НСl + НОСl
При обычных условиях в насыщенном растворе хлора около половины всего растворенного хлора превращается в кислоты. Из образующихся двух кислот – соляной и хлорноватистой (НОСl) –первая является очень сильной, а вторая – очень слабой (К =3 ·10–8).Аналогично протекают процессы взаимодействия брома с водой. Фтор в воде не растворяется, он окисляет воду со взрывом. А иод в воде растворим очень плохо и с ней практически не взаимодействует.
Подобным образом (реакция диспропорционирования) галогены могут взаимодействовать и со щелочами.
Cl2 + NaOH → NaCl + NaOCl – на холоду
Cl2 + KOH → KCl + KClO3 + H2O – при нагревании
4. Нахождение в природе.
Галогены в природе встречаются в виде солей, галогенидов.
Общее содержание фтора в земной коре составляет 0,02% по числу атомов. Основная масса фтора распылена по различным горным породам. Наиболее важен минералфлюорит (полевой шпат) – CaF2. По распространенности в природе хлор близок к фтору – на его долю тоже приходится 0,02% от общего числа атомов земной коры. Небольшие количества этого элемента входят в состав самых различных минеральных пород земной коры. Большинство соединений хлора хорошо растворимы. На протяжении многих миллионов лет вода разрушала горные породы и вымывала из них растворимые соединения, соединения хлоранакапливались в морях. Соленость морской воды в среднем 35%о (промилле - тысячные доли). Соленость средиземного моря 37-40%о, а Мертвого моря – 240%о. Высыхание водоемов привело к образованию во многих местах земного шара мощных залежей NaCl (каменная соль, галит) и менее мощных, но не менее важных КCl∙NaCl (сильвинит), которые и служат основным исходным сырьем для получения хлора. Содержание в земной коре брома составляет 3·10–5%, а иода 4·10–6%. По характеру распределения в природе оба элемента похожи на хлор, но образование скоплений для них не характерно. Основными источниками промышленного получения брома являются воды некоторых соляных озер и морская вода. Важным источником иода являются морские водоросли, зола которых содержит обычно до 0,5% I.
5. Получение.
Основным промышленным методом получения хлора является электролиз концентрированного водного раствора NaCl. При этом на аноде выделяется хлор (2Сl- – 2e- = Сl2), а в катодном пространстве выделяется водород (2Н+ + 2e– = H2) и образует NaOH.
При лабораторном получении хлора обычно пользуются действием КМnО4 на соляную кислоту:
2КМnО4 + 16НСl = 2КСl + 2МnСl2 + 5Сl2 + 8Н2 О
Для полученияброма и иода чаще всего пользуются реакцией вытеснениягалогенов из их солей свободным хлором, например:
MgBr2 + Сl2 = MgCl2 + Вr2
2KJ + Сl2 = 2КСl + J2
Применение.
Практическое использование фтора и его соединений широко развилось за последние годы. В промышленности используют раствор фтороводорода в воде, этот раствор называют плавиковой кислотой. Эта кислота не очень сильная, но она обладает уникальным свойством: взаимодействует с SiO2 (песок, кварц), который входит в состав стекла. Реакция идет по схеме:
SiO2 + 4HF = SiF4 + 2Н2 О
Поэтому фтороводород нельзя получать и сохранять в стеклянных сосудах. Обычно плавиковую кислоту хранят в бутылях из искусственных пластмасс, на которые HF не действует. Но большую часть фтора используют для фторированияорганических соединений (т. е. замены в них водорода на фтор). Эти органические соединения обладают рядом удивительных свойств (фреоны, тефлоны, перфтораны).
Общее мировое потребление хлора составляет десятки млн. т ежегодно. Используется хлор главным образом для отбеливания тканей и бумажной массы, обеззараживания питьевой воды (примерно 1,5 г на 1 м3), а в химической промышленности для получения разнообразных соединений хлора – органических и неорганических.
Ежегодная мировая добыча брома оценивается десятками тысяч тонн, иода – тысячами тонн. В виде 1% и 5%–ого спиртового раствораиод применяется в медицине. Соединения обоих тяжелых галоидов широко применяются в фотографии, медицине и т. д.