Фтор. Содержание в организме 10-5%, участвует в образовании костей и зубной эмали, его недостаток вызывает кариес, а избыток – флюороз. Избыток иона фтора парализует деятельность ряда ферментов, угнетает процессы обмена углеводов и жиров, тканевое дыхание, тормозит деятельность щитовидной железы. Фторид натрия используют при лечении тиреотоксикозов, эндемического зоба и т.д.
Хлор. Содержание в организме 10-2%, принимает участие в образовании буферных систем крови, в регуляции водно-солевого обмена. Соляная кислота стимулирует работу желудка и кишечника, оказывает противомикробное действие. Соляная кислота (8% водный раствор) используется при лечении некоторых заболеваний ЖКТ. 0,5% раствор гипохлорита натрия (NaClO) используют для орошения ран и как дезраствор. Хлорная известь (CaOCl2) – для дезинфекции помещений и инструмента. Растворы NaCl изотонические и гипертонические широко применяются в медицине.
Бром. Содержание в организме10-4%, больше всего его в почках, гипофизе, щитовидной железе; он ускоряет процессы торможения ЦНС; участвует в синтезе половых гормонов и регулирует функцию половых желёз. Его препараты в малых дозах восстанавливают равновесие процессов торможения и возбуждения в головном мозге. Применяют при эпилепсии, белой горячке, гипертонии...
Йод. Содержание в организме 10-4%, большая часть (~ 75%) находится в щитовидной железе, а остальная в крови, головном мозге, печени и т.д. Постоянная концентрация йода в крови – 10-5-10-6% называется «йодным зеркалом» организма. Основная биологическая роль – участвует в синтезе тироксина. Концентрация ионов иода влияет на концентрацию ионов натрия и калия, повышает активность половых гормонов, положительно влияет на фагоцитоз. Йод и его соединения широко используют в медицине. Спиртовой раствор (1%, 5%, 10%) имеет антисептическое, раздражающее, противовоспалительное действие. Используют для обработки рук, операционного поля, гнойничков на коже. Внутрь применяют иодид калия при заболеваниях щитовидной железы, при атеросклерозе, бронхиальной астме и бронхите. Электрофорез с иодидом калия назначают при гипертонии и воспалительных процессах.
 7. Соединения хлора.
7. Соединения хлора.
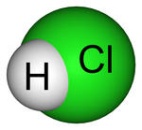
 Наиболее важным соединением хлора является хлороводород. Хлороводород представляет собой бесцветный газ (т. пл. –112°С, т. кип. –84 °С). В отсутствие влаги при обычных температурах он не проводит электрический ток и не действует на большинство металлов и их окислов, т.е. он не обладает кислотными и окислительными свойствами. Хлороводород - слабый восстановитель. Он хорошо растворяется в воде: при обычных условиях 1 объем воды способен поглотить до 450 объемов хлороводорода. РастворНСl в воде называется хлороводородной (соляной) кислотой. Концентрированная соляная кислота имеет плотность 1,19 и содержит около 37% хлороводорода. Соляная кислота относится к числу наиболее сильных кислот. Подобно другим сильным кислотам, НСl энергично взаимодействует со многими металлами, но окислителем металлов здесь выступает ион водорода. Например:
Наиболее важным соединением хлора является хлороводород. Хлороводород представляет собой бесцветный газ (т. пл. –112°С, т. кип. –84 °С). В отсутствие влаги при обычных температурах он не проводит электрический ток и не действует на большинство металлов и их окислов, т.е. он не обладает кислотными и окислительными свойствами. Хлороводород - слабый восстановитель. Он хорошо растворяется в воде: при обычных условиях 1 объем воды способен поглотить до 450 объемов хлороводорода. РастворНСl в воде называется хлороводородной (соляной) кислотой. Концентрированная соляная кислота имеет плотность 1,19 и содержит около 37% хлороводорода. Соляная кислота относится к числу наиболее сильных кислот. Подобно другим сильным кислотам, НСl энергично взаимодействует со многими металлами, но окислителем металлов здесь выступает ион водорода. Например:
Mg + HCl → MgCl2 + H2
Большинство хлоридов хорошо растворимо в воде. Практически нерастворим только хлорид серебра. Поэтому для определения соляной кислоты и ее солей используют нитрат серебра: Cl- + Ag+ → AgCl↓ (белый творожистый осадок)
Подобную реакцию можно провести и для бромоводородной и для иодоводородной кислот и их солей, только цвет осадка будет желтый.
Следует отметить еще одну особенность галогенидов серебра – они разлагаются под действием солнечного света с образованием свободного серебра. Именно этот процесс лежит в основе черно-белой фотографии.
Ежегодное мировое потребление соляной кислоты исчисляется миллионами тонн. Широкое практическое применение находят также многие ее соли (например: поваренная соль, сильвинит, каломель...).
| формула | название кислоты | название соли |
| HClO | хлорноватистая | гипохлориты |
| HClO2 | хлористая | хлориты |
| HClO3 | хлорноватая | хлораты |
| HClO4 | хлорная | перхлораты |
Хлор (а так же бром и иод) могут проявлять в соединения и положительные степени окисления. Например, в кислородных соединениях: оксидах, гидроксидах и их солях.
Возможные степени окисления: +1, +3,+5,+7.
Если сопоставить друг с другом кислородные кислотыхлора по важнейшим для них химическим свойствам – кислотности и окислительной активности, – то получается следующая схема:
Кажущийся парадокс (более высокая степень окисления хлора в хлорной кислоте и сравнительно низкая окислительная активность) объясняется не более высокими окислительными способностями Сl+1, а нестойкостью НОСl. Она существует только в растворах, на свету при комнатной температуре хлорноватистая кислота разлагается на НСl и атомарный кислород. Вот он то и является истинным окислителем в этом случае. И сама НОСl и ее соли являются поэтому очень сильными окислителями, они используются для дезинфекции.
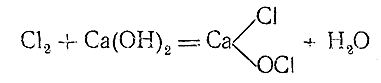 При взаимодействии хлора с дешевой щелочью – Са(ОН)2 – образуется так называемая хлорная известь. Реакция может быть приближенно выражена уравнением:
При взаимодействии хлора с дешевой щелочью – Са(ОН)2 – образуется так называемая хлорная известь. Реакция может быть приближенно выражена уравнением:
Хлорная (иначе, белильная) известь является смешанной солью соляной и хлорноватистой кислот,это белый порошок, обладающий сильными окислительными свойствами. Она применяется для беления и дезинфекции, а также служит одним из основных дегазаторов. Безводная НСlО4 малоустойчива и иногда взрывается даже просто при хранении. В продажу обычно поступает вполне устойчивый 72% раствор хлорной кислоты,НСlО4является самой сильной из всех известных кислот.