Строение атома
Атомное ядро.
Атом – мельчайшая, электронейтральная (не имеющая заряда), химически неделимая частица вещества, состоящая из положительно заряженного ядра и отрицательно заряженной электронной оболочки.
Электронная оболочка – совокупность движущихся вокруг ядра электронов.
Атомное ядро – центральная часть атома, состоящая из нуклонов – протонов и нейтронов, связанных между собой ядерными силами.
Протон р+ Нейтрон n0 Электрон е
Заряд частицы +1 0 -1
Масса частицы 1 а.е.м. 1 а.е.м. 1/1840 от массы протона
Заряд ядра атома соответствует атомному номеру элемента в периодической системе (Z).
Так как атом - электронейтральная частица, то число протонов должно быть равно числу электронов (число + = числу -):
N(e-) = N(p) = Z
Массовое число А – складывается из числа протонов и нейтронов в ядре данного атома. Тогда число нейтронов легко найти, вычитая заряд ядра атома из массового числа.
А = N(p) + N(n) N(n) = A – Z
Пример: определить число протонов и нейтронов в ядре атома мышьяка с массовым числом 75.
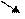 массовое число
массовое число
75
 заряд ядра атома 33 As
заряд ядра атома 33 As
Решение: порядковый номер у As – 33. Следовательно, заряд ядра Z= +33, число протонов – 33. Число нейтронов: A – Z = 75 – 33 = 42.
Химический элемент – вид атомов, с определённым зарядом ядра.
Природа устроена так, что один и тот же элемент может существовать в виде двух или нескольких изотопов.
Изотопы – атомы с одинаковым зарядом ядра, но разным массовым числом, т.е разным числом нейтронов в ядре.
Поскольку нейтроны практически не влияют на химические свойства элементов, все изотопы одного и того же элемента химически неотличимы.
Пример: изотопы углерода: 12С и 13С. Значит, они отличаются по составу на 1 нейтрон: у 12С – 6 нейтронов, у 14С – 7 нейтронов.
Водород имеет три изотопа: протий  Н, дейтерий
Н, дейтерий 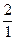 Н и тритий
Н и тритий 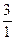 Н
Н
Электронное строение атома.
1). Электронная оболочка атома состоит из электронных слоев или уровней.
Номер периода, в котором находится атом данного химического элемента, показывает число энергетических слоев (уровней) в его атоме. Электронные уровни обозначаются целыми числами 1, 2,.., n, начиная от ближайшей к ядру.
2). Номер группы, в которой находится атом данного химического элемента, соответствует числу электронов на внешнем слое атома (это справедливо только для элементов главных подгрупп).
На внешнем слое атомов элементов побочных подгрупп находится почти всегда 2 электрона (по 1 электрону на внешнем слое у хрома, молибдена, меди, серебра и золота).
3). Максимальное количество электронов на уровне можно определить по формуле:
N=2n2 , где n – номер уровня, для которого мы делаем расчет, а N – максимально возможное число электронов на слое. В соответствии с этой формулой на 1 слое не может быть больше 2-х электронов, на 2-ом – более 8, на 3-ем – более 18 и т.д.
4). Если уровень содержит максимально возможное число электронов, его называю завершенным. Если меньше максимального, то незавершенным.
5). На внешнем слое атомов не может содержаться более 8-ми электронов (у атомов 1 периода – более 2-х).
6). Уровни, в свою очередь, могут состоять из близких по энергии подуровней. Их обозначают символами s, p, d, f.
Подуровни, в свою очередь, состоят из одинаковых по энергии орбиталей.