Марганец — элемент 4-го периода и VII B-группы Периодической системы, порядковый номер 25. Электронная формула атома [18Аr]Зd54s2; характерные степени окисления + VII,+ VI, +IV, +III, +II и 0.
Шкала степеней окисления марганца:
+7 — Mn2O7 , MnO4— ,HMnO4,KMnO4
+ 6 — MnO42-, K2MnO4
+4 — MnO2, Mn(SO4)2 ,MnF4,K3[MnF6]
+3 — Mn2O3, MnO(OH),Mn2(SO4)3 ,MnF3, K3[MnF6]
+ 2 — Mn2+, MnO, Mn(OH)2, MnSO4 ,MnCl2
0 — Mn
По электроотрицательности (1,60) марганец занимает промежуточное положение между типичными металлами (Na, К, Са, Мg) и неметаллами (F, O,N, Cl). Соединения Мn‖‖ — оксид и гидроксид — проявляют основные свойства, соединения Мn‖‖‖ и Мn IV — амфотерные свойства, для соединений МnVI и МnVII характерно почти полное преобладание кислотных свойств. Марганец образует многочисленные соли и бинарные соединения.
Пиролюзит (минерал марганца) был известен людям еще с древних времен, он использовался нашими предками для осветления стекла, получаемого варкой. До 1774 г. пиролюзит считали разновидностью магнитного железняка. И только в 1774 г. швед К. Шееле догадался, что в пиролюзите присутствует неизвестный тогдашней науке металл, после чего Ю. Ган получил металлический марганец, нагревая пиролюзит в печке с углем. Свое название «марганец» получил в начале 19 века (от немецкого Manganerz — марганцевая руда).
Марганец занимает 14-е место среди всех химических элементов по распространенности в земной коре. Больше всего марганца содержится в основных породах. Самостоятельные месторождения марганца крайне редки, чаще этот металл сопутствует железу во многих его рудах. Достаточно много марганца содержится в железо-марганцевых конкрециях, расположенных в донной части Мирового океана.
Минералы, богатые марганцем:
· пиролюзит - MnO2· n H2O
· манганит - MnO(OH)
· марганцевый шпат - MnCO3
· браунит - 3Mn2O3·MnSiO3
 Марганец Мn. Серебристо-белый (с серым оттенком) металл, более твердый и хрупкий по сравнению с железом. В виде мелкого порошка пирофорен. На воздухе покрывается оксидной пленкой. Пассивируется в воде, поглощает водород, но не реагирует с ним.
Марганец Мn. Серебристо-белый (с серым оттенком) металл, более твердый и хрупкий по сравнению с железом. В виде мелкого порошка пирофорен. На воздухе покрывается оксидной пленкой. Пассивируется в воде, поглощает водород, но не реагирует с ним.
При нагревании сгорает в кислороде воздуха, реагирует с хлором и серой:
Mn →(O2, до450oC) MnO2 →(O2, до 800oC) Mn2O3
Mn→ MnO+(MnIIMn2 II)O4 «окалина» (O2, выше 800oC)
Mn+Cl2→MnCl2, (200oC) Mn+S→ MnS (до1580oC)
В ряду напряжений марганец стоит левее водорода, из разбавленных кислот НCl и Н2SO4 вытесняет водород:
Мn (порошок) + 2Н+ = Мn2+ + Н2↑
Взаимодействует с кислотами-окислителями при нагревании, также образуя соли марганца (II):
Мn + 2Н2SO4 (конц.) = МnSO4 + SO2↑+ 2Н2O
3Мn + 8HNO3 (разб.) = 3Мn(NO3)2 + 2NO↑ + 4Н2O
Получение марганца в промышленности — восстановление пиролюзита МnO2 или гаусманита (МnIIMnIII)O4 коксом или алюминием:
МnO2 + С (кокс) = Мn + СO2 (600 °С)
3(МnII MnIII)O4 + 8Аl = 9 Мn + 4А12O3(700-900 °С)
Наиболее чистый марганец выделяют электролизом раствора из солей марганца (II), например:
2MnSO4+2H2O→ 2Mn↓+ O2↑+2H2SO4 (40oC, электролиз)
Промышленно важен сплав с железом — ферромарганец (> 70 % Мn), его получают восстановлением оксидных руд марганца и железа.
Применяется марганец для изготовления специальных и тугоплавких сплавов, зеркального чугуна и марганцевых твердых сталей, в качестве катализатора в органическом синтезе.
Оксид марганца (IV) МnO2. Черный, с коричневым оттенком, при нагревании разлагается. Из раствора осаждается в виде черного гидрата МnO2 nН2O. Не проявляет амфотерных свойств в силу малой реакционной способности по отношению к воде, разбавленным кислотам НCl и Н2SO4, азотной кислоте и щелочам в растворе. Типичный окислитель в растворе и расплаве, менее характерны свойства восстановителя.
Применяется для промышленного производства марганца, как деполяризатор в «батарейках» (сухих гальванических элементах), компонент минеральных пигментов, осветлитель стекла.
Уравнения важнейших реакций:
4МnO2 = 2Мn2O3 + O2 (530-585 °С)
2МnO2 + 2Н2SO4(конц.) = МnSO4 + O2↑ + 2Н2O (кипячение)
МnO2 + 4НСl(конц.) = МnСl2 + Сl2↑ + 2Н2O
МnO2 + Н2SO4 (гор.) + КNO2 = МnSO4 + КNO3 + Н2O
МnO2 + 2Н2SO4 + 2FeSO4 = МnSO4 + Fе2(SO4)3 + 2Н2O
МnO2 + 2КОН + КNO3 = К2MnO4 + KNO2 + Н2O (350-450 °С)
3МnO2 + 3К2CO3 + КСlO3 = 3К2MnO4+ КСl + 3CO2 (400 °С)
В природе самое распространенное соединение марганца — минерал пиролюзит.
Манганат калия К2MnO4. Оксосоль. Темно-зеленый, плавится под избыточным давлением О2. В растворе устойчив только в сильнощелочной среде. Зеленая окраска раствора отвечает иону МnO42-. Медленно разлагается при разбавлении раствора водой, быстро — при подкислении. Проявляет окислительно-восстановительные свойства.
Качественная реакция — появление фиолетовой окраски при подкислении раствора. Промежуточный продукт при синтезе КMnO4.
Уравнения важнейших реакций:
3K2MnO4(конц) +2H2O→(t) 2KMnO4+MnO2↓+4KOH
3K2MnO4(разб)+4HCl=2KMnO4+MnO2↓+2H2O+4KCl
K2 MnO4 +8HCl(конц)=MnCl2+2Cl2↑+4H2O+2KCl
3K2MnO4+2H2O+4CO2(г)=2KMnO4+MnO2↓+4KHCO3
2K2 MnO4+Cl2(насыщ)=2KMnO4+2KCl
2K2MnO4+2H2O→ H2↑+2KMnO4+KOH (электролиз)
Получение: сплавление МnO2 с сильными окислителями (KNO3, КClO3).
Перманганат калия КМnO4. Оксосоль. Красно-фиолетовый (почти черный). При нагревании разлагается без плавления. Умеренно растворим в воде (интенсивно-фиолетовая окраска раствора отвечает иону МnO4), гидролиза нет. Медленно разлагается в воде, серной кислоте, щелочах. Сильный окислитель в растворе и при сплавлении; в сильнокислотной среде восстанавливается до МnII, в нейтральной среде – до Mn IV в сильнощелочной среде — до МnVI
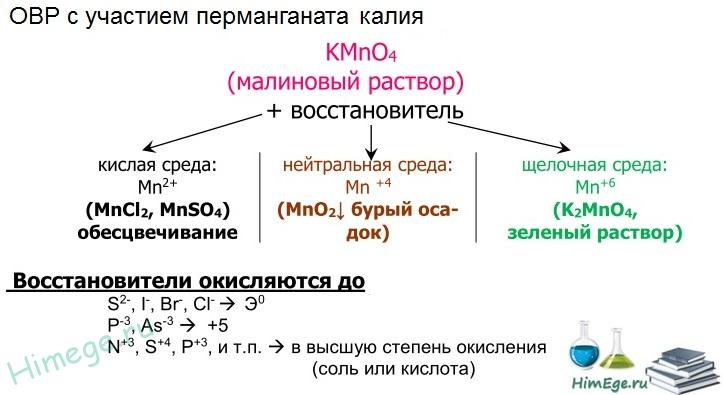
Качественная реакция на ион МnO4 — исчезновение фиолетовой окраски раствора при восстановлении в кислотной среде.
Применяется как окислитель углеводородов до карбоновых кислот, реактив в фотографии, антисептик в медицине, средство для очистки газов и отбеливания тканей, твердый источник кислорода. Распространенный окислитель в лабораторной практике. Уравнения важнейших реакций:
2КMnO4= К2MnO4 + МnO2 + O2 (200—240°С)
4КМnO4 + 2Н2O→МnO2↓+ 3O2↑ + 4КОН (t)
2КМnO4(т) + 16НСl(конц.) = 2МnСl2 + 5Сl2↑ + 8Н2O + 2КСl (80°С)
2КМnO4(т) + 2Н2SO4 (96%) = 2КНSO4 + Мn2O7 + Н2O (на холоду)
4КМnO4 (насыщ.) + 4КОН (15%) = 4К2МnO4+ O2↑ + 2Н2O (100 °С)
2КМnO4 + 2(NН3• Н2O)= 2МnO2↓ + N2↑ + 4Н2O+ 2КОН (50 °С)
2МnO4— + 16Н+ +10I— = 5I2+2Мn2+ + 8Н2O
2МnO4— + 6Н+ + 5Н2O2 (разб.) = 2Мn2+ + 5O2↑+ 8Н2O
2МnO4— + 6Н+ + 5SO32- =2Мn2+ + 5SO42- + 3Н2O
МnO4— + 8Н+ + 5Fе2+ = Мn2+ + 5Fе3+ + 4Н2O
2МnO4— + 6Н+ + 5NO2— = 2Мn2+ + 5NО3— + 3Н2O
2МnO4— + 3Н2S (насыщ.) = 2МnO2↓ + 3S↓ + 2Н2O + 2OН—
2МnO4— + Н2O + 3SO32- = 2МnO2↓ + 3SO42-+ 2OH—
2МnO4— + 2Н2O + 3Мn2+ = 5МnO2↓ + 4Н+ (50-80 °С)
2МnO4— + 2OH— (конц.) + SO32- = 2МnO42-+ SO42- + Н2O
Получение — электролиз раствора К2MnO4