Реакции присоединения молекул НХ с кислым атомом водорода к ненасыщенным соединениям
Реакции присоединения различных молекул НХ (Х – ОН, Cl, ОАс, CN) к ненасыщенным молекулам (олефины, диены, алкины, нитрилы, альдегиды, кетоны и др.) занимают важное место в промышленном органическом и нефтехимическом синтезе. Рассмотрим механизмы и кинетические модели некоторых процессов.
Гидратация олефинов
Реакция гидратации этилена в газовой фазе –
 (1)
(1)
процесс экзотермический ( ккал/моль), осуществляется на гетерогенных катализаторах (H3PO4/С, борофосфатный катализатор), которые активны лишь при Т > 300°С. При 330°С и P =1 атм равновесный выход этанола равен нулю (a @ 0). При 80 атм выход достигает ~10% (на практике лишь 5 – 6%). Если проводить процесс гидратации в жидкой фазе при температурах ниже Ткр для воды (374°С) и выше Ткр для спирта (247°С) и этилена (9,2°С), термодинамические ограничения заметно уменьшаются. Для реакции (2)
ккал/моль), осуществляется на гетерогенных катализаторах (H3PO4/С, борофосфатный катализатор), которые активны лишь при Т > 300°С. При 330°С и P =1 атм равновесный выход этанола равен нулю (a @ 0). При 80 атм выход достигает ~10% (на практике лишь 5 – 6%). Если проводить процесс гидратации в жидкой фазе при температурах ниже Ткр для воды (374°С) и выше Ткр для спирта (247°С) и этилена (9,2°С), термодинамические ограничения заметно уменьшаются. Для реакции (2)
 (2)
(2)
при Т = 330°С  и
и 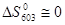 и равновесный выход при P >135 атм достигает 48%. В этих условиях при наличии плёнки жидкой воды указанные выше катализаторы быстро теряют активность. Наилучший вариант проведения реакции (2) – атмосферное давление и температуры 80°С < Т < 100 С. В этих условиях a = 40%, однако до настоящего времени нет гомогенных или гетерогенных (в жидкой фазе) катализаторов гидратации в таких мягких условиях.
и равновесный выход при P >135 атм достигает 48%. В этих условиях при наличии плёнки жидкой воды указанные выше катализаторы быстро теряют активность. Наилучший вариант проведения реакции (2) – атмосферное давление и температуры 80°С < Т < 100 С. В этих условиях a = 40%, однако до настоящего времени нет гомогенных или гетерогенных (в жидкой фазе) катализаторов гидратации в таких мягких условиях.
По аналогии с другими процессами присоединения молекул НХ вполне очевидны возможные механизмы этой реакции в случае металлокомплексных катализаторов, например,



и не имеется принципиальных причин, которые бы делали невозможной реализацию этих механизмов.
Теоретический анализ сернокислотной гидратации этилена, протекающей с образованием на первой стадии процесса этилсульфата в 97% Н2SO4 по реакции (3)
 (3)
(3)
показывает, что можно подобрать температуру и давление для процесса, протекающего по уравнению (2) в 50% Н2SО4, если скорость реакции (2) описывается уравнением (4)
 (4)
(4)
В этом случае увеличение константы скорости (Т), давления этилена и aH2O должны компенсировать снижение h0 при уменьшении концентрации кислоты с 97% до 50%, процессы образования этилсульфата и его гидролиза будут протекать в одном растворе и процесс при P > 300 атм и Т = 600К становится каталитическим по Н2SО4.
Прямая гидратация пропилена в жидкой воде до изопропанола уже не требует столь жёстких условий. Реакция катализируется катионитом КУ-2, имеющим кислотные группы SО3Н, при Т = 130°С и P =50 атм с выходом 10-15% спирта (равновесный выход ~ 18%).
В отличие от олефинов гидратация алкинов легко осуществляется в растворах комплексов Hg(II), Cu(I), Ru(III), Au(III) и Pd(II).
Гидратация нитрилов
Наиболее важные промышленные процессы гидратации нитрилов – реакции синтеза акриламида и адипиновой кислоты.
 (5)
(5)
 (6)
(6)
Сернокислотная гидратация нитрила акриловой кислоты (НАК) по реакции (5) осуществляется в концентрированном растворе кислоты в условиях, когда продукт гидратации – акриламид(АА) – образуется в форме сульфата акриламида
 (7)
(7)
Разложение соли проводят аммиаком с образованием АА и сульфата аммония (селективность по НАК ~ 80%).
Скорость стадии (7) также, как и в случае этилена определяется кислотностью среды.
 (8)
(8)
а механизм реакции типичен для катализа сильными кислотами:
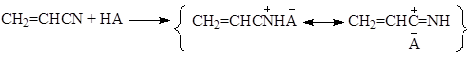
Протонированная молекула НАК присоединяет молекулу воды с образованием енольной формы амида и НА с последующей изомеризацией гидроксиимина в амид и связыванием амида серной кислотой.
Разработаны и гетерогенные металлсодержащие катализаторы – Cuмет, медь Ренея, меднохромовый и медноцинковый катализаторы синтеза АА. На катализаторе медь Ренея при 80 – 120°С степень превращения НАК 60 – 80%, селективность ~ 96%.
Скорость реакции (5) на мелкодисперсном металлическом медном катализаторе (получен разложением СuС2О4) описывается уравнением (9)
 (9)
(9)
где CAA и CAK – концентрации АА и акриловой кислоты в растворе. Схема механизма включает восстановленные центры Z·Н2О на поверхности меди.




A– – анион акриловой кислоты.
При QZ·HAK << 1 скорость реакции
 (10)
(10)
Из сравнения (9) и (10) следует, что k = k2b1; К1 = b3 / СH2O и К2 = 2b40.5.
В последние 15 лет появились биотехнологические способы получения акриламида из НАК. Разработан штамм микроорганизмов, содержащих фермент нитрилгидратазу, способный при 20°С и атмосферном давлении проводить гидратацию НАК с выходом 100% АА. Процесс разработан в Японии (фирма Nitto Chem. Jnd) и в России и реализован в промышленном масштабе.
Гидрохлорирование ацетилена
Процесс синтеза винилхлорида по реакции (11)
 (11)
(11)
в промышленном масштабе происходит на гетерогенном катализаторе HgCl2/С при 175 – 220°С и P = 1.5 атм. Скорость реакции (11) описывается уравнением
 (12)
(12)
свидетельствующем об образовании поверхностных комплексов НgCl2·НCl. По аналогии с гомогенным процессом в системе НgCl2 – НCl – Н2О лимитирующей стадией газофазного процесса является, вероятно, стадия ацидолиза b-хлорвинильного производного ртути

Известен также гомогенный процесс с металлокомплексным катализатором RhCl3-2-метилпирролидон (растворитель) при 150°С и P = 1 атм. Процесс исследован на пилотной установке. Скорость и селективность процесса превышают показатели гетерогенного “ртутного” катализатора.
Скорость гидрохлорирования описывается уравнением (13)
 (13)
(13)
В этой системе в материальном балансе по [Rh] участвует комплекс Rh(III) с НСl и С2Н2.