Лечение детей, страдающих острой гнойной деструктивной пневмонией, должно быть комплексным и в остром периоде заболевания проводиться в условиях блока (или палаты) интенсивной терапии. Одним из основных компонентов такого лечения является санация очагов деструкции.
С хирургических позиций при лечении детей с легочными формами заболевания главной задачей является обеспечение эффективного чрезбронхиального дренажа, что достигается, преждевсего, применением комбинации отхаркивающих препаратов с бронхосекретолитиками и муколитиками. Наиболее эффективной комбинацией на сегодняшний день является сочетание мукалтина и содержащих термопсис отхаркивающих микстур с ацетилцистеином (АЦЦ или флуимуцил) и с амбробене (амброгексалом). При этом препараты термопсиса и мукалтин даются per os, ацетилцистен путем ультразвуковых ингаляций, а амброгексал – парентерально (при наличии катетеризированной вены – в\венно). На этом фоне многократно в течение суток необходимо стимулировать у детей кашель путем назофарингеальной катетеризации с активной аспирацией мокроты. Столь интенсивная отхаркивающая терапия способствует быстрому разрешению внутрилегочной деструкции: на 3–4 сутки от поступления по данным рентгенографического контроля отмечается уменьшение интенсивности инфильтрата, на фоне которого выявляются полостные образования (рис. 4). Если в эти сроки на фоне адекватной антибиотико- и дезинтоксикационной терапии по данным физикального обследования ребенка и контрольной R-графии грудной клетки нет выраженной положительной динамики местного процесса – необходимо прибегнуть к проведению бронхоскопии (БС) с катетеризацией устья долевого бронха заинтересованных сегментов легкого (чаще всего – это верхнедолевой бронх). При этом долевой бронх оказывается обтурированным густой слизисто-гнойной мокротой.
В процессе манипуляции, после аспирации этой «пробки», устье бронха промывают большим количеством физиологического раствора, затем 0,5% раствором диоксидина. Перед тем, как извлечь тубус бронхоскопа в долевой бронх вводят раствор ацетилцистеина или амбробене. Как правило, однократная БС, при методически правильном проведении манипуляции, приводит к восстановлению чрезбронхиального дренажа.
Тем детям с инфильтративно-деструктивной формой ОГДП, у которых при поступлении имеют место клинико-рентгенологические проявления плеврита, необходимо производить диагностическую пункцию плевральной полости.
Поскольку техникой плевральной пункции (ПП) должен владеть врач любой специальности, приводим методику пункции:
Первичную (диагностическую) ПП желательно проводить в положении ребенка сидя с отведенной вверх рукой на стороне вмешательства (рис.11).

Рис. 11
Точку пункции выбирают по результатам физикального и рентгенологического обследования: при наличии значительного количества жидкости и (или) газа в плевральной полости она обычно соответствует У–У1 межреберью по средне- или заднеподмышечной линии. Необходимо предостеречь от пункции плевральной полости в УП–УШ межреберьях (как принято в практике взрослых хирургов): у маленьких детей может иметь место высокое стояние купола диафрагмы, поэтому проведение плевральной пункции в нижних отделах грудной клетки чревато ранением печени, желудка или толстой кишки.
Важное значение имеет адекватное обезболивание манипуляции. При отсутствии экстренных показаний к ПП мы рекомендуем первоначально обезболить кожу в точке пункции путем герметичной аппликации современных обезболивающих кремов типа ЕМЛА. Экспозиция крема в течение 60 мин. делает прокол кожи совершенно безболезненным. Послойную инфильтрационную анестезию грудной стенки следует проводить 2% раствором лидокаина или новокаина. В зависимости от возраста ребенка для проведения полноценной анестезии при этом достаточно 2–5 мл анестетика. Прокол грудной стенки проводят в месте анестезии по верхнему краю нижележащего ребра специальной иглой длиной 5–7 см. с внутренним диаметром не менее 0,1 см. с надетой на мандрен резиновой или пластиковой трубкой длиной 10–15 см. Проксимальный конец трубки герметично надевается на тубус шприца объемом 10–20 мл., содержащий 2–3 мл физиологического раствора или 0,5% раствора новокаина (рис.12).
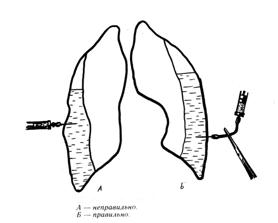
Рис.12
Игла вводится под прямым углом к поверхности грудной стенки, однако после прокола кожи ее необходимо немного сместить вдоль ребра, чтобы избежать формирования прямого раневого канала из плевральной полости на кожу после окончания манипуляции. Перед проколом париетальной плевры (который можно и не ощутить ввиду тонкости ее у маленького ребенка), необходимо создать разрежение в шприце, что обеспечит своевременный контроль за поступлением плеврального содержимого (помутнение раствора новокаина). После заполнения шприца резиновая трубка пережимается хирургическим зажимом, шприц отключается от системы и опорожняется. В указанной последовательности процедуру повторяют до полной эвакуации содержимого из плевральной полости. Появление у ребенка непроизвольного кашля и (или) «присасывания» поршня шприца и «слипания» переходной трубки свидетельствует об опорожнении плевральной полости и наличии герметизма в ней. Не следует доводить аспирацию плеврального содержимого до появления в шприце примеси крови или окрашенной кровью пенистой жидкости – это сигнализирует о ранении легкого.
Поскольку дети с тяжелыми формами пневмонии чаще всего требуют проведения интенсивной посиндромной терапии, целесообразно осуществлять ПП под общим обезболиванием сразу после катетеризации центральной вены.
У детей с легочно-деструктивными формами ОГДП при первичной пункции получают обычно от 10 до 100 мл серозного или серозно-гнойного экссудата. Если по характеру или количеству экссудата нельзя исключить вероятность повторных пункций, целесообразно в точке пункции провести микроторакоцентез и оставить в плевральной полости торакальный катетер небольшого диаметра, подключенный к системе активной аспирации. После прекращения экссудации (как правило, на 3-5 сутки) катетер удаляется.
Поскольку одиночные крупные абсцессы легкого характеризуются выраженной плевральной реакцией (рис.5-6), приводящей к быстрой облитерации плевральной полости в проекции абсцесса, наиболее рациональным методом санации такого гнойника является его чрезкожное дренирование торакальным катетером диаметром 0,3–0,4 см в режиме активной аспирации (рис.13).
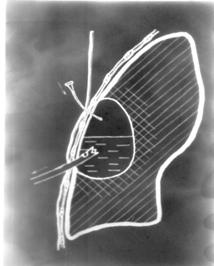
Рис. 13
В течение 3–5 суток п\о периода полость абсцесса дважды в день следует промывать 1% раствором диоксидина. Длительность дренирования обычно не превышает 7 дней.
Детям с предположительным диагнозом «фибриноторакс» при поступлении в стационар пункцию плевральной полости проводят с диагностической целью. Получение незначительного (2–3 мл) количества экссудата или крошек фибрина подтверждает диагноз. При затяжном течении фибриноторакса в условиях специализированного торакального отделения возможно проведение оперативного вмешательства – торакоскопии с ультразвуковой санацией плевральной полости. Однако в подавляющем большинстве наблюдений при проведении адекватной антибиотикотерапии, дополненной современной энзимотерапией (большие дозы полиферментного препарата Вобэнзим) удается добиться быстрой резорбции фибринозных наложений из плевральной полости.
Основным методом хирургического лечения детей с пиотораксом, пиопневмотораксом и пневмотораксом является дренирование плевральной полости в режиме активной аспирации, которое обычно производят сразу после первичного обследования ребенка в отделении интенсивной терапии. При наличии в плевральной полости значительного количества гнойного экссудата в качестве дренажа используется силиконовая трубка с внутренним диаметром 0,5 см. Обязательным условием для дренирования является предварительная пункция полости плевры, во время которой уточняют показания к торакоцентезу и определяют место вмешательства.
Режим активной аспирации с помощью современных аспирационных систем можно варьировать в широких пределах: при наличии герметичного пиоторакса в целях скорейшего расправления легкого разрежение в плевральной полости устанавливают на уровне 40–50 см водного столба, при небольших продуваниях воздуха аспирация должна быть «щадящей»: порядка 5–10 см водного столба. Никаких препаратов в плевральную полость вводить не следует, в тоже время при наличии густого отделяемого из полости плевры в течение первых трех-четырех суток дренажную трубку необходимо регулярно промывать раствором диоксидина. На фоне комплексной консервативной терапии экссудация из плевральной полости прекращается, как правило, на 3–5 сутки, дренаж «забивается» фибринозными отложениями и перестает функционировать, после чего его удаляют. У детей с пневмотораксом показанием к удалению дренажа служит отсутствие гнойного отделяемого и эффективность общей санационной терапии. Предварительно на 1–2 дня дренаж переводится на «пассивный» режим. Наличие небольшого по объему воздушного осумкования с периодическими продуваниями воздуха не является показанием к продолжению дренирования плевральной полости. Максимальная длительность дренирования у ребенка с «ригидным» внутриплевральным осумкованием составляет 10-12 суток.
При катамнестическом наблюдении детей с санированными внутриплевральными осумкованиями, выявляется, что через 1,5–3 месяца на фоне обычных реабилитационных мероприятий легкое полностью расправляется и на месте таких полостей отмечаются лишь остаточные плевральные наложения.
Существенное место в комплексном лечении детей с ОГДП занимает антибактериальная химиотерапия.
При первичном назначении антибиотиков (до получения результатов бактериологического и серологического исследований) следует ориентироваться на общую тяжесть состояния больного, длительность заболевания и проводимую ранее антибиотикотерапию. Детям, поступившим из дома в относительно ранние сроки заболевания и не получавшим антибактериальные препараты, или получавшим их в течение 1–2-х дней, следует назначать β-лактамные антибиотики (амоксициллин, амоксиклав, цефалоспорины П–Ш поколения). Если антибиотикотерапия в домашних условиях проводилась в течение нескольких дней, тем более, если клиническая картина пневмонии развилась на фоне приема антибактериальных химиопрепаратов – β-лактамы необходимо сочетать с аминогликозидами. После идентификации микробного возбудителя заболевания антибиотикотерапию, в случае необходимости, следует коррегировать. При этом, если отмечается положительная динамика общего состояния и местного процесса, можно перейти на «монотерапию» (как правило, отменяется препарат аминогликозидной группы).
У всех детей, поступающих в специализированный стационар после более-менее продолжительного лечения в условиях инфекционных или педиатрических отделений, антибиотикотерапию необходимо назначать с учетом высокой вероятности участия в патологическом процессе грамотрицательной микрофлоры. Препаратами выбора при этом являются цефалоспорины Ш–1У поколения в сочетании с аминогликозидами 2 - 3 поколения (тобрамицин, амикацин).
При затяжном течении процесса, тем более, если ребенок подвергался инвазивным вмешательствам (повторные пункции или дренирование плевральной полости, длительная катетеризация центральной вены, интубация трахеи) в комплекс антибактериальной терапии следует вводить метронидазол, имея ввиду высокую вероятность участия в процессе анаэробных микроорганизмов.
При наличии у ребенка выраженных признаков микробной интоксикации на фоне предшествующей неэффективной комбинированной антибиотикотерапии, препаратами выбора становятся карбапенемы (тиенам или меронем), которые на сегодня являются наиболее поливалентными из всех антибактериальных химиопрепаратов.
Эффективность антибактериальной химиотерапии следует оценивать, ориентируясь в первую очередь на клинико-рентгенологическую динамику процесса и данные гемограммы: ко 2-4 суткам адекватной антибиотикотерапии значительно уменьшаются проявления интоксикации и дыхательной недостаточности (температура снижается до субфебрильной, «уходят» проявления микроциркуляторных нарушений, уменьшается одышка, у детей появляется аппетит, нормализуется функция кишечника). В анализах крови отмечается выраженное снижение лейкоцитоза (например – с 28 до 12 тыс. лейкоцитов), исчезают юные формы нейтрофилов, появляется тенденция к нарастанию гемоглобина. Динамика физикальных проявлений при этом может оставаться достаточно «скромной»: несколько улучшается проводимость дыхания в зоне поражения, над которой появляются в большем или меньшем количестве разнокалиберные влажные хрипы (что является признаком улучшения дренажной функции бронхов). У детей с пиопневмотораксом или пневмотораксом появление хрипов, наряду с данными перкуссии, свидетельствует о том, что легкое «расправляется».
В эти сроки на контрольных рентгенограммах грудной клетки у детей с инфильтративно-деструктивными формами заболевания отмечается уменьшение интенсивности инфильтрата с появлением признаков наличия деструктивных очагов.
При легочно-плевральных формах поражения отмечается незначительное снижение интенсивности плевральных наложений (при фибринотораксе его может еще и не быть), легкое бывает расправлено (может сохраняться парциальный пневмоторакс или небольшие по объему внутриплевральные осумкования), свободная жидкость в полости плевры не определяется. Важно подчеркнуть, что при положительной динамике заболевания контрлатеральное легкое остается вне воспалительного процесса.
При сохранении проявлений интоксикации, гипертермии и выраженных воспалительных изменений в анализах крови в течение 2–3 суток вне зависимости от физикальной и рентгенологической динамики процесса необходимо производить смену антибиотиков.
Длительность антибактериальной терапии у детей с ОГДП колеблется, как правило, от 10-ти до 20 суток. Отменяют антибиотики опираясь, прежде всего, на клинико-лабораторные показатели течения процесса. Первоначально отменяют один из препаратов (чаще всего – аминогликозид), через 2–3 дня – второй. Обязательными условиями отмены являются: купирование интоксикации и дыхательной недостаточности, стойкое снижение температуры до нормальной или субфебрильной (в пределах 37,0-37,5оС), снижение лейкоцитоза до нормального или субнормального при нормализации лейкоцитарной формулы крови. Физикальная и рентгенографическая динамика заболевания решающего значения при этом не имеют. Субфебрильная температура и небольшой лейкоцитоз могут наблюдаться после отмены антибиотиков еще в течение 5–7 суток, что бывает связано с процессом резорбции остаточных плевральных наложений и не служит показанием к возобновлению химиотерапии.
Естественно, что длительную антибактериальную химиотерапию следует проводить на фоне профилактики грибковой суперинфекции и дисбиоза кишечника. В этих целях в последние годы применяются современные противогрибковые препараты (низорал, дифлюкан) и пробиотики (линекс, пробифор и пр.). Низорал отменяют через 2 – 3 дня после прекращения антибиотикотерапии, пробиотики следует продолжать на протяжении еще 2-х недель (по показаниям – дольше).
На фоне тяжелого течения бактериальной инфекции у части больных ОГДП в остром периоде заболевания отмечается угнетение противоинфекционного иммунитета: преимущественно за счет фагоцитарного звена иммунитета и умеренного снижения количества иммуноглобулинов (чаще А класса). У детей первых двух месяцев жизни имеется транзиторный гуморальный иммунитет, в связи с чем при тяжелых деструктивных пневмониях в этой возрастной группе показано назначение с иммунозаместительной целью стандартных иммуноглобулинов для внутривенного введения (октагам, интраглобин) в терапевтических дозах 0,5 гр/кг массы тела 2-3 введения через день или ежедневно.
Необходимость назначения иммунозаместительной терапии у детей до 3 лет определяется тяжестью течения пневмонии и наличием факторов, способствующих снижению иммунной защиты. Так как этиология пневмоний в данной возрастной группе представлена преимущественно пневмококком, гемофильной палочкой или другими грамотрицательными микробами, целесообразно назначать обогащенный антителами класса М (Ig) пентаглобин в дозе 5 мл/кг массы тела курсом в 2-3 введения ежедневно или через день. В иммуноглобулинах класса М сконцентрированы антитела к грамотрицательным возбудителям и к эндотоксину грамотрицательных бактерий. Известно, что пентамерная структура антител класса М определяет более сильную агглютинацию бактериальных антигенов, что способствует более активному уничтожению и элиминации бактерий. До идентификации микробной этиологии процесса в целях пассивной противоинфекционной иммунотерапии при необходимости следует применять нативнозамороженную донорскую плазму. При установленной этиологии процесса – гипериммунную (антистафилококковую или антисинегнойную). Плазма дозируется из расчета 5–10 мл на 1 кг массы ребенка, кратность введения плазмы не превышает 3-х раз (с интервалом через 1–2 дня).
Следует, однако, отметить, что практическая необходимость иммунозаместительной терапии при адекватном комбинированном лечении в настоящее время возникает редко. Тем более нет нужды в применении таких активирующих иммуногенез препаратов, как стафилококковый анатоксин, левамизол, продигиозан, довольно широко использовавшихся в недавнем прошлом (В.А.Бычков и соавт., 1994).
Важным компонентом лечения детей с легочно-плевральными формами ОГДП является энзимотерапия: при нормализации функции кишечника детям в возрасте 2-х лет и старше следует назначать вобэнзим по 2–3 таблетки х 3 раза в день в течение двух недель. При наличии выраженных плевральных наложений вобэнзим необходимо давать длительным курсом в процессе ребилитационных мероприятий.
Реабилитационные мероприятия у детей с ОГДП начинают уже в остром периоде заболевания (после купирования токсикоза и снижения температуры до субфебрильных цифр) с массажа конечностей и дыхательной гимнастики. При расширении двигательной активности (обычно после удаления катетера из центральной вены и дренажной трубки из плевральной полости) можно продолжать занятия лечебной и дыхательной гимнастикой в зале. В это же время начинают и физиотерапевтическое лечение.
Длительность пребывания детей с ОГДП в стационаре составляет 15–35 суток (в среднем – 25–30 дней). При условии, что последние 10–12 из них приходятся на первичную реабилитацию, как таковую.
Всех детей, перенесших ОГДП, необходимо наблюдать в течение 0,5-3-х лет. Кратность осмотра при этом составляет 1 раз в три месяца в течение первых 6 месяцев после выписки, далее – 1 раз в полгода. Рентгенографию грудной клетки производят через первые три месяца всем детям, при повторных осмотрах – по показаниям.
Особо следует отметить, что наличие даже выраженных остаточных клинико-рентгенологических проявлений перенесенного деструктивного процесса (осумкованных воздушных внутрилегочных или внутриплевральных полостей, объемных плевральных наложений) при удовлетворительном состоянии ребенка и отсутствии признаков продолжающегося инфекционного процесса, не может служить показанием для пролонгации госпитального лечения, тем более – для каких-либо хирургических вмешательств (торакоскопия, повторные дренирования плевральной полости, торакотомия с декортикацией легкого и пр.). Как показывает практика, после санации организма ребенка и нормализации его иммунного статуса подобные осложнения при условии систематической реабилитации (повторные курсы физиотерапии, ЛФК и массажа грудной клетки, постоянных занятий дыхательной гимнастикой и длительная энзимотерапия) подобные осложнения полностью купируются в сроки от 0,5 до 1,5 лет.
Клинический пример.
Ребенок С., 5 лет поступил в отделение интенсивной терапии в тяжелом состоянии (интоксикация, одышка с ограничением дыхательных экскурсий правого гемиторакса, гипертермия) на 8-е сутки заболевания с клинико-рентгенологической картиной правосторонней нижнедолевой пневмонии, осложненной пиофибринотораксом (рис. 14 - при пункции плевральной полости получено небольшое количество гнойного выпота и крошки фибрина).
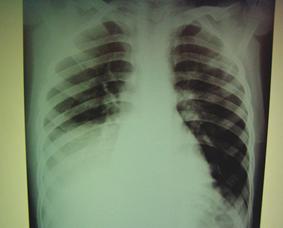
Рис. 14
На фоне интенсивной посиндромной и антибактериальной терапии в течение 7 суток общее состояние ребенка значительно улучшилось: проявления интоксикации и дыхательной недостаточности купировались, температура снизилась до субфебрильной. Однако, несмотря на дренирование плевральной полости в течение 5 суток с введением в нее раствора хемотрипсина, проявления фибриноторакса практически не уменьшились: дыхательные экскурсии правой половины грудной клетки оставались сниженными, дыхание в проекции нижней доли правого легкого – практически не выслушивалось. На контрольной R-грамме – очень незначительное уменьшение интенсивности фибриноторакса. Начаты интенсивная вобэнзимотерапия, физиотерапия, ЛФК, дыхательная гимнастика, массаж грудной клетки. Еще через 12 дней ребенок был выписан домой в удовлетворительном состоянии. На R-грамме грудной клетки – картина осумкованного фибриноторакса (рис. 15), что клинически проявлялось снижением дыхательных экскурсий в нижних отделах правого гемиторакса, снижением дыхательных шумов в проекции нижней доли правого легкого, резко выраженным укорочением перкуторного тона по заднебоковой поверхности грудной клетки ниже уровня V ребра.
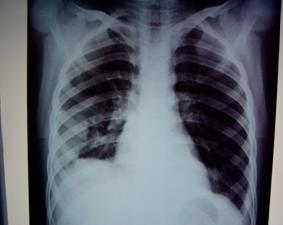
Рис. 15
Амбулаторно ребенку проводились пролонгированная энзимотерапия, постоянная дыхательная гимнастика, курсы ЛФК и массажа грудной клетки. На контрольной R-грамме через 0,5 года – признаков фибриноторакса нет, физикальной симптоматики остаточных проявлений перенесенного процесса нет (рис. 16).
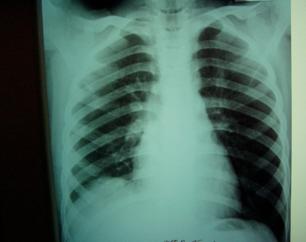
Рис. 16.