План.
1. Состав и строение молекулы бензола.
2. Гомологический ряд аренов. Номенклатура аренов. Изомерия аренов.
3. Свойства бензола.
4. Получение.
5. Применение.
1. Ароматическими называют вещества, в молекулах которых содержится одно или несколько бензольных колец. Бензольное кольцо - это циклические группы атомов углерода с особым характером связи. Простейшим представителем ароматических углеводородов является бензол.

 Молекулярная формула бензола С6Н6. Структурная формула для него была предложена Кекуле еще в 1865 году. Она правильно отражает равноценность шести атомов углерода, но не объясняет, почему бензол не обесцвечивает бромную воду и раствор марганцовки, т.е. не дает типичных реакций для непредельных углеводородов. Кроме того, рентгеноструктурный анализ показывал, что все связи между атомами углерода в бензоле одинаковы по длине.
Молекулярная формула бензола С6Н6. Структурная формула для него была предложена Кекуле еще в 1865 году. Она правильно отражает равноценность шести атомов углерода, но не объясняет, почему бензол не обесцвечивает бромную воду и раствор марганцовки, т.е. не дает типичных реакций для непредельных углеводородов. Кроме того, рентгеноструктурный анализ показывал, что все связи между атомами углерода в бензоле одинаковы по длине.
 Особенности строения и свойств бензола удалось объяснить только благодаря представлению о гибридизации. Все шесть атомов углерода находятся в состоянии sp2 –гибридизации. Каждый из них образует две
Особенности строения и свойств бензола удалось объяснить только благодаря представлению о гибридизации. Все шесть атомов углерода находятся в состоянии sp2 –гибридизации. Каждый из них образует две  -связи с двумя атомами углерода и одну - с атомом водорода. Валентные углы между этими тремя связями равны 120о и лежат в одной плоскости, шесть таких треугольников образуют правильный шестигранник. Кроме того, каждый атом углерода имеет одну негибридную р-орбиталь, которые располагаются перпендикулярно плоскости молекулы. При перекрывании этих негибридных орбиталей образуется не три локализованные пары, а единое
-связи с двумя атомами углерода и одну - с атомом водорода. Валентные углы между этими тремя связями равны 120о и лежат в одной плоскости, шесть таких треугольников образуют правильный шестигранник. Кроме того, каждый атом углерода имеет одну негибридную р-орбиталь, которые располагаются перпендикулярно плоскости молекулы. При перекрывании этих негибридных орбиталей образуется не три локализованные пары, а единое  -облако из 6 электронов по форме напоминающее кольцо (точнее два кольца – над и под плоскостью углеродного скелета). В результате длина связи между атомами углерода в цикле выравнивается (она равна 0,139 нм, одинарная - 0,154 нм, двойная - 0,133 нм). Равноценность этих связей показывают кружком внутри цикла.
-облако из 6 электронов по форме напоминающее кольцо (точнее два кольца – над и под плоскостью углеродного скелета). В результате длина связи между атомами углерода в цикле выравнивается (она равна 0,139 нм, одинарная - 0,154 нм, двойная - 0,133 нм). Равноценность этих связей показывают кружком внутри цикла.



Теперь понятно, почему бензол не вступает в реакции присоединения – это приводит к нарушению сопряжения, такие реакции возможны только в жестких условиях.
 Условно арены делят на гомологи бензола (с одним бензольным кольцом) и конденсированные арены, в которых бензольные кольца соединены друг с другом линейно или нелинейно.
Условно арены делят на гомологи бензола (с одним бензольным кольцом) и конденсированные арены, в которых бензольные кольца соединены друг с другом линейно или нелинейно.
 нафталин
нафталин
антрацен
фенантрен
толуол (метилбензол)о- ксилол (1,2-диметилбензол)
Рассмотрим гомологический ряд бензола. Общая формула СnH2n-6. Структурная изомерия гомологов бензола обусловлена строением заместителей (начиная с С3) и взаимным расположением заместителей в кольце. Если заместитель один, то соединение не имеет изомеров, т.к. все атомы в бензольном кольце равноценны. Например: метилбензол (толуол) и этилбензол. Если с кольцом связаны два заместителя, то тут возможны три варианта, изомеры обозначаются цифрами или словами: о- (орто-) или 1,2, м- (мета-) или 1,3 и п- (пара-) или 1,4). Например: о-ксилол или 1,2-диметилбензол. При отщеплении атома водорода от молекул аренов образуются радикалы, простейший из которых фенил (С6Н5-) и бензил (С6Н5- СН2-).
Физические свойства. Первые члены ряда бензола – бесцветные подвижные жидкости со специфическим запахом. Температура кипения бензола 80оС. Они легче воды (плотность бензола 0,8) и в ней не растворяются. Хорошо растворяются в органических растворителях и сами являются хорошими растворителями.
Физиологическое действие. Бензол токсичен. Вдыхание паров бензола вызывают головную боль, потерю сознания, раздражают слизистые. Бензол легко проникает через кожу. Но особенно опасно попадание бензола в ЖКТ. Бензол канцероген. Гомологи бензола, например, толуол, менее ядовиты.
Химические свойства.
1) Как и все углеводороды, бензол горит. Но не очень охотно, пламя желтое, коптящее. Это связано с высоким содержанием углерода в бензоле. Реакция происходит быстрее, если бензол находится в газообразном состоянии или в виде аэрозоля. Но бензол не обесцвечивает раствор марганцовки. И вообще по отношению к окислителям больше напоминает алканы.
С6Н6 + О2 → СО2 + Н2О
2) Характерными для бензола являются реакции замещения с галогенами. Но реакция не протекает при Н.У. Не имеет она и цепного характера, как реакция замещения у предельных углеводородов. Ароматическое ядро обладает повышенной электронной плотностью и является удобным объектом для электрофильной атаки. Для аренов характерны реакции электрофильного замещения. В качестве электрофила может выступать катион хлора, образующийся в присутствии катализатора:
Cl/:Cl + FeCl3 => Cl+ + FeCl4- ,
Реакция проходит через образование  -комплекса когда электрофильная частица притягивается к избытку электронной плотности в бензольном кольце, потом электрофил «забирает» два электрона из ароматического кольца и образует
-комплекса когда электрофильная частица притягивается к избытку электронной плотности в бензольном кольце, потом электрофил «забирает» два электрона из ароматического кольца и образует  -связь с одним из атомов углерода бензольного кольца. При этом ароматичность структуры нарушается, а затем протон отщепляется, и ароматическая система восстанавливается. Отщепляющийся протон связывается с нуклеофильной частью реагента. В результате:
-связь с одним из атомов углерода бензольного кольца. При этом ароматичность структуры нарушается, а затем протон отщепляется, и ароматическая система восстанавливается. Отщепляющийся протон связывается с нуклеофильной частью реагента. В результате:


+ Сl2 → HCl +
Так протекают не только реакции бензола с галогенами, но и реакция нитрования, сульфирования, алкилирования (реакция Фриделя-Крафтса).


+ НО-NO2  + H2O
+ H2O


+CH3 -Cl  + HCl
+ HCl
После введения хлора в бензольное кольцо оно теряет избыток электронной плотности и второй атом водорода в бензольном кольце уже не подвергается замещению (т.е. второй и далее стадий нет).

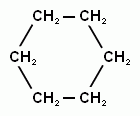 4) Наряду с реакциями замещения ароматические углеводороды могут вступать в реакции присоединения, но т.к. эти реакции протекают с разрушением ароматической системы, они протекают в жестких условиях. Например, гидрирование бензола идет при нагревании и высоком давлении в присутствии катализаторов (Ni, Pt).
4) Наряду с реакциями замещения ароматические углеводороды могут вступать в реакции присоединения, но т.к. эти реакции протекают с разрушением ароматической системы, они протекают в жестких условиях. Например, гидрирование бензола идет при нагревании и высоком давлении в присутствии катализаторов (Ni, Pt).
+ H2 →
Бензол при этом превращается в циклогексан. Эту реакцию называют иногда восстановлением бензола.
При взаимодействии паров хлора с бензолом под воздействием жесткого ультрафиолетового излучения, молекула бензола присоединяет три молекулы хлора и образуется твердое вещество – гексахлорциклогексан (гексахлоран). Это соединение, как и другие хлорпроизводные бензола используют в сельском хозяйстве для борьбы с вредителями (насекомыми, грызунами и т.д.)

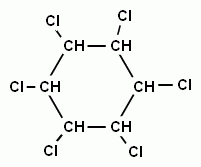

+ 3Сl2 →
Химические свойства гомологов бензола во многом похожи на свойства бензола, но есть и отличия. Например, в реакции замещения с галогенами для толуола образуются 2-бромтолуол и 4-бромтолуол



+ Br2 → HВr + +
Т.о. мы видим, что заместитель (метил) влияет на способность бензольного кольца вступать в реакцию замещения (облегчает реакцию и направляет ее в определенное положение). Так же ведут себя и другие электродонорные заместители, например, группа –ОН или - NH2
Боковые цепи в гомологах бензола ведут себя в соответствии со строением, т.е. вступают в реакции замещения и присоединения. При окислении гомологов бензола боковые цепи «обгорают» и образуется бензойная кислота.
Получение бензола.
- Бензол входит в состав нефти и может быть получен при ее перегонке. Но этого количества недостаточно, чтобы удовлетворить потребности промышленности.
- Бензол (и его гомологи) получают из алканов и циклоалканов, которые более широко распространены в природе (реакция ароматизации, дегидрирования). При пропускании алканов нормального строения имеющих не менее 6 атомов углерода в молекуле над нагретой платиной происходит отщепление атомов водорода и замыкание цикла.


 3 H2 +
3 H2 +
Применение.
- растворитель для неполярних соединений;
- составная часть бензина (топливо);
- исходное вещества для синтеза фенола (гидроксобензола) (полимеры, ВВ, красители, ПАВ, лекарства, антисептик), анилина (аминобензола) (красители, полимеры), хлорпроизводных (пестициды и ОВ), стирола (полимеры);