При опытах с водородом нельзя поджигать водород, выходящий из прибора, не убедившись предварительно в его чистоте, иначе внутри прибора может произойти взрыв и разорвать его.
1. ПОЛУЧЕНИЕ ВОДОРОДА ДЕЙСТВИЕМ МЕТАЛЛА НА КИСЛОТУ
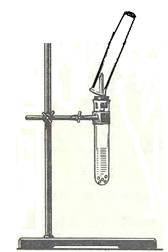
Приборы и посуда. 1) Штатив с лапкой. 2) Пробирка с пробкой и трубкой с оттянутым концом.
Химические реактивы:
| Знаки опасности | Указания опасности (R-, H-Sätze, Hazard Statements) | Меры предосторожности (S-,P-Sätze, Precautionary Statements) | |
| Серная кислота H2SO4 (2н.) | 
| R36/38 | S (2), S26 |
| Цинк (гранул.) | R10,R15 | S (2), S43 |
Ход работы: Собрать прибор, состоящий из пробирки с пробкой, через которую проходит стеклянная трубка с оттянутым концом (рис. 1).
Положить в пробирку несколько кусочков цинка и прилить разбавленной H2SO4. Плотно вставить пробку с оттянутой трубкой и укрепить пробирку вертикально в зажиме штатива. Наблюдать выделение газа.
 Zn + H2SO4 → ZnSO4+ H2↑.
Zn + H2SO4 → ZnSO4+ H2↑.
Рис.1. Прибор для получения водорода
Убедиться, что выходящий через трубку водород не содержит примеси воздуха. Для этого надо на газоотводную трубку надеть перевернутую вверх дном пробирку, через полминуты снять и, не переворачивая, поднести к пламени горелки. Если в пробирку поступил чистый водород, он загорается спокойно (при загорании слышен слабый звук). При наличии в пробирке с водородом примеси воздуха происходит небольшой взрыв, сопровождающийся резким звуком. В этом случае испытание газа на чистоту следует повторить, взяв чистую пробирку.
Убедившись, что из прибора идет чистый водород, зажечь его у отверстия оттянутой трубки.
Подержать над пламенем водорода сухую пробирку. Какое вещество образуется в результате горения водорода? Написать уравнения реакций получения и горения водорода.
ПОЛУЧЕНИЕ ВОДОРОДА ДЕЙСТВИЕМ МЕТАЛЛА НА ЩЕЛОЧЬ
Приборы и посуда. 1) Штатив с лапкой. 2) Пробирка с пробкой и трубкой с оттянутым концом.
Химические реактивы:
| Знаки опасности | Указания опасности (R-, H-Sätze, Hazard Statements) | Меры предосторожности (S-,P-Sätze, Precautionary Statements) | |
| Гидроксид натрия NaOH (2н.) | 
| R34 | S (1/2), S26, S37/39, S45 |
| Алюминий (Al) | 
| R15,R17 | S (2), S7/8, S43 |
Ход опыта: В пробирку прибора, описанного в предыдущем опыте, всыпать немного алюминиевых стружек и налить 2—3 мл раствора гидроксида натрия. Наблюдать выделение газа. Если реакция идет медленно, осторожно подогреть. Закрыть пробирку пробкой с оттянутой трубкой и, убедившись в полноте вытеснения воздуха из пробирки (как в предыдущем опыте), поджечь выделяющийся газ. Написать уравнения реакций.
ВЗРЫВ ГРЕМУЧЕГО ГАЗА
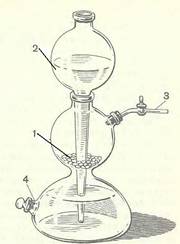
Приборы и посуда. 1) Аппарат Киппа, заряженный для получения водорода.2) Лучина. 3) Железный цилиндр с отверстием на дне. 4) Фильтровальная бумага, предварительно смоченная водой. 5) Лабораторный столик
Химические реактивы:
| Знаки опасности | Указания опасности (R-, H-Sätze, Hazard Statements) | Меры предосторожности (S-,P-Sätze, Precautionary Statements) | |
| Соляная кислота HСl (2н.) | 
| R36/37/38 | S (2), S28 |
| Цинк (гранул.) | R10,R15 | S (2), S43 |
Ход работы: Наполнить цилиндр, перевернутый вверх дном водородом (из аппарата Киппа) методом вытеснения воздуха (Внимание! Отверстие цилиндра должно быть закрыто фильтровальной бумагой во время заполнения водородом). Убрать фильтровальную бумагу и поднести горящую лучину к отверстию цилиндра, должен быть слышен хлопок. Далее будет слышен нарастающий звук и произойдет взрыв. Объяснить наблюдаемые явления.
 2Н2 + О2 → 2Н2О
2Н2 + О2 → 2Н2О
Рис.2. Аппарат Киппа: 1. Гранулы цинка; 2.Соляная кислота (1:1); 3.Газоотводная трубка с краном; 4. Тубус для выливания отработанной жидкости.
ВОССТАНОВЛЕНИЕ ПЕРМАНГАНАТА КАЛИЯ АТОМНЫМ ВОДОРОДОМ
(В МОМЕНТ ВЫДЕЛЕНИЯ)
Приборы и посуда. 1) Аппарат Киппа, заряженный для получения водорода 2) Держатели для пробирок. 3) Пробирка (2 шт.).4) Пинцет. 5) Секундомер
Химические реактивы:
| Знаки опасности | Указания опасности (R-, H-Sätze, Hazard Statements) | Меры предосторожности (S-,P-Sätze, Precautionary Statements) | |
| Серная кислота H2SO4 (2н.) | 
| R36/38 | S (2), S26 |
| Цинк (гранул.) | R10,R15 | S (2), S43 | |
| Перманганат калия КМnO4 (0,1 н.). | 
 
| R8, R22, R50/53 | S (2), S60, S61 |
Ход опыта: В разбавленный раствор серной кислоты добавить несколько капель раствора перманганата калия и налить смесь в две пробирки. В одну из них бросить кусочек цинка, в другую пропустить водород из аппарата Киппа. Сравнить скорость изменения цвета раствора в пробирках. Объяснить разницу в скорости изменения цвета.
Уравнение реакции восстановления перманганата калия атомным водородом:
2КМnO4 + 10Н+ 3H2S04→2MnS04 + K2SO4 + 8Н20
Упражнения и задачи
1. Почему температура пламени гремучего газа выше, чем температура пламени водорода, горящего на воздухе?
2. Привести примеры, показывающие отличие химической активности молекулярного и атомного водорода.
3. Сколько граммов воды получится при взрыве 6 л гремучего газа (при н. у.)?
4. Какой газ и какая его масса не полностью войдет в реакцию при взрыве смеси, состоящей из 0.36 г водорода и 3,26 г кислорода?
5. Сколько граммов цинка надо взять, чтобы при взаимодействии с серной кислотой получить 5,6 л водорода (при н. у.)?
6. Сколько литров водорода (при н. у.) потребуется для восстановления 20 г оксида меди (II)?
7. Сколько литров водорода выделится при разложении водой 5,5 г гидрида кальция при температуре 17 °С и давлении 101,3 кПа?
8. Какай масса гидрида кальция должна прореагировать с водой, чтобы выделившимся водородом восстановить 20 г оксида меди (II)?