Класс Москва 2010
ЗАДАНИЯ С РЕШЕНИЯМИ
11-1. Предложите лабораторный способ разделения на индивидуальные вещества смеси газов, состоящей из аммиака, углекислого газа, угарного газа, азота. Напишите уравнения соответствующих реакций.
РЕШЕНИЕ.
1) Пропустить смесь через кислоту.
NH3 + H+ = NH4+ (остальные компоненты не реагируют)
К раствору соли аммония добавить щелочь и нагреть. Выделится аммиак. Собрать выделившийся аммиак.
2) Пропустить остаток через известковую воду.
CO2 + 2OH¯ + Ca2+ = CaCO3↓ + Н2О (остальные компоненты не реагируют)
Осадок отфильтровать, высушить, прокалить. Собрать выделившийся углекислый газ.
3) Разделение СО и N2 можно провести следующим образом.
4 СО + Ni =t Ni(CO)4 (N2 не реагирует)
При более высокой температуре карбонил никеля разлагается с выделением угарного газа.
Можно получить также кабонил железа, но при других условиях.
11-2. Предложите реакции, с помощью которых можно осуществить следующую схему превращений:
пропандиол-1,2 → ацетон → изомасляная (метилпропановая) кислота
РЕШЕНИЕ.
1) Превращение (пропандиол-1,2 → ацетон) можно осуществить в 3 стадии.

Стадия 1. Замещение гидроксильных групп на галоген.
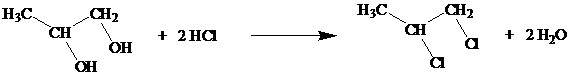
Стадия 2. Дегидрогалогенирование спиртовым раствором щелочи.

Стадия 3. Гидратация пропина (реакция Кучерова).
CH3─C≡CH + H2O  CH3─CO─CH3
CH3─CO─CH3
Ацетон
Возможны другие варианты ответа.
2) Превращение (ацетон → изомасляная (метилпропановая) кислота) можно провести в 3 стадии. Последняя стадия может быть осуществлена двумя способами.

Стадия 1. Восстановление ацетона.

Стадия 2. Замещение гидроксила спирта на галоген.

В качестве реагентов можно использовать также PCl5, PCl3, SOCl2.
Стадия 3. Трансформация атома галогена в СООН. Может быть осуществлена двумя способами:
I способ – через нитрил


II способ – через реактив Гриньяра


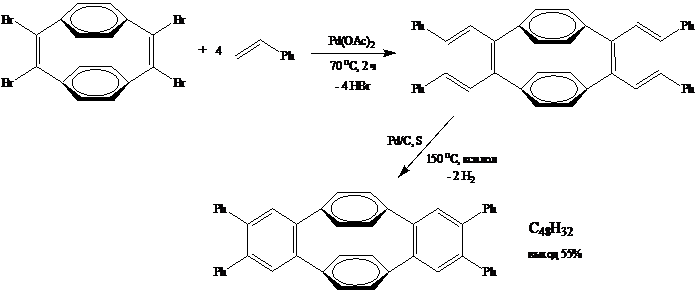
11-3. Нобелевская премия по химии в 2010 году присуждена американцу Ричарду Хеку, японцам Акире Судзуки и Эйити Негиси - авторам трех "именных" реакций кросс-сочетания с помощью палладиевых катализаторов.
Реакция Хека формально проста:

С помощью модифицированной реакции Хека оказалось возможным получение соединения Б в мягких условиях и с хорошим выходом по следующей схеме:

Напишите уравнения реакций и структурные формулы соединений А и В.
РЕШЕНИЕ.
11-4. Восстановите левые части приведенных ниже уравнений химических реакций:
? → 2 Fe(OH)3 + 3 Ca(NO3)2 + 6 SО2
? → S + 2 FeS + 6 NaCl
? → 2 Cu(NO3)2 + 3 NO
? → 2 I2 + 2 FeCl3
? → NH4H2PO4 + (NH4)2HPO4
РЕШЕНИЕ.
2Fe(NO3)3 + 3 Ca(HSO3)2 = 2 Fe(OH)3 + 3 Ca(NO3)2 + 6 SО2
2 FeCl3 + 3 Na2S = S + 2 FeS + 6 NaCl
Cu2O + 7 NO2 = 2 Cu(NO3)2 + 3 NO
2 FeI2 + 3 Cl2 = 2 I2 + 2 FeCl3
3 NH3 + 2 H3PO4 = NH4H2PO4 + (NH4)2HPO4
11-5. Массовая доля металла в смеси хлорида и фторида, в которых этот металл проявляет степень окисления + 2, равна 0,1629. Вычислите массовую долю хлорид-иона в смеси солей.
РЕШЕНИЕ.
Пусть n(MeCl2+MeF2) = 1 моль, n(Cl-) = x моль, n(F-) = (2-x) моль. Тогда n(Me2+) = 1 моль.

M(Me) = 0,1629∙m(Me) + 5,78295х + 6,1902 – 0,1629∙x, откуда

В этом случае масса металла M(Me) > 7,395, поэтому металл может быть бериллием.
Вычисляем количество вещества хлорид-иона в смеси:
x = n(Cl-) =  = 0,5 моль
= 0,5 моль
Массовая доля хлорид-иона в смеси солей равна:
w(Cl-) = 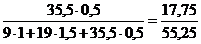 = 0,321 (32,1 %)
= 0,321 (32,1 %)
Для магния M(Mg)=24г/моль величина x = n(Cl-)=  =5,171 моль, такое значение n(Cl-) приводит к отрицательному значению n(F-), чего не может быть. Следовательно, в состав смеси солей входит бериллий
=5,171 моль, такое значение n(Cl-) приводит к отрицательному значению n(F-), чего не может быть. Следовательно, в состав смеси солей входит бериллий
ОТВЕТ: w(Cl-) = 0,321 (32,1 %)