В органической химии различают четыре вида реакций по конечному результату и изменению в структуре субстрата:
присоединения, замещения, отщепления, или элиминирования, и перегруппировки (изомеризации).
Такая классификация аналогична классификации реакций в неорганической химии по числу исходных реагентов и образующихся веществ, с изменением или без изменения состава. Классификация по конечному результату основана на формальных признаках, так как стехиометрическое уравнение, как правило, не отражает механизм реакции. Сравним типы реакций в неорганической и органической химии.
| Тип реакции в неорганической химии | Пример | Тип реакции в органической химии | Разновидность и пример реакции | |
| 1. Соединение | Cl2+H2=2HCl | Присоединение по кратным связям | Гидрирование

| Гидрогалогенирование

|
Галогенирование

| Гидратация

| |||
| 2. Разложение | 2H2O=2H2+O2 | Элиминирование | Дегидрирование

| Дегидрогалогенирование

|
Дегалогенирование

| Дегидратация

| |||
| 3. Замещение | Zn+2HCl=ZnCl2+H2 | Замещение | 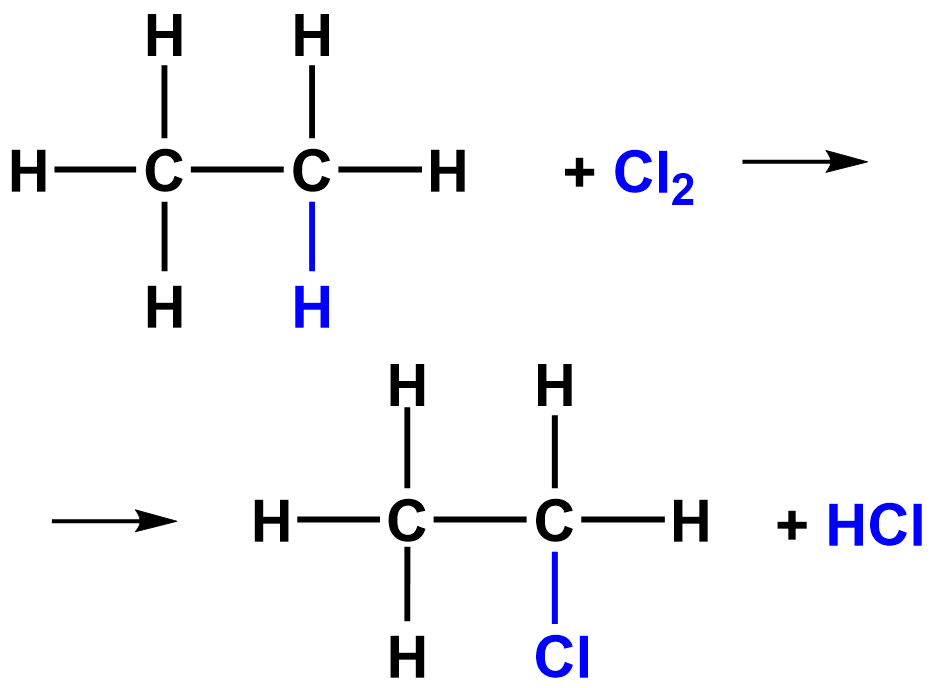 
| |
| 4. Обмен (частный случай — нейтрализация) | H2SO4+2NaOH= Na2SO4+2H2O | частный случай — этерификация |  
| |
| 5.Аллотропизация | графит⇔ алмаз красн. бел.Pкрасн.⇔P бел. ромб.пласт.Sромб.⇔Sпласт. | Изомеризация | Изомеризация алканов
 
|
ОПРЕДЕЛЕНИЕ
Элиминирование — отщепление от молекулы органических соединений частиц (атомов или атомных групп) без замены их другими.
В зависимости от того, какие атомы отщепляются — соседние C – C или изолированные двумя-тремя, или более атомами углерода – C –C–C– C –, – C –C–C–C– C –, могут образовываться соединения с кратными связям и или циклические соединения. Отщепление галогеноводородов из алкилгалогенидов либо воды из спиртов происходит по правилу Зайцева.
ОПРЕДЕЛЕНИЕ
Правило Зайцева: атом водорода Н отщепляется от наименее гидрогенизированного атома углерода.
Например, отщепление молекулы бромоводорода происходит от соседних атомов в присутствии щелочи, при этом образуется бромид натрия и вода.

ОПРЕДЕЛЕНИЕ
Перегруппировка — химическая реакция, в результате которой происходит изменение взаимного расположения атомов в молекуле, перемещение кратных связей или изменение их кратности.
Перегруппировка может осуществляться с сохранением атомного состава молекулы (изомеризация) или с его изменением.
ОПРЕДЕЛЕНИЕ
Изомеризация — частный случай реакции перегруппировки, приводящая к превращению химического соединения в изомер путем структурного изменения углеродного скелета.
Перегруппировка тоже может осуществляться по гомолитическому или гетеролитическому механизму. Молекулярные перегруппировки могут классифицироваться по разным признакам, например, по насыщенности систем, по природе мигрирующей группы, по стереоспецифичности и др. Многие реакции перегруппировки имеют специфические названия — перегруппировка Кляйзена, перегруппировка Бекмана и др.
Реакции изомеризации широко используются в промышленных процессах, например, при переработке нефти для повышения октанового числа бензина. Примером изомеризации является превращение н -октана в изооктан:


КЛАССИФИКАЦИЯ ОРГАНИЧЕСКИХ РЕАКЦИЙ ПО ТИПУ РЕАГЕНТА РАЗРЫВ СВЯЗИ
Разрыв связи в органических соединениях может гомолитическим и гетеролитическим.

ОПРЕДЕЛЕНИЕ
Гомолитический разрыв связи — это такой разрыв, в результате которого каждый атом получает неспаренный электрон и образуются две частицы, имеющие сходное электронное строение — свободные радикалы.
Гомолитический разрыв характерен для неполярных или слабополярных связей, например, C–C, Cl–Cl, C–H, и требует большого количества энергии.
Образующиеся радикалы, имеющие неспаренный электрон, обладают высокой реакционной способностью, поэтому химические процессы, протекающие с участием таких частиц, часто носят «цепной» характер, их трудно контролировать, а в результате реакции получается набор продуктов замещения. Так, при хлорировании метана продуктами замещения являются хлорметан CH3Cl, дихлорметан CH2Cl2, хлороформ CHCl3 и четыреххлористый углерод CCl4. Реакции с участием свободных радикалов протекают по обменному механизму образования химических связей.
Образующиеся в ходе такого разрыва связи радикалы обуславливают радикальный механизм протекания реакции. Радикальные реакции обычно протекают при повышенных температурах или при излучении (например, свет).
В силу своей высокой реакционной способности свободные радикалы могут оказывать негативное воздействие на организм человека, разрушая клеточные мембраны, воздействуя на ДНК и вызывая преждевременное старение. Эти процессы связаны, в первую очередь, с пероксидным окислением липидов, то есть разрушением структуры полиненасыщенных кислот, образующих жир внутри клеточной мембраны.
ОПРЕДЕЛЕНИЕ
Гетеролитический разрыв связи — это такой разрыв, при котором электронная пара остается у более электроотрицательного атома и образуются две заряженные частицы — ионы: катион (положительный) и анион (отрицательный).
В химических реакциях эти частицы выполняют функции «нуклеофилов » («фил» — от гр. любить) и «электрофилов », образуя химическую связь с партнером по реакции по донорно-акцепторному механизму. Частицы-нуклеофилы предоставляют электронную пару для образования новой связи.
ОПРЕДЕЛЕНИЕ
Нуклеофил — электроноизбыточный химический реагент, способный взаимодействовать с электронодефицитными соединениями.
Примерами нуклеофилов являются любые анионы (Cl−, I−, NO3− и др.), а также соединения, имеющие неподеленную электронную пару (NH3, H2O).
Таким образом, при разрыве связи могут образоваться радикалы или нуклеофилы и электрофилы. Исходя из этого выделяют три механизма протекания органических реакций.
МЕХАНИЗМЫПРОТЕКАНИЯ ОРГАНИЧЕСКИХ РЕАКЦИЙ
Свободно-радикальный механизм: реакцию начинают свободные радикалы, образующиеся при гомолитическом разрыве связи в молекуле.
Наиболее типичный вариант — образование радикалов хлора или брома при УФ-облучении.
1. Свободно-радикальное замещение
Метан - хлорметан
Инициирование цепи
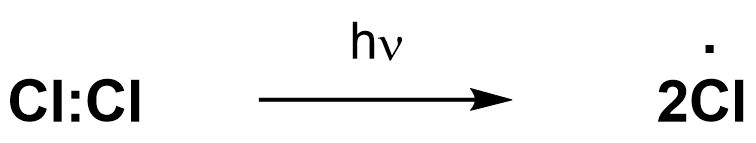
Рост цепи

Обрыв цепи
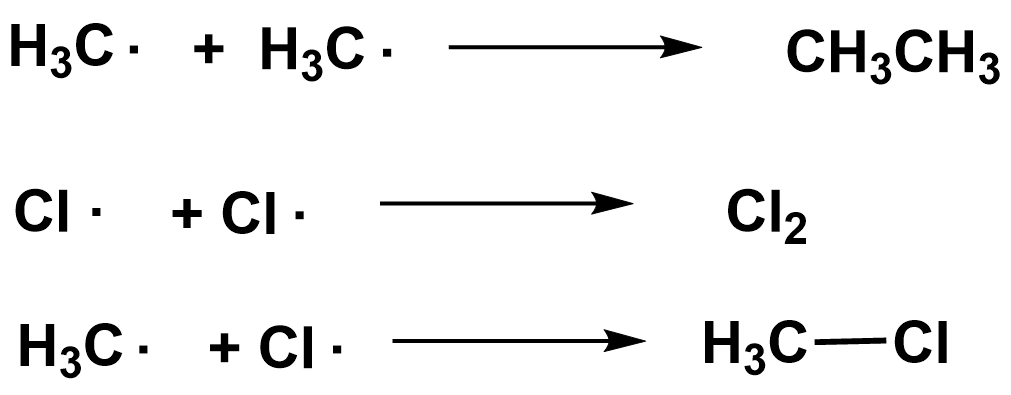
2. Свободно-радикальное присоединение

Этен полиэтилен
Электрофильный механизм: реакцию начинают частицы-электрофилы, получающие положительный заряд в результате гетеролитического разрыва связи. Все электрофилы — кислоты Льюиса.
Такие частицы активно образуются под действием кислот Льюиса, которые усиливают положительный заряд частицы. Чаще других используются AlCl3, FeCl3, FeBr3, ZnCl2, выполняющие функции катализатора.
Местом атаки частицы-электрофила являются те участки молекулы, которые имеют повышенную электронную плотность, т. е. кратная связь и бензольное кольцо.
Общий вид реакций электрофильного замещения можно выразить уравнением:

1. Электрофильное замещение

Бензол бромбензол
2. Электрофильное присоединение

Пропен 2-бромпропан
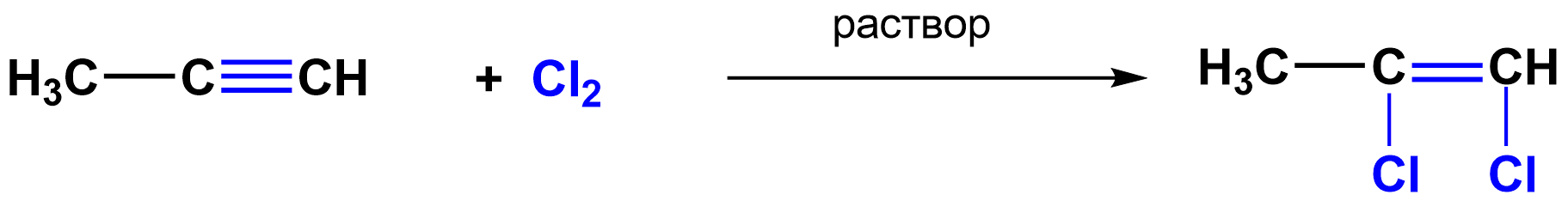
Пропин 1,2-дихлорпропен
Присоединение к несимметричным непредельным углеводородам происходит в соответствии с правилом Марковникова.
ОПРЕДЕЛЕНИЕ
Правило Марковникова: присоединение к несимметричным алкенам молекул сложных веществ с условной формулой НХ (где Х — это атом галогена или гидроксильная группа ОН–) атом водорода присоединяется к наиболее гидрогенизированному (содержащему больше всего атомов водорода) атому углерода при двойной связи, а Х — к наименее гидрогенизированному.
Например, присоединение хлороводорода HCl к молекуле пропена CH3–CH=CH2.


Реакция протекает по механизму электрофильного присоединения. За счет электронодонорного влияния CH3-группы электронная плотность в молекуле субстрата смещена к центральному атому углерода (индуктивный эффект), а затем по системе двойных связей — к концевому атому углерода CH2-группы (мезомерный эффект). Таким образом, избыточный отрицательный заряд локализован именно на этом атоме. Поэтому атаку начинает протон водорода H+, являющийся электрофильной частицей. Образуется положительно заряженный карбеновый ион [CH3–CH−CH3]+, к которому присоединяется анион хлора Cl−.
ОПРЕДЕЛЕНИЕ
Исключения из правила Марковникова: реакция присоединения протекает против правила Марковникова, если в реакцию вступают соединения, у которых атом углерода, соседний с атомом углерода двойной связи, оттягивает на себя частично электронную плотность, то есть при наличии заместителей, проявляющих значительный электроноакцепторный эффект (–CCl3,–CN,–COOH и др.).

Нуклеофильный механизм: реакцию начинают частицы-нуклеофилы, имеющие отрицательный заряд, образовавшиеся в результате гетеролитического разрыва связи. Все нуклеофилы — основания Льюиса.
В нуклеофильных реакциях реагент (нуклеофил) имеет на одном из атомов свободную пару электронов и является нейтральной молекулой или анионом (Hal–, OH–, RO−, RS–, RCOO–, R–, CN–, H2O, ROH, NH3, RNH2 и др.).
Нуклеофил атакует в субстрате атом с наименьшей электронной плотностью (т. е. с частичным или полным положительным зарядом). Первой стадией реакции нуклеофильного замещения является ионизация субстрата с образованием карбкатиона. При этом новая связь образуется за счет электронной пары нуклеофила, а старая претерпевает гетеролитический разрыв с последующим отщеплением катиона. Примером нуклеофильной реакции может служить нуклеофильное замещение (символ SN) у насыщенного атома углерода, например, щелочной гидролиз бромпроизводных.
1. Нуклеофильное замещение

2. Нуклеофильное присоединение

Этаналь циангидрин
Упражнения.
1. Для следующих ниже реакций укажите, какие связи разрываются и какие новые связи образуются:

| № реакции | Разрываются связи | Образуются связи |
2. Какой состав смеси монобромидов, образовавшихся при бромировании изобутана (СН3)2СНСН3, если известно, что отношение реакционных способностей С–Н-связей в этой реакции у первичного, вторичного и третичного атомов углерода равно 1:82:1600?
3. Какие радикалы теоретически могут образоваться при гомолитическом разрыве связей в соединениях:
а) СН3–СН2–Сl;
б) Вr–СН2–СН2–О–Н?
4. Из предложенных ниже реакций определите реакции замещения, реакции присоединения, реакции элиминирования:

5. В приведенных ниже соединениях у элементов, разность электроотрицательностей которых равна 0,5 или более, обозначьте частичные заряды  + и
+ и  – (т.е. укажите полярность):
– (т.е. укажите полярность):

6. Сколько  - и сколько
- и сколько  -связей в молекулах соединений:
-связей в молекулах соединений:

7. Выберите из приведенных ниже частиц карбкатионы и карбанионы:

8. Какие из приведенных частиц и молекул являются нуклеофилами (обозначьте Nu) и какие электрофилами (Е):

9. Для приведенных ниже реакций укажите: а) субстрат; б) реагент; в) продукт реакции; г) уходящую группу. Определите реакции: нуклеофильного замещения (NuS), электрофильного присоединения (ЕАd), элиминирования под действием оснований (ЕlNu) и элиминирования под действием кислот (ЕlE).

10. Укажите, какие реакции протекают по радикальному механизму, а какие по ионному:

Ответы на упражнения к теме 1
Урок 6
1.
| № реакции | Разрываются связи | Образуются связи |
| С–Н и Cl–Cl | C–Cl и Н–Сl | |

| C–H и C–Cl | |
| C–Cl и K+OH– | C–OH и K+Cl– |
2. В молекуле (СН3)2СНСН3 девять первичных атомов Н и один третичный Н. С учетом разной реакционной способности связей С–Н соотношение продуктов монобромирования: (СН3)2СНСН2Вr/(СН3)2СВrСН3 = 9/1600 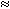 1/178, или
1/178, или 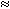 0,56% и 99,44%.
0,56% и 99,44%.
3. При гомолитическом разрыве связей в принципе могут образоваться радикалы:
| Формула соединения | Некоторые возможные радикалы | ||||||
| СН3СН2Сl | Н• | Сl• | СН3СН2• | 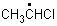
| •СН2СН2Сl | СН3• | •СН2Сl |
| BrСН2СН2OH | Br• | H• | BrСН2• | •СН2CН2OH | BrСН2СН2• | •OH | •СН2OH |
4.

5.

7.

8.

9.
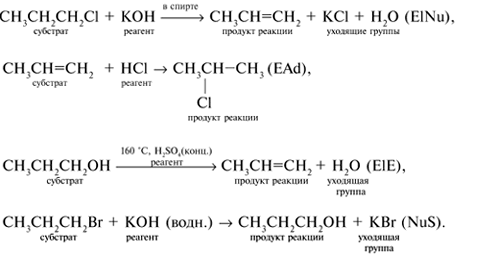
10.
