Важнейшие окислители и восстановители
Окислители
Восстановители
Простые вещества: все галогены, кислород, сера
Щелочные и щелочноземельные металлы, алюминий, цинк, водород.
Сложные вещества: HNO3, H2SO4, KMnO4, KClO3, MnO2, K2Cr2O7
KI,H2S, FeSO4, HCl, CO, NH3
Вещества, проявляющие как окислительные, так и восстановительные свойства
H2O2, KNO2, SO2, Na2SO3
Это зависит от величины степени окисления элементов, которые входят в состав вещества.
Если в состав вещества входит элемент с высшей степенью окисления, он может только понижать ее, т. е. участвовать в процессе восстановления. Следовательно, данное вещество может только присоединять электроны и выступать только в роли окислителя. НапримерKMnO4.
Если в состав вещества входит элемент с низшей степенью окисления, он может только повышать ее, т. е. участвовать в процессе окисления. Следовательно, данное вещество может только отдавать электроны и выступать только в роли восстановителя. НапримерNH3.
Если в состав вещества входит элемент с промежуточной степенью окисления, он может как повышать, так и понижать ее, т. е. участвовать и в процессе окисления, и в процессе восстановления. Следовательно, данное вещество может быть и окислителем и восстановителем. НапримерNa2SO3.
Типы окислительно-восстановительных реакций
1. межмолекулярные реакции. В этих реакциях элемент-окислитель и элемент-восстановитель входят в состав молекул различных веществ.
N2+2H2=2NH3
2. внутримолекулярные реакции. В этих реакциях элемент-окислитель и элемент-восстановитель входят в состав одного вещества.
NH4NO2=N2+2H2O
3. реакции диспропорционирования. Это ОВР, при протекании которых один и тот же элемент, находящийся в промежуточной степени окисления, и окисляется и восстанавливается.
2NO2+H2O=HNO2+HNO3
Метод электронного баланса.Правила расстановки коэффициентов методом электронного баланса
1. Расставить степени окисления.
2. Выписать элементы, изменившие степени окисления, указав число отданных и принятых электронов. Определить окислитель и восстановитель.
3. Поставить дополнительные коэффициенты, уравняв число отданных и принятых электронов.
4. Проверить эти коэффициенты: они должны соответствовать числу атомов данного элемента в молекуле. Например, если дополнительный коэффициент нечетный, а в молекуле четное число атомов (например, Сl2), то оба дополнительных коэффициента удваиваются.
5. Проверенные коэффициенты переносят в уравнение к тем атомам, которые с данной степенью окисления встречаются в уравнении один раз.
6. Уравнивают атомы металлов; неметаллов; водорода.
7. Проверяют по кислороду.
Рассмотрим эти правила на примере. Требуется расставить коэффициенты в схеме реакции:
KMnO4+ HCl —> Cl2+ MnCl2+ KCl + H2O.
Выполняем пп. 1–3 правил:
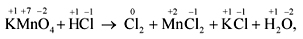
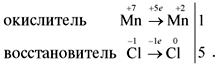
Поскольку число атомов хлора в молекуле четное (2), а коэффициент к хлору нечетный (5), удвоим оба дополнительных коэффициента (в соответствии с п. 4):
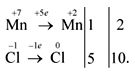
Согласно п. 5, переносим коэффициенты к атомам марганца и хлора (кроме  , которые встречаются в уравнении реакции три раза):
, которые встречаются в уравнении реакции три раза):
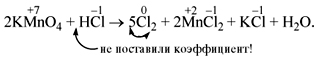
Обратите внимание, что перед молекулой хлора поставлен коэффициент 5, а не 10, т.к. нужно считать атомы хлора: 5•2 = 10 атомов.
Уравняем остальные атомы:
2KMnО4 + 16НСl = 5Сl2 + 2MnСl2 + 2KСl + 8Н2O.
Атомы кислорода до и после реакции пересчитайте самостоятельно.
Задание 3. Уравнять методом электронного баланса:
Zn + HNO3—>Zn(NO3)2+ N2O + H2O,
Al + H2SO4—>Al2(SO4)3+ H2S + H2O,
KMnO4+ H2SO3 —> K2SO4+ H2SO4+ MnSO4+ H2O
Занятие
Самостоятельная работа по вариантам.
Вариант1
1.Определите степень окисления всех атомов:
K2SO3, H2SO4, KClO3, K2Cr2O7, Ca3(PO4)2, KOH.
2. Расставьте коэффициенты в следующих схемах реакций и укажите окислитель и восстановитель:
KNO2+KMnO4+H2SO4→ KNO3+MnSO4+K2SO4+H2O
K2Cr2O7+KNO2+H2SO4→ KNO3+Cr2(SO4)3+ K2SO4+H2O
3.К какому типу окислительно-восстановительных реакций относятся данные реакции, расставьте коэффициенты методом электронного баланса:
KMnO4→ K2MnO4+MnO2+O2
HClO3+H2S→ HCl+H2SO4
Вариант 2
1.Определите степень окисления всех атомов:
KClO4, Na2S, K2CrO4, KNO2, H3PO4, Na2SO3
2. Расставьте коэффициенты в следующих схемах реакций, и укажите окислитель и восстановитель:
NaCrO2+Br2+NaOH → Na2CrO4+NaBr+H2O
KMnO4+H2S+H2SO4 →S + MnSO4+K2SO4+H2O
3.К какому типу окислительно-восстановительных реакций относятся данные реакции, расставьте коэффициенты методом электронного баланса:
K2MnO4+H2O → KMnO4+MnO2+KOH
Na2SO3 → Na2SO4+Na2S