Прохождение практики осуществлялось на кампусе ДВФУ в ШБМ с 26.06.2017 г. по 15.07.2017 г.
Краткая характеристика деятельности предприятия, учреждения
ДВФУ — один из крупнейших вузов на Дальнем Востоке России, академический форпост страны в Азиатско-Тихоокеанском регионе. Концентрация в университетском кампусе на острове Русском интернациональных образовательных программ и научных исследований, наличие уникального оборудования, привлечение ученых и преподавателей с мировым именем, владеющих современными образовательными технологиями, позволяет создавать условия для обучения и воспитания нового поколения мотивированных и современно мыслящих молодых людей.
Университет переходит к новому этапу своего развития, цель которого — превратить ДВФУ в крупнейший на Дальнем Востоке образовательный, исследовательский и инновационный центр, привлекающий к себе талантливую молодежь, лучших ученых, высокотехнологичный бизнес из России и из-за рубежа.
Школа биомедицины Дальневосточного федерального университета стремится занять достойное место среди ведущих медицинских высших учебных заведений и факультетов России. Это будет достигнуто за счет прорывных исследований в фундаментальных науках и клинической медицине, нацеленных на предупреждение и лечение болезней человека и улучшение качества жизни, а также путем повышения уровня образования будущих ученых и клиницистов.
Цели практики: ознакомившись с основными правилами техники безопасности при проведении лабораторных исследований, изучить устройство и эксплуатацию общелабораторного оборудования. Научиться готовить растворы заданной концентрации, доводить растворы до заданного pH, ознакомиться с методами расчета концентраций. Освоить основные принципы приготовления гистологических препаратов и их анализа. Научиться выделять белки из биологических образцов и визуализировать их, попутно определяя молекулярную массу, с помощью электрофореза.
Задачи практики:
· Ознакомиться с принципами устройства и эксплуатации общелабораторного оборудования и технологией мытья и стерилизации лабораторной посуды.
· Приготовить растворы для работы с белками и для гистологической части учебной практики с доведением до нужного pH и без доведения.
· Взять биологический материал лабораторной крысы чистой линии для проведения гистологических работ.
· Приготовить гистологический препарат из ткани крысы (спинной мозг).
· Разморозить клеточные культуры (глиома С6), оценить их жизнеспособность. Оценить влияние эмбриональной бычьей сыворотки на рост клеточных линий. Провести МТТ-тест.
· Извлечь белки из печени крысы и приготовить три их фракции с известной концентрацией. Для этого необходимо использовать микробиуретовый метод и, далее, произвести диализ полученных фракций.
· Провести электрофорез белков, предварительно приготовив необходимые растворы.
· Ознакомиться с методами световой микроскопии. Изучить устройство светового микроскопа.
· Научиться применять методы различных видов микроскопии для медико-биологических работ.
· Проанализировать полученные препараты.
· Полученные знания на практике применять в дальнейшей учебе и работе.
ОСНОВНАЯ ЧАСТЬ
Краткая характеристика деятельности предприятия, учреждения
Организационная структура предприятия, учреждения
Лаборатория «Биомедицинских клеточных технологий», находящаяся в ШБМ, ДВФУ.
Организация рабочего места
Рабочее место представляет собой 7 специализированных лабораторных комнат, оснащенных специальной мебелью и приборами для молекулярно-биологических работ, приготовления гистологических препаратов
Результаты выполнения программы практики:
Вводная часть
Во-первых, мы ознакомились с техникой безопасности, правилами работы с оборудованием в лаборатории, схемой мытья лабораторной посуды. Последняя представляет из себя последовательность этапов:
1. Мытье с порошком;
2. Цикл химика (10 в проточной воде, 3 раза в дистиллированной);
3. Замачивание в 10% р-ре «Белизны» (гипохлорит натрия) (от 2-х ч. до 3 сут.);
4. Цикл химика;
5. Замачивание в 1% р-ре 7X (от 2-х ч. до 7 сут.);
6. Цикл химика;
7. Замачивание в дистиллированной воде на срок от 15 мин. до 2-х часов;
8. Сушка на столе;
9. Сушка в сухожаровом шкафу (при необходимости)
Во-вторых, мы выполняли задания по приготовлению растворов с заданной концентрацией с доведением до нужного pH и без него. Выполняя индивидуальное задание, я приготовил 1000 мл 192 мМ раствора трис-глицинового буфера, доведя его pH до значения 8,4
Приготовление растворов
Методом навески и доведения до нужной концентрации приготовили следующие растворы: PBS 2000 мл, 1,5 М трис-HCl, pH 8,9 50 мл, 192 мМ трис-глициновый буфер, pH 8,4 1000 мл, 0,1 М ЭДТА 50 мл, 0,5 М трис-HCl, pH 6,7 50 мл, насыщенный (0 по Цельсию) сульфат аммония 100 мл, 30% раствор акриламида-метиленбисакриламида 50 мл, PMSF 150 мМ 10 мл, 70% этиловый спирт 200 мл, 90% этиловый спирт 200 мл, 100% этиловый спирт 200 мл, этиловый спирт:Ксилол 3:1 200 мл, этиловый спирт:ксилол 1:3 200 мл, PFA-PBS 200 мл, 50% водный раствор глицерина 50 мл, спирт:уксусная кислота:вода 3:6:1 500 мл, 30% гидроксид натрия, 0,2% сульфата меди 200 мл, 50% этиловый спирт 200 мл, ксилол:Парафин 1:1 200 мл, кумасси синий G-250, 500 мл
Белки
Первым этапом был выбор источника биоматериала. Им оказалась печень лабораторной крысы чистой линии. Вторым этапом было взятие биоматериала, его пестичная гомогенизация (грубый экстракт) с добавлением PBS и PMSF (ингибитор сериновых протеаз). Вторым этапом было осветление - мы центрифугировали смесь, отделили супернатант, тем самым проведя экстракцию белков. Третий этап, высаливание, мы проводили в несколько этапов:
1. Добавление сульфата аммония 30% насыщения, центрифугирование. Сушка осадка на фильтровальной бумаге;
2. Добавление в надосадочную жидкость сульфата аммония 50% насыщения, центрифугирование. Сушка осадка на фильтровальной бумаге;
3. Добавление в надосадочную жидкость сульфата аммония 70% насыщения, центрифугирование, сушка осадка, надосадочную жидкость вылили.
Необходимый объем сульфата аммония мы каждый раз рассчитывали по формуле:  , где Х1- исходная степень насыщения, а Х2-конечная. Четвертым этапом был диализ: мы разбавили 3 получившихся осадка фосфатным буфером, сделали диализные мешки, поместили их в PBS и оставили на ночь. Далее провели электрофорез. Непосредственно для электрофореза приготовили два геля, концентрирующий и разделяющий. Собрали установку для электрофореза, а затем залили сначала разделяющий гель, затем концентрирующий. В образовавшиеся кармашки залили образцы, а по бокам стандарты. По окончании электрофореза отделили концентрирующий гель с белками от стекол и поместили в краситель Кумасси. После окраски на специальном приборе получаем следующее изображение
, где Х1- исходная степень насыщения, а Х2-конечная. Четвертым этапом был диализ: мы разбавили 3 получившихся осадка фосфатным буфером, сделали диализные мешки, поместили их в PBS и оставили на ночь. Далее провели электрофорез. Непосредственно для электрофореза приготовили два геля, концентрирующий и разделяющий. Собрали установку для электрофореза, а затем залили сначала разделяющий гель, затем концентрирующий. В образовавшиеся кармашки залили образцы, а по бокам стандарты. По окончании электрофореза отделили концентрирующий гель с белками от стекол и поместили в краситель Кумасси. После окраски на специальном приборе получаем следующее изображение
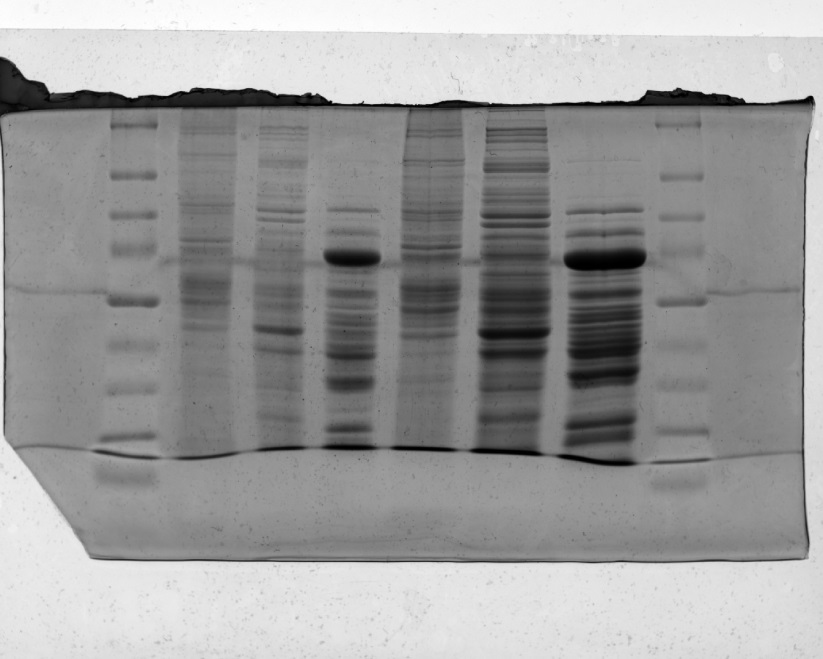
Разделение полос прошло успешно. Зная стандарты, можно теперь узнать молекулярные массы (в дальтонах) исходных белков печени крысы.
Культура клеток.
Прежде всего, мы ознакомились с основными принципами организации лаборатории для культивирования и прослушали теоретическую часть. После этого нам выдали культуру глиомы С6 мозга человека в культуральном фласке Т75.Приготовив рабочий раствор трипсина 0,25% концентрации, добавил его во фласк. Инкубировали 10 минут при температуре 37 градусов по Цельсию при содержании углекислого газа 5%. Слив суспензию свободных клеток (около 5 мл) в Falcon, добавили к клеткам краситель трипановый синий, что позволил нам определить концентрацию живых клеток в камере Горяева. Чтобы избавиться от среды, содержащей остатки трипсина, осадили клетки центрифугированием. Поместили клетки в среду DMEM, содержащую компоненты: 10% FBS с ростовыми факторами, 1% пеницилина-стрептомицина, антимикотические препараты (получили стандартную среду культивирования). Далее приготовили 96-ти луночный планшет (6400 клеток/лунка, или 20000 клеток на см^2. Здесь был проведен МТТ-тест, использовавшийся в качестве контроля. В соседнем планшете приготовили 4 «столбца» лунок по два повтора, имея в каждом «столбцов» следующий состав:FBS + DMEM; 5% Паниксин + DMEM; 10% Паниксин + DMEM; 5% Паниксин + DMEM. Паниксин – это новый коммерческий препарат с неизвестным составом, являющийся искусственным заменителем эмбриональной бычьей сыворотки. Также в лунки добавили по 20 мкл раствора желтой соли реактива МТТ (MTT Solution (5 мг сухого вещества растворили в 1 мл PBS; приготовили раствор нужной концентрации)). Инкубировали планшеты 4 часа. Чтобы разрушить клетки и высвободить формазан (нерастворимый продукт МТТ реактива, получающийся в результате окисления МТТ реактива НАДФ-Н-зависимыми клеточными оксидоредуктазами), приготовили раствор МТТ Solvent (на изопропиловом спирте): 4 мМ НСl + 0,1 NP-40 + изопропанол. До начала инкубирования измерили светопоглощение формазана при начале культивирования, или то же самое, что светопоглощение 6400 клеток. В конце концов, проведя спектрофотометрию двух планшетов и использовав статистический метод оценки (Стьюдента) достоверности влияния эмбриональной бычьей сыворотки на рот клеточных линий, убедились в том, что раствор 10% Паниксина + DMEM оказал самое большое влияние на рост клеточной линии глиомы С6, что можно увидеть из графика.
Гистология.
Мы прослушали лекции по темам:
· Схема получения гистологических препаратов
· Биоэтика: работа с животными
Мы ознакомились с правилами обращения с лабораторными животными. Затем, умертвив крысу ингаляционным методом, взяли индивидуальный биоматериал (спинной мозг). Затем мы зафиксировали наши образцы 4% раствором параформальдегида (PFA) и оставили на ночь. На следующий день мы уплотнили наши образцы однократным фосфатным буфером (PBS) - 3 раза по 30 мин. После этого провели обезвоживание с помощью батареи спиртов (50%, 70%, 90%, 100% - каждый по 45 минут). Затем залили смесью спиртов (C2H5OH – Спирт изопропиловый в соотношении 3:1 на 30 минут и в соотношении 1:3 на ночь). Утром следующего дня мы провели заливку препаратов в парафин, проходящую в несколько стадий. Завершающей стадией была заливка в воск с парафином на ночь. В последний день мы изготовили парафиновые срезы, произвели их обработку (обратная батарея спиртов) и окраску. Свои препараты я окрашивала 2-мя способами: гематоксилин-эозин и Fast Green (pH=2.2).
Фотография исследуемого препарата (спинной мозг лабораторной крысы):
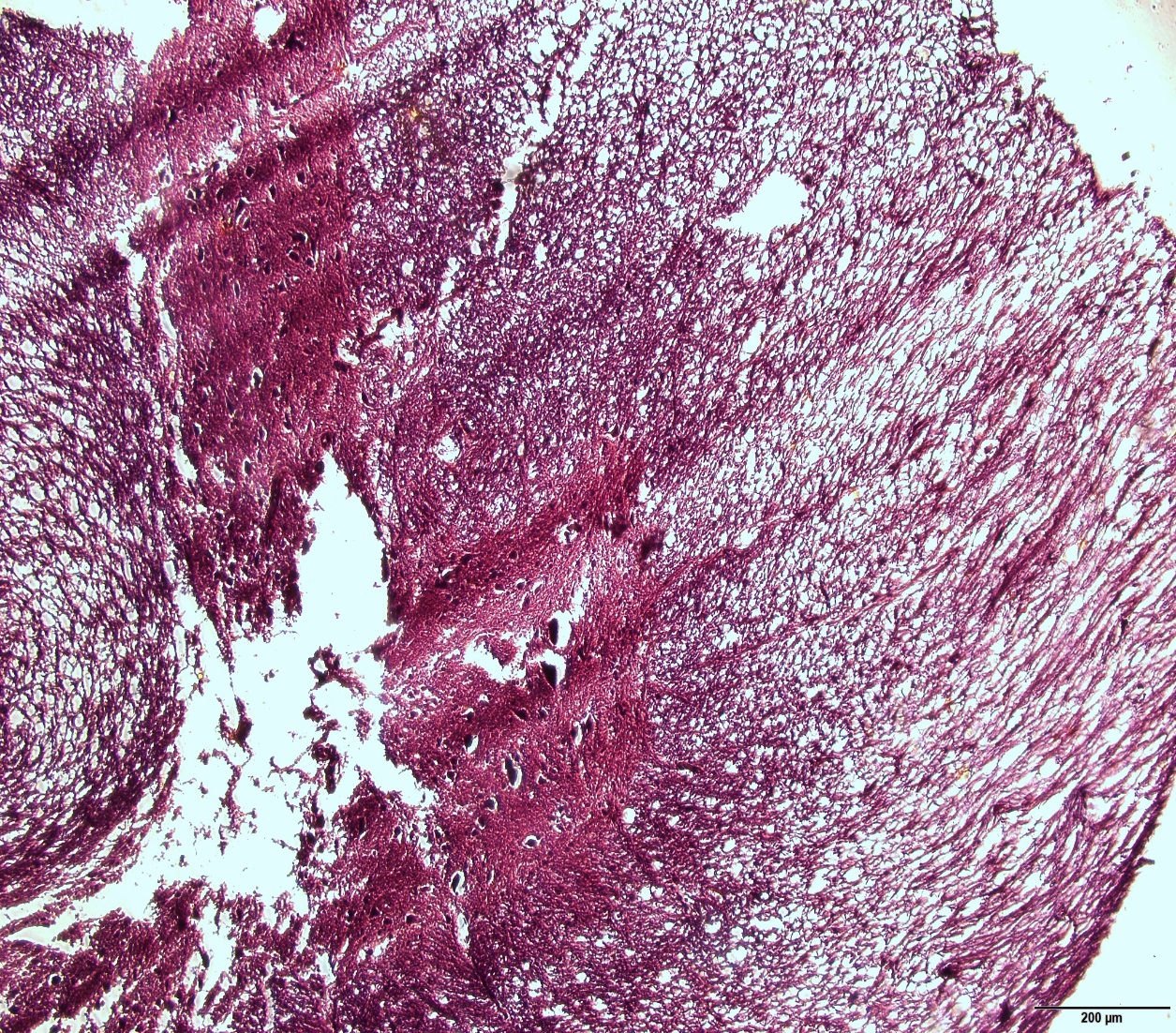
Отсутствие т.н. «бабочки», получающейся при поперечном срезе спинного мозга, связываем с механическими повреждениями, возникшими в ходе извлечения биологического материала из канала спинного мозга.