Вторичные ЭХГ – это аккумуляторы, в которых проходят обратимые процессы. Аккумуляторы перезаряжаются пропусканием постоянного тока в направлении, противоположном направлению тока в режиме разрядки. При этом активные соединения в элементе восстанавливаются в результате обратной химической реакции.
Свинцовый аккумулятор. Свинцовый аккумулятор – самый распространенный в настоящее время. Он был изобретен Ж.Планте в 1860 г. Аккумулятор состоит из положительного электрода (катода) – свинцовой пластинки с ячейками, заполненными пастообразным оксидом свинца PbO2. и отрицательного электрода (анода) – решетчатой пластинки, заполненной пастой из губчатого свинца. Каждый аккумулятор состоит из нескольких пар таких пластин, погруженных в электролит – разбавленный раствор серной кислоты – и соединенных последовательно. Напряжение заряженного элемента аккумулятора составляет 2 В. Состояние свинцового аккумулятора оценивается путем измерения относительной плотности электролита. Непосредственно после зарядки она составляет примерно 1,26, а по мере разрядки понижается почти до 1,0 (это объясняется тем, что серная кислота образует химическое соединение с материалом пластин, давая в остатке воду).
В процессе разряда аккумулятора, т.е. при его работе, на электродах протекают реакции:

Для заряда аккумулятора используют внешний источник тока, подключая его к электродам. В результате на электродах протекают процессы в обратном направлении:

Преимуществами свинцового аккумулятора являются: большая электрическая емкость, устойчивость к работе, большое количество циклов разряда – заряда. К недостаткам относятся: большая масса, малая удельная емкость, выделение водорода при заряде, негерметичность при наличии концентрированного раствора серной кислоты.
Экспериментальная часть
Для измерения электродного потенциала металла необходимо составить гальванический элемент (рис. 7) из исследуемого электрода (ИЭ) и электрода сравнения (ЭС). Для этого опустить ИЭ в раствор соли этого же металла или в морскую воду, а ЭС – в раствор хлорида калия (KCl) Затем с помощью электролитических мостиков соединить эти электроды через промежуточный сосуд с раствором хлорида калия. Это обеспечивает контакт электролитов, но препятствует их смешиванию.
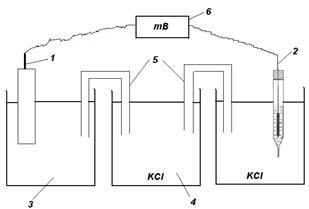
Рис. 7 Схема установки для измерения ЭДС гальванического элемента:
1 –исследуемый электрод (ИЭ); 2 – хлорсеребряный электрод (ЭС);
3 – сосуд с электролитом (раствором соли, морской водой и т.д.);
4 – промежуточный сосуд с насыщенным раствором KCl; 5 – солевые мостики; 6 – прибор для измерения ЭДС.
Электроды ИЭ и ЭС подключают к измерительному прибору таким образом, чтобы стрелка прибора отклонялась вправо. После измерения ЭДС (Е) гальванического элемента можно рассчитать электродный потенциал металла по формуле

В качестве электрода сравнения в данной работе используют хлорсеребряный электрод (см. приложение 2). Потенциал этого электрода, измеренный по отношению к стандартному водородному электроду, составляет  .
.
Так как φиэ по отношению к φэс может быть как катодом, так и анодом, то φиэ рассчитывается, соответственно:
А) φИЭ=  Е+ φэс = Е + 0,22
Е+ φэс = Е + 0,22
Б) φИЭ = φэс - Е = 0,22 - Е
Опыт 1. Влияние природы металла и состава электролита на величину электродного потенциала
Для работы использовать следующие металлы: Fe, Zn, Al, Cu, Mg.
Собрать гальванические элементы, состоящие из электрода сравнения и предложенных металлов в 1М растворах их солей. Измерить Е, рассчитать потенциалы исследуемых электродов и сравнить их с табличными данными (см. приложение 1). Измерить Е и рассчитать величины электродных потенциалов исследуемых металлов, погруженных в искусственную морскую воду. Результаты измерений занести в таблицу.
| Исследуемый металл | Электролит | Е,мВ | φМе, мВ | ||
| φр | φнр | φо | |||
| Fe | FeSO4 | - | |||
| Морская вода | - | ||||
| Zn | ZnSO4 | - | |||
| Морская вода | - | ||||
| Al | Al2(SO4)3 | - | |||
| Морская вода | - | ||||
| Cu | CuSO4 | - | |||
| Морская вода | - | ||||
| Mg | MgSO4 | - | |||
| Морская вода | - |
Опыт2. Влияние концентрации электролита на величину электродного потенциала.
Собрать гальванический элемент, состоящий из хлорсеребряного электрода сравнения и медного электрода.
Определить характер изменения потенциала медного электрода в зависимости от концентрации раствора сульфата меди. Для работы использовать растворы CuSO4 следующих концентраций:
1М; 0,1М; 0,01М; 0,001М.
Записать в таблицу результаты измерений Е, рассчитать величины потенциалов медных электродов и сравнить полученные данные с теоретическими значениями потенциалов (по формуле Нернста) при тех же концентрациях растворов.
| Исследуемый электрод (ИЭ) | Концентрация CuSO4 (моль/л) | Е, мВ | φиэ, мВ | |
| Экспериментальная величина | Теоретическая | |||
| Cu | 1M | |||
| 0,1M | ||||
| 0,01M | ||||
| 0,001M |
По полученным данным построить график экспериментальной и теоретической зависимости потенциала φр от концентрации [Cu2+]. Сделать вывод.
Опыт 3. Определение концентрации раствора соли.
Соберите гальванический элемент в соответствии с предложенной схемой записи:
A (-) Ag | AgCl, KCl║ MeA | Me (+) K
CX
Измерьте с помощью высокоомного вольтметра величину ЭДС элемента. Рассчитайте величину равновесного потенциала исследуемого электрода  . Затем, используя формулу Нернста, оцените концентрацию раствора соли металла CX=[MeA].
. Затем, используя формулу Нернста, оцените концентрацию раствора соли металла CX=[MeA].
Вопросы для самоконтроля по темам:
«Электродные потенциалы. Гальванический элемент»
1. Дайте определение понятия «электрод».
2. Дайте определение понятия «гальванический элемент».
3. Приведите схемы записи и полуреакции, протекающие в элементе для электродов:
– медного
– цинкового
– водородного
– хлорсеребряного.
4. Приведите примеры электродов сравнения.
5. Дайте определение понятиям:
- равновесный электродный потенциал;
- коррозионный электродный потенциал;
- стандартный электродный потенциал.
6. Приведите уравнение Нернста для расчета величины электродного потенциала для произвольного электрода и обозначьте входящие величины.
7. Укажите факторы, влияющие на величину электродного потенциала.
8. Приведите уравнение Нернста для расчета величины электродного потенциала для водородного электрода при известном значении pH.
9. Какой процесс протекает на катоде? на аноде?
10. Изобразите схематично гальванический элемент Якоби-Даниэля.
11. Запишите анодную, катодную и суммарную реакции, протекающие при работе гальванического элемента Якоби-Даниэля.
12. Приведите уравнение для расчета ЭДС гальванического элемента.
13. Каковы принципы составления гальванического элемента?
14. Приведите схему записи медно-цинкового гальванического элемента.
15. Приведите уравнения реакций, идущих на положительно и отрицательно заряженных электродах.
16. Приведите суммарную реакцию, идущую при работе медно-цинкового гальванического элемента.
17. Дайте определение понятия «концентрационный гальванический элемент.
18. Серебряные электроды погружены в растворы солей с концентрациями 0,1 М и 0.001 М. Назовите электрод-анод.
19. Приведите схему записи концентрационного гальванического элемента.
20. Приведите примеры первичных источников тока.
21. Приведите примеры вторичных источников тока.
22. Устройство элемента Лекланше.
23. Какие преимущества имеют топливные элементы по сравнению с другими источниками энергии?
24. Назовите вещества, используемые в топливных элементах в качестве реагентов.
ПРИМЕРЫРЕШЕНИЯ ЗАДАЧ
Пример 1. Составить схему гальванического элемента, анодом которого является магний, погруженный в раствор соли с концентрацией 0,01М.
Решение. 1. Записываем схему электрода: Mg|Mg2+
2. По уравнению Нернста рассчитываем величину электродного потенциала:
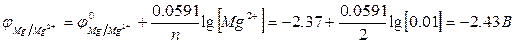
3. Так как в условии задачи не указан материал, из которого изготовлен катод, то используя соотношение φк > φа, выбираем металл с более положительным потенциалом. Например, цинковый электрод. Значение потенциала выбранного электрода определяем по таблице «Стандартные электродные потенциалы металлов при 250С».
Следовательно,  .
.
4. Записываем схему гальванического элемента:
А(-) Mg|Mg2+||Zn2+|Zn (+)K
5. Записываем электродные реакции:
А(-) Mg - 2e- ® Mg2+
K(+) Zn2+ + 2e- ® Zn0
Суммарная реакция: Mg0 + Zn2+ ® Mg2+ + Zn0
6. Рассчитываем ЭДС гальванического элемента:

Пример 2. Составьте схему гальванического элемента, состоящего из водородного электрода, погруженного в раствор с рН =3 и железного электрода, погруженного в раствор соли с концентрацией 0.1М. Рассчитайте ЭДС элемента.
Решение. 1. Записываем схемы электродов:
Водородный – 2Н+| Н2 (Pt);
Железный – Fe|Fe2+
2. По уравнению Нернста рассчитываем величину электродного потенциала железного электрода:

3. Используя уравнение Нернста [3] рассчитываем величину электродного потенциала водородного электрода.
Известно, что
 .
.
Таким образом, электродный потенциал водородного электрода можно записать следующим образом:


4. Используя соотношение φк > φа, определяем электрод-анод.
Так как величина φ-потенциала железного электрода меньше следовательно этот электрод является анодом: (-0,47 < -0,18)
5. Записываем схему гальванического элемента:
А(-) Fe|Fe2+||2H+|H2 (+) K
6. Рассчитываем ЭДС гальванического элемента.

Задания для самоконтроля
1. Составьте схему гальванического элемента, состоящего из никелевого электрода-катода, погруженного в раствор соли с концентрацией 0.02М. Напишите уравнения электродных реакций и вычислите ЭДС гальванического элемента.
2. Составьте схему гальванического элемента, состоящего из медного электрода, погруженного в раствор соли меди с концентрацией 0.01М и железного электрода, погруженного в раствор соли железа с концентрацией 0.1М. Напишите уравнения электродных реакций. Вычислите ЭДС гальванического элемента.
3. Составьте схему гальванического элемента, состоящего из стандартного водородного электрода и ртутного электрода. Рассчитайте его ЭДС при [Hg2+]=0,1 М. Напишите уравнения электродных реакций.
4. Составьте схему и рассчитайте ЭДС концентрационного гальванического элемента, составленного из двух железных электродов, погруженных в раствор соли железа с концентрациями 1 М и 0,01 М. Напишите уравнения электродных реакций.
5. В гальваническом элементе протекает химическая реакция
Zn+NiSO4=ZnSO4+Ni.
Напишите его схему и уравнения электродных реакций. Вычислите ЭДС этого элемента при стандартных условиях. Какой металл вместо никеля можно взять, чтобы увеличить ЭДС?
6. Составьте схему гальванического элемента, в котором протекает следующая реакция:
 Mn + CdSO4 = MnSO4 + Cd
Mn + CdSO4 = MnSO4 + Cd
Вычислите ЭДС при стандартных условиях.
7. ЭДС элемента (Pt) H2|HCl||AgCl|Ag при 250С равна 0.322 В. Чему равен рН раствора НСl? φAg = 0,22 В
8. Составьте схему гальванического элемента, состоящего из водородного электрода, погруженного в раствор с pH=5, и марганцевого электрода, погруженного в раствор соли марганца с концентрацией 0.2 М. Напишите уравнения электродных реакций и рассчитайте его ЭДС.
9. Составьте схему гальванического элемента, состоящего из водородного электрода, погруженного в раствор с pH=10, и серебряного электрода, погруженного в раствор соли серебра с концентрацией 0.01 М. Напишите уравнения электродных реакций и рассчитайте его ЭДС.
10. Напишите уравнения реакций, протекающих при работе медно-цинкового гальванического элемента. Укажите, как повлияют на электродвижущую силу этого элемента (повысят, понизят, оставят без изменения) следующие воздействия:
а) увеличение [Cu2+] до 3 М;
б) добавление в катодное пространство NaOH для осаждения Cu(OH)2;
в) удваивание размера цинкового электрода;
г) уменьшение [Zn2+] до 0.1 М;
д) повышение температуры.
11. Серебряную деталь с чернью из Ag2S поместили в оцинкованную емкость с мыльным раствором. Через некоторое время деталь стала блестящей, так как чернь полностью растворилась. Объясните, что послужило причиной растворения черни.
Приложение
Таблица № 1 Электрохимический ряд напряжений металлов (стандартные электродные потенциалы)
|
 Приложение 2
Приложение 2
Хлорсеребряный электрод.
1- серебряная проволока; 2 – слой AgCl;
3 – раствор KCl; 4 - микрощель.
Схема записи электрода: Ag|AgCl, KCl насыщ.
Реакция, протекающая на электроде

или

Уравнение Нернста для расчета величины электродного потенциала:

Литература
1. Глинка Н.Л. Общая химия: Учебник. Л.: Химия. 1985
2. Коровин Н.В., Масленникова Г.Н. и др. Курс общей химии. М., Высшая школа. 1990.
3. Химия. Справочные материалы. Под ред. академика Ю.Д.Третьякова. М., «Просвещение». 1994.
4. Зимон А.Д., Лещенко Н.Ф. Физическая химия. М., Химия. 2000.
5. Трусов В.И., Соколова Л.Б. Введение в химию для судостроителей. Часть 2. Учебное пособие. С.-Петербург, 1997.
6. Даниловская Л.П. Электрохимические процессы в технике. Методические указания. С.-Петербург, 1993.
7. Грицкевич А.И. Решение типовых задач по курсу общей химии. Методические указания. С.-Петербург, 2006.