Метод реализуется в двух вариантах – аналитическом и графическом.
Аналитический метод подбора уравнения заключается в том, что мы предлагаем общий порядок реакции (n) и выбираем необходимое уравнение (колонка 2.1 в таблице)
Критерием правильности выбора порядка реакции является расчет нескольких значений k и если они близки в пределах ошибки (k = const), то порядок выбран правильно. В противном случае выбираем новый порядок (n) и заново повторяем процедуру.
Пример решения разобран ниже.
Графический метод подбора уравнения (точнее метод спрямляющих координат) заключается, что для выбранного порядка строится график прямой линии в спрямляющихся координатах. Правильно выбранный порядок (n) отвечает лучшей линейной зависимости.
Пример 1. Кинетическая кривая для реакция между эквивалентными концентрациями А В при 24,8оС описывается следующими данными:
А + В à Пр
| t, мин | ||||||
| [I2], моль/л | 0,0251 | 0,0213 | 0,0177 | 0,0155 | 0,0124 | 0,0079 |
Определите среднее значение константы скорости реакции и время полупревращения
Решение:
Предложим, что возможные порядки реакции n – 1 или 2. Из данных видно, что при
| t = 0 C0A=0,0251. |
Из таблицы (кол. 2.1) n= 1; ln(CA) = ln(C0A) –k1t отсюда k 1= [ln(CA)/(C0A)]/t n=2; 1/ CA = 1/ CA 0 +k2t для CA = CВ отсюда k2 = [1/ CA - 1/ CA 0 )]/ t
рассчитает новые координаты ln(CA) и 1/ CA значения k для каждого t
| t, мин | ||||||
| [А], моль/л | 0,0251 | 0,0213 | 0,0177 | 0,0155 | 0,0124 | 0,0079 |
ln(CA) -3,685 -3,849 -4,034 -4,167 -4,390 -4,841
k1*103 1,44 1,28 1,19 1,07 0,83
1/ CA 39,84 46,95 56,50 64,52 80,65 126,58
k2*102 6,23 6,10 6,09 6,16 6,25
Найденные значения (аналитический метод) показывают постоянство k = 6,17*10-2 л/ моль*м для n=2. В то время как для k1 наблюдается ее уменьшение при увеличении времени.
График линейной зависимости также подтверждает 2 порядок реакции:
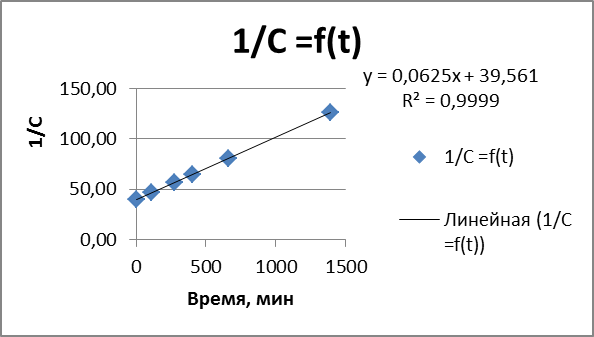
Для линейного графика критерием выбора порядка реакции является квадрат коэффициента корреляции R2
Чем выше значение коэффициента R2, тем лучше прямая.
Уравнение прямой представлено на графике У = kx +b
Тангенс угла наклона tga = k = 0,0625
Определив порядок реакции, можно найти время полупревращения (кол 3 в таблице)
t1/2 = 1/(kCA0) = 1/( 6,25*10-2*0,0251) = 645 мин
Выражение для скорости реакции r = kCa2
Решенная задача представляет 1 тип кинетических данных – для реакции известны как начальные концентрации реагентов, так и зависимости изменения концентрации исходных веществ от времени.
Алгоритм решения в общем виде:
Решение: 1. Предполагаем порядок простой реакции = nI.
2. Записываем выражение для скорости реакции
3. Выбираем из таблицы интегральное выражение для данной реакции
4. Находим k по крайней мере для трех точек и подтверждает правильность
выбора порядка реакции и затем находим t1/2
2 тип кинетических данных– для реакции: Даны только начальные концентрации реагентов и зависимость изменения концентрации только одного из участников реакции от времени.
Пример 2.
Для газофазной реакции
N2O5 = N2O4 + ½ O2
При 25оС получены следующие опытные данные:
t, мин………,,0 20 30 40 50 60 ¥
Р(О2), атм…… 0 0,821 1,237 1,640 2,051 2,470 5,000
Определить порядок реакции, значение константы скорости, время полупревращения и записать выражение для скорости реакции
Как видно из экспериментальных данных в задаче имеется только информация о кинетической кривой продукта реакции О2, в то время как нам необходима информация о кинетической кривой исходного N2O5 . Для связи концентраций между собой используем уравнение материального баланса (МБ).
Уравнение материального баланса (МБ) в общем виде имеет вид:
Сi = Coi ± (ni/nст)*хст,
где nст и хст – стехиометрический коэффициент и изменение концентрация любого вещества по которому есть информация в задаче.
± относится к типу вещества – исходное (-) и конечное (+)
Уравнение материального баланса справедливо и для числа молей
ni = noi ± (ni/nст)*хст
и для давления: Рi = Рoi ± (ni/nст)*хст
Алгоритм решения:
1. Предполагаем порядок простой реакции = nI.
2. Записываем выражение для скорости реакции
3. Выбираем из таблицы интегральное выражение для данной реакции
4. Используя уравнения материального баланса находим зависимость
концентрации всех исходных реагентов от времени
5. Находим k по крайней мере для трех точек и подтверждает правильность
выбора порядка реакции и затем находим t1/2
Решение
По уравнению МБ запишем выражение для давления N2O5 :
хст = хО2 и Р(N2O5) = Р0(N2O5) - (1/½)*хО2 = Р0(N2O5) - 2*хО2 .
Аналогично: Р(О2) = Р0(О2) - (½/½)*хО2 = Р0(О2) - *хО2 .
По условию задачи: Р0(О2) = Р(О2) при t = 0 и следовательно Р0(О2) = 0
В задаче отсутствует значение Р0(N2O5), которое тоже можно найти из МБ.
При бесконечно большом времени Р(N2O5) = 0 (весь реагент прореагировал), тогда
Р¥(N2O5) = Р0(N2O5) - 2*х¥О2 = 0 отсюда Р0(N2O5) = 2*х¥О2 =2*5 = 10 атм
Окончательно имеем уравнение связи:
Р(N2O5) = Р0(N2O5) - 2*хО2 = 2*х¥О2 - 2*хО2. Полученные данные запишем в таблицу
t, мин………, 0 20 30 40 50 60 ¥
Р(О2), атм…… 0 0,821 1,237 1,640 2,051 2,470 5,000
Р(N2O5), атм 10 8,358 7,526 6,720 5,898 5,060
Допустим, что n =0. Из таблицы кол. 2.1 à Р(N2O5) = Р0(N2O5) - kt, значит график в координатах Р(N2O5) = f(t) должна быть прямая линия.

Тангенс угла наклона tga = - k = -0,0822 и k = 8,22*10-2 1/мин
Время полупревращения t1/2 = РA0/2k = 10/2* 8,22*10-2 = 60,83 мин
Выражение для скорости реакции r = kР0 = k