Спирты
Спирты - кислородсодержащие органические соединения, функциональной группой которых является гидроксогруппа (OH) у насыщенного атома углерода.
Спирты также называют алкоголи. Первый член гомологического ряда - метанол - CH3OH. Общая формула их гомологического ряда - CnH2n+1OH.
Классификация спиртов
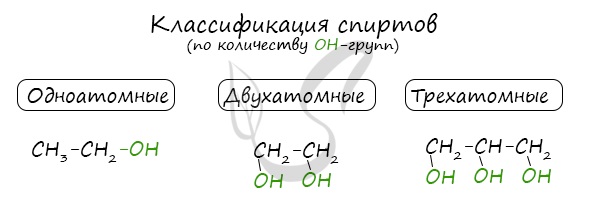
По числу OH групп спирты бывают одноатомными (1 группа OH), двухатомными (2 группы OH - гликоли), трехатомными (3 группы OH - глицерины) и т.д.
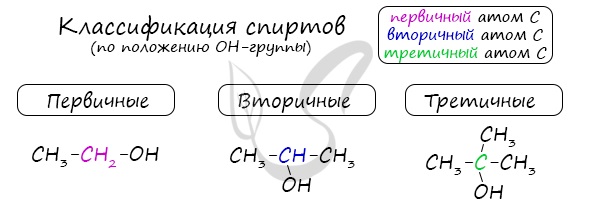
Одноатомные спирты также подразделяются в зависимости от положения OH-группы: первичные (OH-группа у первичного атома углерода), вторичные (OH-группа у вторичного атома углерода) и третичные (OH-группа у третичного атома углерода).
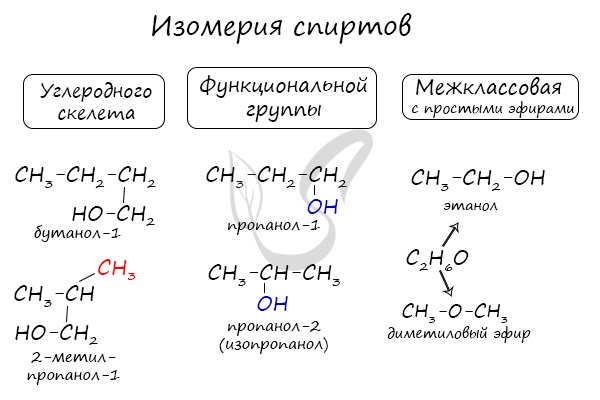
Номенклатура и изомерия спиртов
Названия спиртов формируются путем добавления суффикса "ол" к названию алкана с соответствующим числом атомов углерода: метанол, этанол, пропанол, бутанол, пентанол и т.д.
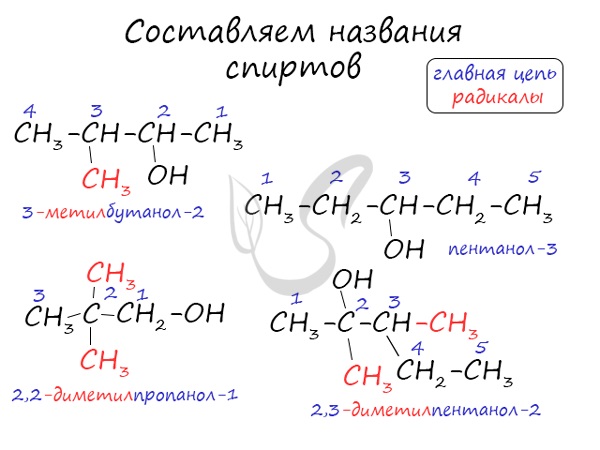
Для спиртов характерна изомерия углеродного скелета (начиная с бутанола), положения функциональной группы и межклассовая изомерия с простыми эфирами, которых мы также коснемся в данной статье.
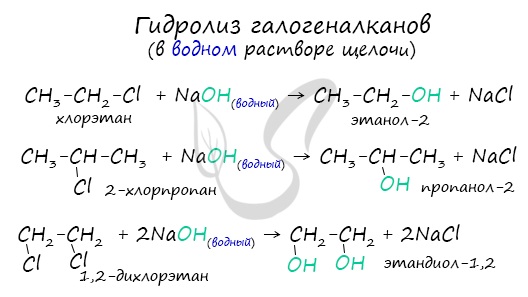
Получение спиртов
- Гидролиз галогеналканов водным раствором щелочи
Помните, что в реакциях галогеналканов со с ПИ ртовым раствором щелочи получаются Пи -связи (π-связи) - алкены, а в реакциях с водным раствором щелочи образуются спирты.
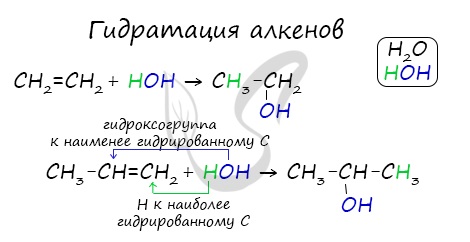
- Гидратация алкенов
Присоединения молекулы воды (HOH) протекает по правилу Марковникова. Атом водорода направляется к наиболее гидрированному атому углерода, а гидроксогруппа идет к соседнему, наименее гидрированному, атому углерода.
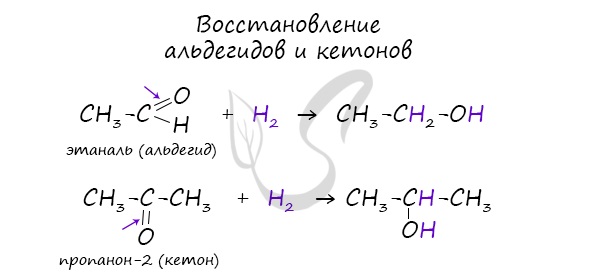
- Восстановление карбонильных соединений
В результате восстановления альдегидов и кетонов получаются соответственно первичные и вторичные спирты.
- Получение метанола из синтез-газа
Синтез газом в промышленности называют смесь угарного газа и водорода, которая используется для синтеза различных химических соединений, в том числе и метанола.
CO + 2H2 → (t,p,кат.) CH3-OH
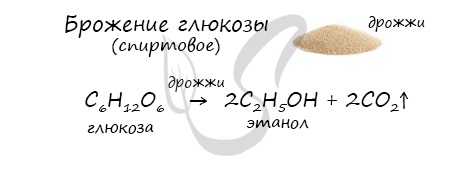
- Получение этанола брожением глюкозы
В ходе брожения глюкозы выделяется углекислый газ и образуется этанол.
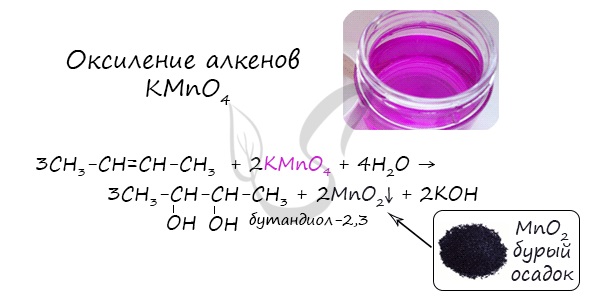
- Окисление алкенов KMnO4 в нейтральной (водной) среде
В результате такой реакции у атомов углерода, прилежащих к двойной связи, формируются гидроксогруппы - образуется двухатомный спирт (гликоль).
Химические свойства спиртов
Предельные спирты (не содержащие двойных и тройных связей) не вступают в реакции присоединения, это насыщенные кислородсодержащие соединения. У спиртов проявляются новые свойства, которых мы раньше не касались в органической химии - кислотные.
- Кислотные свойства
Щелочные металлы (Li, Na, K) способны вытеснять водород из спиртов с образованием солей: метилатов, этилатов, пропилатов и т.д.
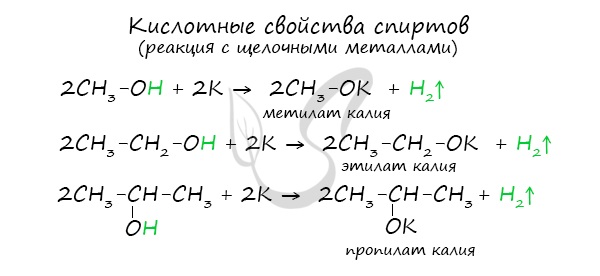
Необходимо особо заметить, что реакция с щелочами (NaOH, KOH, LiOH) для предельных одноатомных спиртов невозможна, так как образующиеся алкоголяты (соли спиртов) сразу же подвергаются гидролизу.
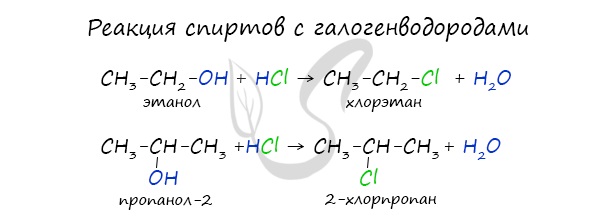
- Реакция с галогеноводородами
Реакция с галогеноводородами протекают как реакции обмена: атом галогена замещает гидроксогруппу, образуется молекула воды.
- Реакции с кислотами
В результате реакций спиртов с кислотами образуются различные эфиры.
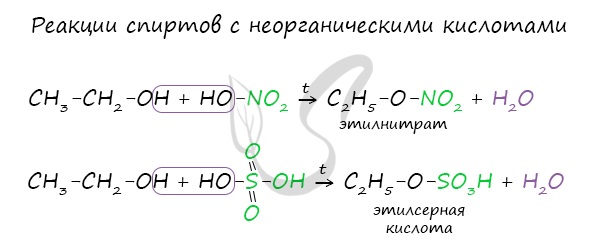
- Дегидратация спиртов
Дегидратация спиртов (отщепление воды) идет при повышенной температуре в присутствии серной кислоты (водоотнимающего) компонента.
Возможен межмолекулярный механизм дегидратации (при t < 140°С), в результате которого образуются простые эфиры. При более высокой температуре (t > 140°С) механизм дегидратации становится внутримолекулярный - образуются алкены.
Названия простых эфиров формируются проще простого - по названию радикалов, входящих в состав эфира. Например:
- Диметиловый эфир - CH3-O-CH3
- Метилэтиловый эфир - CH3-O-C2H5
- Диэтиловый эфир - C2H5-O-C2H5
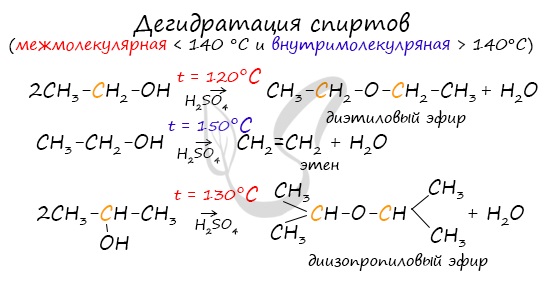
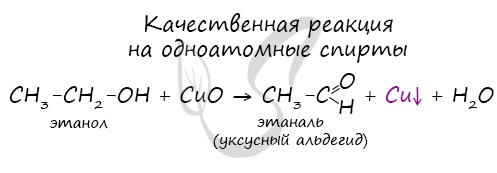
- Окисление спиртов
Качественной реакцией на спирты является взаимодействие с оксидом меди II. В ходе такой реакции раствор приобретает характерное фиолетовое окрашивание.
Замечу, что в обычных условиях третичные спирты окислению не подвергаются. Для них необходимы очень жесткие условия, при которых углеродный скелет подвергается деструкции.
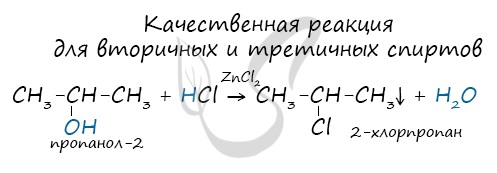
Вторичные и третичные спирты определяются другой качественной реакцией с хлоридом цинка II и соляной кислотой. В результате такой реакции выпадает маслянистый осадок.
Первичные спирты окисляются до альдегидов, а вторичные - до кетонов. Альдегиды могут быть окислены далее - до карбоновых кислот, в отличие от кетонов, которые являются "тупиковой ветвью развития" и могут только снова стать вторичными спиртами.

- Качественная реакция на многоатомные спирты
Такой реакцией является взаимодействие многоатомного спирта со свежеприготовленным гидроксидом меди II. В результате реакции раствор окрашивается в характерный синий цвет.
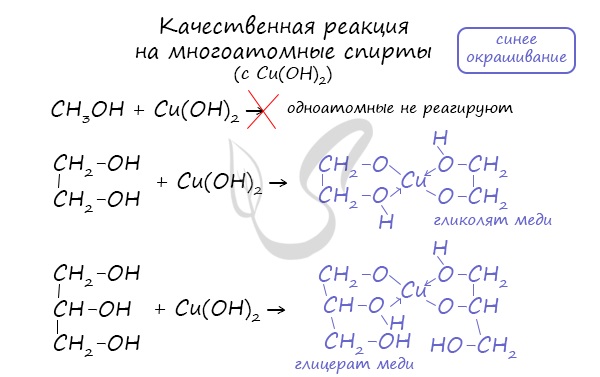
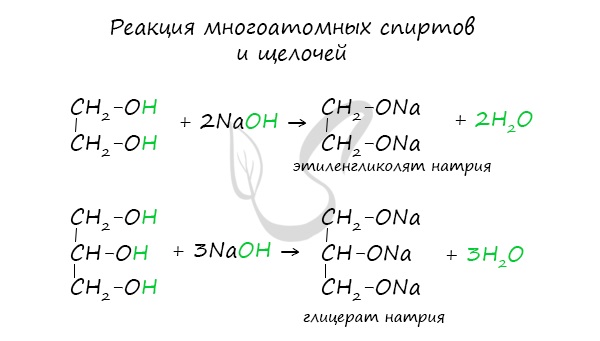
- Кислотные свойства многоатомных спиртов
Важным отличием многоатомных спиртов от одноатомных является их способность реагировать со щелочами (что невозможно для одноатомных спиртов). Это говорит об их более выраженных кислотных свойствах.
Пройдите тест для закрепления знаний
Блиц-опрос по теме Спирты
1. Межклассовыми изомерами предельных одноатомных спиртов являются
ФенолыАреныСложные эфирыПростые эфиры
2. Спирт можно получить
Реакцией основания с кислотойРеакцией галогеналкана со спиртовым раствором щелочиРеакцией щелочи с галогеналканом в водном раствореДегидрированием алканов
3. При внутримолекулярной дегидратации из спиртов образуются
АлкеныАлканыАреныЦиклоалканы
4. При нагревании спиртов до 140° преимущественно происходит образование
Сложных эфировПростых эфировКарбоновых кислотАлкенов
5. Качественная реакция на многоатомные спирты
Реакция с натриемРеакция с хлорэтаномСо свежеприготовленным гидроксидом меди IIРеакция серебряного зеркала
Фенолы
Фенолы - кислородсодержащие ароматические соединения, в молекулах которых содержится одна или несколько гидроксильных групп (OH), присоединенных к бензольному кольцу.
Номенклатура фенолов
Нумерацию атомов углерода в молекуле фенола начинают в такой последовательности, чтобы заместители получили наименьшие номера (идут кратчайшим путем). В основе названия принято сохранять тривиальное название "фенол".
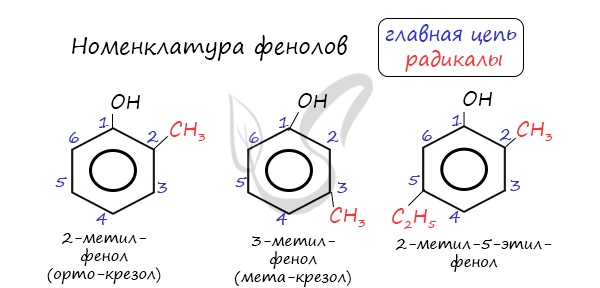
Напомню, что гидроксильная группа является ориентантом I порядка (орто-, пара-ориентант). Поэтому реакции галогенирования, нитрования протекают в орто- и пара-положениях.
Получение фенолов
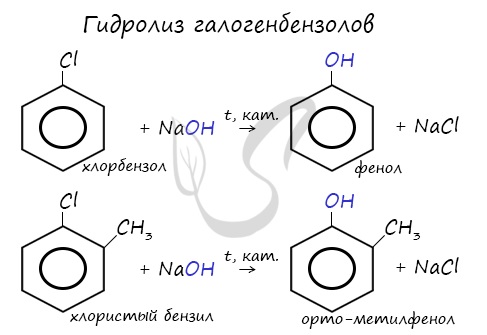
- Гидролиз галогенбензолов
При гидролизе галогенбензолов происходит обмен: гидроксогруппа встает на место атома галогена.
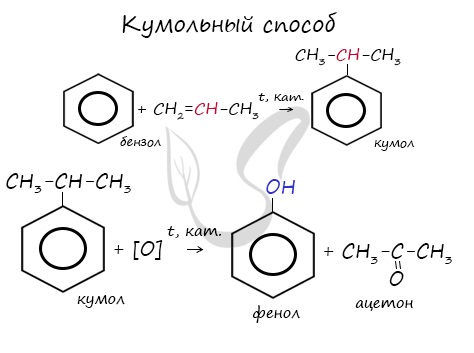
- Кумольный способ
Этим способом получают 95% всего производимого фенола. В ходе этой реакции кумол (изопропилбензол) подвергают окислению, в результате получается фенол и ацетон.