Электрохимические метода анализа основаны на использовании электрохимических процессов, происходящих в электролитической ячейке. Последняя представляет собой электрохимическую систему, состоящую из электродов, помещенных в растворы электролитов. В простейшем случае электролитическая ячейка может состоять из двух металлических электродов, опущенных в раствор электролита. Электролитическая ячейка, в зависимости от происходящих в ней процессов, может являться либо электрохимической ванной, либо гальваническим элементом.
Электрохимической ванной называется система, в которой за счет приложенного извне электрического тока происходят химические превращения веществ на электродах. Например, два платиновых электрода опущены в стеклянную емкость, содержащую 0,1М водный раствор соляной кислоты. К электродам ячейки подведен постоянный ток необходимого напряжения (рис.1). Поскольку соляная кислота в воде диссоциирует на ионы Н+ и Сl-, и к отрицательно заряженному электроду (катоду) будут двигаться ионы Н+, к положительно заряженному электроду (аноду) - ионы Cl-. Если приложенное извне напряжение постоянного тока обеспечивает достижение потенциалов разряда ионов Н+ и Сl-, то на электродах ячейки пойдут следующие электродные реакции:
- катод: 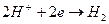 ;
;
- анод:  .
.

Рис.1. Электрохимическая ванна: А-амперметр; В-вольтметр
Очевидно, что вследствие этих процессов плотность электронного облака на аноде будет возрастать, а на катоде уменьшаться. Поэтому электроны от анода через металлические провода внешней цепи начнут перетекать на катод, где будут расходоваться на восстановление ионов водорода.
Таким образом, в данной электролитической ячейке, являющейся электрохимической ванной, прохождение электрического тога обеспечивается двумя видами электрической проводимости:
- металлической проводимостью проводников первого рода (платина, серебро, медь, алюминий и т.п.), в которых электрический ток представляет собой поток электронов, передвигающихся от отрицательного полюса к положительному;
- электролитической проводимостью проводников второго рода (раствора электролитов), когда электрический ток проходит через раствор электролита за счет движения находящихся в нем ионов.
Через границу раздела фаз «металл - раствор электролита» электрический ток проходит за счет электродных реакций на катоде и аноде.
Электрические параметры электролитической ячейки (сила тока, напряжение, сопротивление и т.п.) могут служить аналитическими сигналами при проведении анализов, если эти сигналы измерены с достаточной точностью. Поэтому электрохимические методы анализа основаны на использовании зависимости электрических параметров ячейки от концентрации, природы и структуры вещества, участвующего в электродной реакции или в электрохимическом процессе переноса электрических зарядов между электродами.
Электрохимические методы анализа используют либо для прямых измерений, основанных на зависимости «аналитический сигнал-состав», либо для определения конечной точки титрования.
Электрохимические методы анализа можно классифицировать следующим образом:
- методы, в которых отсутствует протекание электродных реакций, т.е. строение двойного электрического слоя 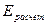 не принимается (например, кондуктометрия);
не принимается (например, кондуктометрия);
- методы, основанные на электродных реакциях в отсутствие внешнего тока (потенциометрия) или под током (вольтамперометрия, кулонометрия).
Электрохимические методы позволяют определять:
- концентрацию веществ в широком интервале (1-1×10-9 м/л);
- концентрацию веществ в мутных и окрашенных растворах;
- концентрацию смеси веществ (например, определение концентрации слабой и сильной кислоты в растворе).
Электрохимические методы анализа могут быть использованы для автоматического контроля и управления производственными процессами.
2.1. Потенциометрия.
Потенциометрический метод анализа основан на измерении потенциала электрода, погруженного в анализируемый раствор. Таким образом, аналитическим сигналом данного метода анализа является изменение электродного потенциала в процессе титрования (как будет показано ниже, практически за ходом анализа следят по изменению ЭДС, величина, которой определяется изменением потенциала индикаторного электрода).
2.1.1. Теоретические основы метода. Пластинку металлического цинка опустим в раствор сернокислого цинка (рис.2). Поскольку химический потенциал металлического цинка больше его химического, потенциала в растворе электролита, ионы цинка из металла переходят в раствор. Вследствие этого на поверхности металлического цинка скапливаются электроны, она заряжается отрицательно. В результате ионы цинка не диффундируют в глубину раствора, а скапливаются у металлической поверхности. В конечном итоге достигается динамическое равновесие - сколько ионов перешло в раствор, столько же вернулось из раствора в металл.
Таким образом, поверхность металла приобретает отрицательный заряд, а прилежащий к ней слой электролита - положительный. В результате образовывается двойной электрический слой, который представляет собой реальный физический конденсатор с плоскопараллельными обкладками. Из электротехники известно, что если обкладки плоскопараллельного конденсатора заряжены разноименно («+» и «-»), то между ними возникает скачок потенциала. Следовательно, на границе раздела фаз «металл-раствор» также возникает скачок потенциала, который называется, равновесны электродным потенциалом и обозначается буквой  . В только что разобранном случае мы имеем дело с равновесным потенциалом
. В только что разобранном случае мы имеем дело с равновесным потенциалом  .
.

Рис.2. Двойной электрический слой (случай цинка)
Аналогичные процессы происходят и с металлической медью, опущенной в раствор сернокислой меди. Разница состоит лишь в том, что поверхность металлической меди заряжена положительно, а прилегающий слой электролита - отрицательно (рис. 3). Это является следствием того, что химический потенциал меди в растворе больше химического потенциала металлической меди. В результате на последней адсорбируются ионы Сu2+, поверхность приобретает положительный заряд, и к ней притягиваются ионы SO42-.

Рис.3. Двойной электрический слой (случай меди)
В этом случае также образуется двойной электрический слой, представляющий собой реальный физический конденсатор с плоскопараллельными обкладками. Следовательно, на границе раздела фаз «металл-раствор» возникает скачок потенциала, который является равновесным электродным потенциалом 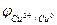 . Ясно, что
. Ясно, что  и
и  могут отличаться не только по величине, но и по знаку (обкладки реальных плоско-параллельных конденсаторов заряжены разноименно).
могут отличаться не только по величине, но и по знаку (обкладки реальных плоско-параллельных конденсаторов заряжены разноименно).
Познакомившись с возникновением электродных потенциалов, перейдем к гальваническим алиментам (рис.4). Соединим емкости с растворами CuSO4, и ZnSO4 электролитическим ключом 1, представляющим собой загнутую стеклянную трубку, заполненную хорошо проводящим электролитом, например, раствором КСl. Металлические электроды соединим проводами, присоединив к ним амперметр 3. Пока контакт 2 разомкнут, стрелка амперметра находится на нуле.

Рис.4. Схема гальванического элемента Якоби-Даниэля
При замыкании контакта амперметр покажет в не пи наличие тока. Это и естественно, т.к. мы получили электрическую цепь, в которой два электрода имеют разные потенциалы, а это, как известно, ведет к возникновению ЭДС. В результате мы получили гальванический элемент Якоби-Даниэля. Он состоит из двух полуэлементов, электролитического ключа и внешней цепи. Подобная система называется гальваническим элементом с переносом. Однако может быть случай, когда два разных электрода (например, Сu и Zn) опущены в один раствор. В этом случае электролитический ключ, естественно, отсутствует, и такая система называется гальваническим элементом без переноса.
Поскольку гальванический элемент есть система, обратная электрохимической ванне, катод в нем имеет положительный знак, а анод - отрицательный. На аноде происходит растворение цинка:
Zn0 – 2e Þ Zn2+
на катоде - осаждение меди:
Cu2+ + 2e Þ Cu0
Суммарная химическая реакция (иногда ее еще называют «токообразующая реакция») имеет вид:
Zn0 + Cu2+ Û Zn2+ + Cu0
Как и в электрохимической ванне, избыточные электроны, появившиеся на аноде в результате его растворения, через внесение в цепь переходят на катод, где расходуются на восстановление ионов Сu2+ (см. рис.4). Для простоты описания гальванические элементы часто записывает схематически. Например, элемент Якоби-Даниэля можно описать следующим образом:
Сu| +CuSO4, H2O || H2O, ZnSO4- | Zn
Гальванические элементы бывают химические и концентрационные. Химические гальванические элементы - это такие системы, в которых природа электродов и электролитов разная. Типичным примером является элемент Якоби-Даниэля. Концентрационные элементы - это такие системы, в которых электрода и электролиты одни и те же, но концентрация электролитов в полуэлементах различная.
Итак, в гальваническом элементе возникает ЭДС. В общем случае ЭДС выражается уравнением
 , (1)
, (1)
где
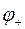 - потенциал электрода, имеющего положительный заряд;
- потенциал электрода, имеющего положительный заряд;
 - потенциал электрода, имеющего отрицательный заряд.
- потенциал электрода, имеющего отрицательный заряд.
Таким образом, для рассмотренного нами гальванического элемента Якоби-Даниэля:
 , (2)
, (2)
где  и
и  - равновесные потенциалы медного и цинкового электродов, опущенных в растворы их солей.
- равновесные потенциалы медного и цинкового электродов, опущенных в растворы их солей.
Равновесный потенциал электрода зависит от изменения активности ионов, которыми этот электрод обменивается с раствором электролита:
 , (3)
, (3)
где
 - равновесный потенциал электрода;
- равновесный потенциал электрода;
 - стандартный потенциал электрода;
- стандартный потенциал электрода;
R - универсальная газовая постоянная (8,314 Дж/м);
Т - температура (К);
n - Валентность иона;
F - Постоянная Фарадея (96496 кулонов);
Aокисл - активность ионов в окисленной форме;
авосст - активность ионов в восстановленной форме.
Уравнение (3) называется формулой или уравнением Нернста и дает зависимость величины равновесного потенциала от концентрации ионов в растворе электролита. В самом деле, активность электролита связана с его концентрацией уравнением:
 , (4)
, (4)
где
а - активность ионов электролита;
γ - коэффициент активности;
С - концентрация ионов электролита.
Следовательно, уравнение (3) можно записать в виде:
 , (5)
, (5)
где
γ1 - коэффициент активности окисленной формы ионов;
С1 - концентрация окисленной формы ионов;
γ2 - коэффициент активности восстановленной формы ионов;
С2 - концентрация восстановленной фермы ионов.
Выразив в уравнении (2) значения равновесных электродных потенциалов по формуле Нернста (5), получим:
 , (6)
, (6)
или окончательно:
 . (7)
. (7)
[ х Это потенциал электрода, опущенного в раствор электролита при 25°С, 1 атм и активности потенциалопределяющих ионов равной 1. Таким образом, для каждого металла значение ¥ 0 - величина постоянная.]
Из уравнения (7) следует, что с изменением в растворе концентрации ионов меди или цинка меняется величина ЭДС.
Основываясь на уравнениях (5) и (7), можно также объяснить возникновение ЭДС в концентрационном гальваническом элементе. Действительно, в концентрационном элементе электроды и электролиты одни и те же, например:
Cu |+ CuSO4, H2O || H2O, CuSO4- | Cu
C1 C2
Однако концентрации электролитов разные (С1>С2),
Следовательно, в соответствии с уравнением (5) потенциалы электродов будут не одинаковые. А раз имеется разность потенциалов, в электрической цепи возникает ЭДС. У рассматриваемого концентрационного элемента на катоде происходит восстановление ионов меди:
Cu2+ + 2e Þ Cu0
и их концентрация С1 уменьшается, на аноде происходит окисление меди:
Cu0 - 2e Þ Cu2+
и концентрация С2 увеличивается. Концентрационный гальванический элемент будет работать до тех пор, пока концентрации раствора сернокислой меди в обоих полуэлементах не сравняются. В этом случае электродные потенциалы у полуэлементов станут равными, и, стало быть, ЭДС равна нулю.
Кратко ознакомившись с электродными потенциалами и гальваническими элементами, перейдем собственно к потенциометрии.
В потенциометрии, в зависимости от обстоятельств, используют гальванические элементы с переносом и без переноса. При этом применяют два типа электродов; индикаторные электроды и. электроды сравнения.
Индикаторным электродом называется такой электрод, чей потенциал, в соответствии с уравнением Нернста (5), зависит от изменения концентрации ионов, которыми обменивается электрод с раствором.
Электродом сравнения называется такой электрод, чей потенциал не зависит от природы и концентрации растворов. Другими словами, потенциал электрода сравнения остается одним и тем жe в разных растворах различной концентрации.
Индикаторные электроды. Индикаторные электроды бывают двух типов - металлические и мембранные.
Металлическими индикаторными электродами называются такие электроды, у которых на границе раздела фаз «металл-раствор электролита» протекают реакции с участием электронов.
В качестве индикаторных металлических электродов используют платину, серебро, медь, кадмий, свинец, т.е. такие металлы, которые способны давать обратимые полуреакции. Потенциалы этих металлов воспроизводимы и полностью отражают активности их ионов в растворе. Однако ряд металлов, например, алюминий, железо, никель, титан, хром не могут быть использованы в качестве индикаторных электродов, т.к. для них характерны невоспроизводимый потенциалы. Это объясняется образованием на поверхности таких электродов окисных слоев, а также напряжениями и деформациями металла электродов.
Мембранными, или ионоселективными, называются такие электроды, у которых на границе раздела фаз «электрод - раствор электролита» протекают ионообменные реакции.
Ионоселективные электроды делятся на четыре группы:
1) стеклянные электроды;
2) электроды с твердыми мембранами;
3) электроды с жидкой мембраной;
4) электроды с газовыми мембранами.
Среди ионоселективных электродов наибольшее распространение получил стеклянный электрод, предназначенный для определения рН (рис.5). Он представляет собой следующее устройство. К концу толстостенной стеклянной трубка припаян тонкостенный шарик 4, изготовленный из специального pH-чувствительного стекла. Вовнутрь шарика заливается O,1 M раствор НСl, насыщенный AgCl (3). В раствор погружают серебряную проволоку, покрытую хлоридом серебра, которая и является токоотводом 2. К концу токоотвода припаивается провод, который подводится к прибору. Это устройство закрывается защитной трубкой 1.
Мембраной стеклянного электрода является тонкостенный шарик 4 (см. рис.5), изготовленный из специального стекла. Перед началом работы стеклянный электрод вымачивается в 0,1 М НСl в течение 8 часов (иначе он не будет селективен по отношению к ионам водорода).
[ х Селективность следует понимать как избирательность. Таким образом, ионоселективный электрод обменивается с раствором только одним ионом, например, только ионом Н+ или ионом Сl, хотя в электролите могут присутствовать другие ионы.].
При этом ионы водорода из раствора обмениваются на ионы натрия из стеклянной мембраны, и в системе устанавливается некоторое равновесие. Таким образом, потенциал стеклянного электрода обусловлен обменом ионов щелочных металлов, находящихся в стекле, с ионами водорода из раствора, т.е. не связан с переходом электронов. Естественно, что изменение рН раствора сдвинет равновесие, установившееся на стекле между ионами водорода и ионами щелочного металла - потенциал стеклянного электрода изменится. Обычно для изготовления рН - чувствительного стекла используются составы, содержащие 22% Na2О, 6% СаО, 72% SiO2. Стекло такого состава может быть применено до рН=9. При более высоких значениях рH мембрана становится чувствительной по отношению к ионам щелочных металлов.

Рис.5. Стеклянный электрод
Поэтому помимо стеклянных электродов, предназначенных для измерения рН, имеются специальные стеклянные электроды для определения активности ионов Na+ и К+.
Электроды с твердыми мембранами также могут быть применены для определения концентрации ионов в растворе электролитов.
Так, в лабораторной практике широко применяют электроды с гомогенными мембранами, которые чувствительны к ионам F-, Cl- и Сu2+. В качестве твердых мембран могут использоваться такие соединения, как LaF3, АgCl-Ag2S, Cu2-xS.В этих соединениях в процессе переноса заряда участвует только один из ионов кристаллической решетка, имеющий, как правило, наименьший ионный радиус и наименьший заряд. В этом случае униполярная проводимость обеспечивает высокую избирательность электрода. Ионоселективный электрод с твердой мембраной (рис.6) состоит из мембраны 5, корпуса электрода 4, внутреннего раствора (0,1 М растворы определяемого иона и хлорида калия) 3, внутреннего полуэлемента Ag/AgCl2, места припая провода 1.
Применение электродов с жидкими мембранами основано на том, что на границе раздела фаз между анализируемым раствором и не смешивающейся с ним жидкостью возникает потенциал, обусловленный ионным обманом между двумя этими жидкостями. Таким образом, электрод с жидкой мембраной отличается от стеклянного электрода или электрода с твердой мембраной тем, что анализируемый раствор отделен от раствора с известной и постоянной активностью тонким слоем не смешивающейся с водой органической жидкости. В качестве электроактивных соединений в электродах с жидкой мембраной могут быть использованы хелаты металлов, ионные ассоциаты органических катионов и анионов, комплексы с нейтральными переносчиками.

Рис.6. Ионоселективный электрод с твердой мембраной
Большое распространение получили пленочные пластифицированные электроды. Чувствительный элемент таких электродов состоит из электродноактивного компонента, поливинилхлорида и растворителя (пластификатора). Таким образом, конструкция таких электродов аналогична конструкции электродов с твердой мембраной, только вместо последней в корпус электрода вклеена пластифицированная мембрана, а внутрь электрода залит раствор сравнения. В качестве токоотвода используют хлорсеребряный полуэлемент.
Ионоселективные электроды находят все более широкое применение. Например, они широко используется при анализе и исследованиях природных и сточных вод, т.к. позволяют следить за поведением индивидуального иона, находящегося в сложной смеси, какими обычно бывают природные и сточные воды.
Электроды сравнения. Для проведения потенциометрического анализа, заключающегося в измерении ЭДС гальванического элемента, 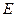 обходим полуэлемент, потенциал которого был бы известен, постоянен и совершенно не зависел от состава исследуемого раствора. Полуэлемент, отвечающий этим требованиям, называется электродом сравнения.
обходим полуэлемент, потенциал которого был бы известен, постоянен и совершенно не зависел от состава исследуемого раствора. Полуэлемент, отвечающий этим требованиям, называется электродом сравнения.
Отметим, что электрод сравнения сохраняет практически постоянным и воспроизводимым свой потенциал даже при прохождении достаточно малых токов в растворах различных электролитов. Постоянство потенциала электрода сравнения достигается поддержанием в контактирующем внутреннем растворе постоянной концентрации веществ, на которые реагирует электрод.
В потенциометрии наиболее часто применяются хлорсеребряный и каломельные электроды сравнения.
Хлорсеребряный электрод является системой (рис.7), состоящей из стеклянного сосуда 1, внутри которого помещена серебряная проволока 2, покрытая хлоридом серебра 3 и опущенная в раствор хлорида калия 4, с исследуемым раствором такой электрод контактирует через асбестовую ткань 5.

Рис.7. Хлорсеребряный электрод сравнения
Таким образом, хлорсеребряный электрод можно представить в виде:
|| AgClTB, KCl {M} | Ag
где М - молярная концентрация КСl Электродная реакция хлорсеребряного электрода описывается уравнением AgClTB + e Û Ag0 + Cl-.
Потенциал хлорсеребряного электрода по отношению к стандартному водородному электроду равен +0,1988 при 25º С.
В заключение необходимо отметить, что различают электроды первого рода и второго рода.
Примером электродов первого рода, обратимых относительно катиона, может служить любой металл в растворе его соли. К ним же относится и газовый водородный электрод (Pt)H2, H+, поскольку на платиновом электроде при насыщении его водородом устанавливается равновесие:
2Н+ ↔ Н2 (адсорбированный)↔Н2 (газ) следовательно:
 . (8)
. (8)
Электроды первого рода могут быть обратимы и относительно аниона, например, газовый хлорный электрод (Pt) Clz, Сl-, поскольку при насыщении платины хлором устанавливается равновесие:
Cl2(газ) Cl2 (адсорбированный) 2Cl-. Здесь окисленная форма - газообразный хлор, восстановленная - ион Cl-. Потенциал такого электрода равен:
 . (9)
. (9)
Электродом второго рода называется металлический электрод, погруженный в раствор труднорастворимого соединения этого металла (соль, окись) и хорошо растворимого электролита с одноименным анионом. Примерами могут служить каломельный и хлорсеребряный электроды сравнения. На каломельном электроде устанавливается равновесие:
2Hg + 2Cl- - 2e Û Hg2+ +2Cl- Û Hg2Cl2
Поскольку окисленной формой является Нg2Cl2, то
 . (10)
. (10)
Рассматривая этот электрод как обратимый относительно катиона, можно представить равновесие на электроде в виде 2Hg - 2e Û Hg2+
откуда
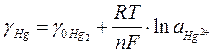 . (11)
. (11)
2.1.2. Потенциометрические измерения. Для проведения потенциометрических измерений необходимо иметь гальванический элемент, в простейшем случае состоящий из индикаторного электрода и электрода сравнения. Изменение ЭДС такого элемента фиксируется специальными приборами, о которых будет сказано ниже.
Суть потенциометрических измерений остается одна - с изменением концентрации в растворе потенциалопределяющих ионов меняется потенциал индикаторного электрода вследствие чего меняется ЭДC, изменение последней фиксируется измерительным прибором.

Рис.11. Потенциометрические кривые
В потенциометрическом анализе существуют прямая потенциометрия и потенциометрическое титрование.
2.1.2.1. Прямая потенциометрия. Методика таких измерений довольно проста потенциал индикаторного электрода в растворе, концентрацию которого нужно определить, сравнивается с потенциалом этого же электрода, погруженного в стандартный раствор того же вещества.
Для практических измерений этим методом cтроят калибровочный график (рис.12). Для этого измеряют потенциал индикаторного электрода в стандартных растворах с определенной активностью или концентрацией ионов. Затем определяют потенциал индикаторного электрода в растворе вещества, концентрация которого неизвестна. Откладывая полученное значение  по оси ординат, определяют концентрацию вещества в растворе
по оси ординат, определяют концентрацию вещества в растворе 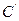 . Метод прямой потенциометрии сочетает в себе такие достоинства, как простота, экспрессность, возможность работы с малыми объектами растворов, доступность автоматического контроля производственных процессов.
. Метод прямой потенциометрии сочетает в себе такие достоинства, как простота, экспрессность, возможность работы с малыми объектами растворов, доступность автоматического контроля производственных процессов.
Основной трудностью использования этого метода является выбор индикаторного электрода. Он должен быть устойчивым к действию раствора, протекающая реакция должна быть обратима и идти только в одном направлении. Сочетать все эти условия для многих металлов оказывается очень сложным.

Рис.12. Калибровочный график
Однако появление ионоселективных электродов значительно расширило возможности метода, причем число методик непрерывно возрастает, В настоящее время, помимо определения ионов водорода, прямой потенциометрией определяют ионы кальция, магния, натрия, серебра, золота, ртути и т.д.
2.1.2.2. Потенциометрическое титрование. Аналитическим сигналом в этом методе также служит изменение потенциала индикаторного электрода в процессе титрования. За ходом анализа следят по показаниям прибора и результаты представляют в виде кривой титрования в координатах « , В - объем титранта», или «рН- объем титранта». Обычно вместо кривой потенциометрического титрования «φ, В - объем титранта» строят кривую в координатах «
, В - объем титранта», или «рН- объем титранта». Обычно вместо кривой потенциометрического титрования «φ, В - объем титранта» строят кривую в координатах «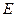 , В - объем титранта», где
, В - объем титранта», где 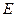 - ЭДС гальванического элемента, величина которой определяется потенциалом индикаторного электрода (см, рис.11). По кривой потенциометрического титрования определяется эквивалентная точка 3 (см. рис.11), по которой рассчитывается концентрация определяемого вещества:
- ЭДС гальванического элемента, величина которой определяется потенциалом индикаторного электрода (см, рис.11). По кривой потенциометрического титрования определяется эквивалентная точка 3 (см. рис.11), по которой рассчитывается концентрация определяемого вещества:
 , (14)
, (14)
где
N1 - определяемая концентрация вещества в растворе, г-экв/л;
V1 - объем пробы исследуемого раствора, мл;
N2 - концентрация титранта;
V2 - эквивалентный объем титранта.
При определении концентрации вещества в растворе методом потенциометрического титрования необходимо иметь в виду следующее:
- чувствительность метода определяется правильным выбором индикаторного электрода;
- величина скачка потенциала вблизи эквивалентной точки тем больше, чем выше концентрация исследуемого раствора;
- величина скачка потенциала зависит также от константы ионизации слабой кислоты илислабого основания, и тем больше, чем больше соответствующая контакта;
- в случае титрования смесей двух или более веществ сначала оттитровывается вещество, имеющее более высокую степень ионизации, окислительно-восстановительный потенциал, величину ПР или устойчивость образующегося комплексного соединения;
- в начале титрования титрант можно приливать большими порциями, а вблизи эквивалентной точки - одинаковыми порциями не более 0,2 мл.
Различают следующие способы потенциометрического титрования: осаждение, перевод в малодиссоциированные комплексы, окислительно-восстановительное титрование, кислотно-основное титрование (иногда его называют «метод нейтрализации»).
Разберем эти способы потенциометрического титрования.
Осаждение. Сущность способа заключается в следующем: кизучаемому раствору добавляется такой титрант, который дает с ионами, концентрацию которых нужно определить, малорастворимое соединение, выпадающее в осадок (нужно подобрать такой индикаторный электрод, который обменивается с электролитом осаждаемыми ионами). Тогда в процессе титрования концентрация потенциалопределяющих ионов будет уменьшаться (т.к. они будут переходить в осадок), что в соответствии с уравнением Нернста (5) поведет к изменению потенциала индикаторного электрода.
Рассмотрим пример определения концентрации ионов серебра в водном растворе AgNO3 (рис,13). Индикаторным электродом будет служить серебряная проволока 2, а электродом сравнения - каломельный полуэлемент 3; в качестве титранта возьмем раствор хлористоводородной кислоты. При добавлении титранта к исследуемому раствору AgNO3 (при перемешивании на магнитной мешалке 4) ионы Ag+ будут переходить в осадок (ПPAgCl=1,7·10-10):
Ag+ + Cl- Þ AgClß
ЭДC элемента, изображенного на рис.13.
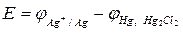 , (15)
, (15)
 - величина постоянная, следовательно, ЭДC определяется значениями
- величина постоянная, следовательно, ЭДC определяется значениями  , которые зависят от изменения концентрации (точнее, активности) ионов Ag+в растворе.
, которые зависят от изменения концентрации (точнее, активности) ионов Ag+в растворе.

Рис.13. Гальванический элемент для определения концентрации ионов
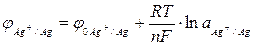 , (16)
, (16)
 . (17)
. (17)
В процессе титрования раствора AgNO3 раствором HCl концентрация ионов Ag+в исследуемом растворе будет снижаться, что повлечет за собой уменьшение ЭДС. Строят график зависимости изменения ЭДС от объема добавленного титранта (осадителя). Получаем характерную кривую потенциометрического титрования (рис.14).

Рис.14. Кривая потенциометрического титрования нитрата серебра хлоридом по методу осаждения
Как видно из рисунка, в точке эквивалентности происходит резкий скачок ЭДС, определяемый изменением потенциала индикаторного электрода. Конечную точку титрования 1 (или точку эквивалентности) определяют как среднюю точку участка, соответствующего вертикальному ходу кривой. Очевидно, что точность данного способа тем выше, чем больше величина скачка потенциала. При этом следует иметь в виду, что скачок потенциала и. следовательно, ЭДС тем больше, чем выше концентрация титруемого раствора и титранта, и чем меньше ПР образующегося осадка. Рассмотрим кривые потенциометрического титрования ионов серебра (рис,15,а) иодидом 1 (ПРAgI=10-16) и хлоридом 2 (ПРAgCl=10-10). Поскольку ПРAgI<ПPAgCl, величина скачка потенциала для случая иодида больше, чем для хлорида. Причем чем выше концентрация нитрата серебра, тем больше скачек потенциала (рис.15,б):

Рис.15. Кривые потенциометрического титрования раствора:
нитрат серебра хлоридом и иодидом (а),
1NHCl при различии концентрации раствора нитрата серебра (б)
По данному способу возможно титрование смеси ионов. При этом необходимо помнить, что дифференциальное титрование этих ионов возможно только в том случае, если ПР образующихся малорастворимых соединений отличаются друг от друга не менее чем на три порядка. Если при потенциометрическом титровании способом осаждения могут встречаться следующие ошибки: явления адсорбции, изменение растворимости осадка в присутствии посторонних электролитов и т.п.
Переведение в малодиссоциированные комплексы. Сущность данного способа заключается в следующем: при добавлении титранта к исследуемому pacтвоpу количество ионов, концентрацию которых нужно определить, уменьшается, т.к. они связываются в малодиссоциированный комплекс. В связи с этим будет изменяться потенциал индикаторного электрода и, следовательно, ЭДС гальванического элемента.
Рассмотрим пример титрования цианид-ионов раствором нитрата серебра. Индикаторным электродом гальванического элемента служит серебряная проволока, электродом сравнения - каломельный полуэлемент. Титрантом является раствор нитрата серебра.
Ионы серебра с ионами цианида образуют комплекс [Ag(CN)2], причем процесс комплексообразования обратим:
Ag+ + 2CN- Û [Ag(CN-)2]-
Константа нестойкости этого комплекса равна:
 . (18)
. (18)
Воспользовавшись этой формулой, можно рассчитать концентрацию ионов серебра, а по формуле Нернста (5) - потенциал серебряного электрода. В процессе титрования потенциал последнего и, следовательно, ЭДС гальванического элемента будут возрастать (рис.16,а), и в точке эквивалентности 1 обнаружится резкий скачок потенциала. При дальнейшем титровании вслед за скачком потенциала, соответствующим

Рис.16. Кривые потенциомётрического титрований по способу комплексообразования: цианид-ионов раствором нитрата серебра (а); ионов кальция раствором ЭДТА (б) при различных рН окончанию процесса комплексообразования, возникает почти горизонтальный участок.
Это объясняется тем, что дальнейшее добавление нитрата серебра ведет к образованию в растворе малодиссоциированного осадка:
[Ag(CN-)2]- + Ag Þ 2AgCNß
Таким образом, концентрация ионов серебра в растворе, от которой зависит величина потенциала индикаторного электрода, определяется растворимостью образующегося осадка. До тех пор, пока весь комплекс не превратится в осадок, потенциал системы остается практически постоянным.
Скачок потенциала в точке эквивалентности тем больше, чем меньше константа диссоциации комплекса и чем больше начальная концентрация титруемого раствора.
При использовании большинства органических комплексообразующих лигандов процесс титрования сильно зависит от рН раствора, так как при различных рН образуются комплексы с различной константой нестойкости и различного состава. На рис.16,б приведены кривые потенциометрического титрования ионов Са2+ раствором динатриевой соли этилендиаминтетра-уксусной кислоты (ЭДТА) при различных рН. Очевидно, что при рН=8 точка эквивалентности будет определена менее правильно, нежели при рН=9 или рН=12.
Окислительное титрирование. При протекании окислительно-восстановительной реакции в растворе имеются ионы в окисленной и восстановленной форме. Если подобрать индикаторный электрод, обратимый относительно этих ионов, то по мере течения реакции концентрация ионов, находящихся в окисленной и восстановленной форме, будет изменяться. Тогда, в соответствии с формулой Нернста, будет меняться величина электродного потенциала и, следовательно, ЭДС гальванического элемента.
В качестве примера окислительно-восстановительного