Функции не охарактеризованных генов можно изучить путём их инактивации и последующего наблюдения эффекта инактивации при различных условиях роста клетки. Для проведения инактивации генов в B. subtilis создан набор векторов для осуществления инсерционного мутагенеза в хромосоме бактерии (Vagner et al.,1998). Данные векторы, обозначенные как pMUTIN, построены на основе репликона ColE1 (рис.8), поэтому они не способны реплицироваться в конечном хозяине (B. subtilis), что необходимо для проведения инсерционного мутагенеза. Они содержат ген-репортёр lacZ для измерения активности промотора исследуемого гена. Также в векторах присутствует индуцибельный промотор P spac, необходимый для контроля экспрессии генов, находящихся в одном опероне с исследуемым геном и расположенным дистальнее от него. Данный промотор необходим из-за возможного полярного эффекта вставки. Промотор P spac был модифицирован для лучшего контроля его активности. Онрепрессируется репрессором LacI (кодируется геном lacI, присутствующим в векторе) и, следовательно, может быть индуцирован IPTG, инактивирующим LacI.
| pMUTIN | терминатор | оператор | MCS |
| t 0 | O1 | есть | |
| t 1 t 2 t 0 | O1 | нет | |
| t 0 | oid | есть | |
| t 1 t 2 t 0 | oid | нет |

Рис. 8. Структура векторов pMUTIN. Общие черты векторов pMUTIN показаны на рисунке. Различия между векторами pMUTIN указаны в таблице справа от рисунка. Белые боксы являются генами экспрессируемыми в B. subtilis, чёрные боксы - гены экспрессируемые в E. coli. ori - область репликации ColE1. ApR и EmR, гены резистентности к ампициллину и эритромицину соответственно. lacZ, модифицированный ген b-галактозидазы - ген lacZ c RBS гена spoVG B. subtilis и стоп кодонами в трёх возможных рамках считывания; P spac, индуцируемый промотор, содержащий последовательности распознавания РНК-полимеразой фага SPO1 и один из lac операторов - O1 или оператор oid; lacI, ген репрессора LacI модифицированный для конститутивной экспрессии в B. subtilis; Ter - терминаторы: lt0 присутствует во всех векторах; t1t2 (сильные терминаторы из rrnB) в pMUTIN2 и pMUTIN4. Op - оператор LacI между промоторными последовательностями P spac: O1 оператор присутствует в pMUTIN1 и pMUTIN2; оператор oid присутствует в pMUTIN3 и pMUTIN4. Различия между векторами pMUTIN указаны в таблице справа от рисунка.
Исследуемый ген можно инактивировать в результате одиночного кроссинговера между вставкой, осуществленной в вектор pMUTIN и геном, локализованным на бактериальной хромосоме (рис.9). Для этого внутренний фрагмент изучаемого гена амплифицируется с помощью ПЦР, клонируется в полилинкер pMUTIN, и получившаяся конструкцию используется для трансформации клеток B. subtilis. В результате интеграции ген прерывается и происходит транскрипционное слияние между его промотором и lacZ геном-репортёром. Если данный ген является частью оперона, то остальные дистально расположенные гены оказываются под контролем промотора P spac. При этом терминатор l  , расположенный перед P spac предотвращает транскрибирование этих генов с других проксимально расположенных промоторов. Данные манипуляции приводят к образованию сразу двух типов мутантов: нулевых мутантов (по orf2) в результате разрыва гена и условных мутантов (по orf3) зависимых от IPTG.
, расположенный перед P spac предотвращает транскрибирование этих генов с других проксимально расположенных промоторов. Данные манипуляции приводят к образованию сразу двух типов мутантов: нулевых мутантов (по orf2) в результате разрыва гена и условных мутантов (по orf3) зависимых от IPTG.
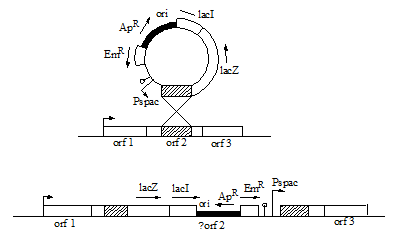
Рис. 9. Интеграция pMUTIN в исследуемый ген. Гены оперона orf1-orf3 показаны в виде белых боксов. Заштрихованный ген соответствует внутреннему сегменту исследуемого гена. Вектор интегрируется в orf2 путём одиночного кроссинговера. Стрелки обозначают направление транскрипции, изломанные стрелки обозначают промотор оперона и P spac.
Созданы векторы для проведения инсерционного мутагенеза в штаммах вида Bacillus cereus, основанного на встраивании мобильного элемента IS231A в случайные сайты хромосомы бактерии (Leonard et al.,1998). Созданные векторы pGIC055 и pGIC057 представляют собой версии одной плазмиды и построены на основе термочувствительного репликона pHT1030. В своём составе они имеют:
1) mini-IS231A, включающий в себя селективный маркер (устойчивость к канамицину [pGIC057] или спектиномицину [pGIC055]) и полилинкеры между инвертированными повторами;
2) ген транспозазы IS 231 A (TnA), находящийся под контролем сильного промотора P deg;
3) дополнительный маркер- ген устойчивости к эритромицину.
Транспозицию mini-IS231A из плазмид pGIC055 или pGIC057 в хромосому осуществляли при температуре 28°С. Плазмиды затем элиминировали путём повышения температуры культивирования до 46°С. Выяснилось, что в хромосоме Bacillus cereus имеется один сайт сильно предпочтительный для транспозиции mini-IS231A (левый инвертированный повтор транспозона Tn4430). Если в данный сайт уже осуществлена вставка, последующие вставки осуществляются в случайные сайты.
Путём повторной вставки были получены ряд ауксотрофных мутантов. С использованием рестрикционного анализа данные мутации (также как и предпочтительный для транспозиции сайт) были локализованы на карте хромосомы B. cereus.

Рис. 10. Структура векторов pGIC055 и pGIC057. ori - репликативный регион pHT1030; TnpA - ген транспозазы; MCS 2 - полилинкеры; P deg - сильный промотор; инвертированные повторы обозначены черными треугольниками; детерминанты устойчивости: EmR - к эритромицину, mini-IS - к спектиномицину (pGIC055) или канамицину (pGIC057).
Из мутанта ауксотрофного по аденину была вырезана вставка mini-IS231A вместе с прилегающими участками путём рестрикции Eco RI (в mini-IS сайт для данной рестриктазы отсутствует). Путём секвенирования и сравнения с последовательностями из баз данных было выявлено, что сайт, в который была осуществлена вставка, имеет высокую степень гомологии с генами pur оперона B. subtilis, что может указывать на то, что вставка mini-IS231A произошла в один из генов синтеза пуринов. Данные результаты показывают, что рестрикционный анализ вместе с секвенированием позволяют создавать объединённые физические и генетические карты бактериальной хромосомы B. cereus.
Данную систему можно использовать для проведения инсерционного мутагенеза также в других грамположительных бактериях, способных расти при температуре выше 45°.
В геноме B. cereus (как и в большинстве других про- и эукариотических геномов) отсутствует сайт рестрикции I- Sce I. Данный сайт присутствует в полилинкере mini-IS. Поэтому последовательное введение двух mini-IS, несущих два разных маркера резистентности, в хромосому приводит к получению фрагмента ограниченного двумя сайтами I- Sce I. Таким образом, путём рестрикции I- Sce I можно получать фрагменты, подходящие для секвенирования. Данный метод позволяет избежать ряда трудностей встречающихся при использовании традиционных методик клонирования.