Окислитель–частица, которая в ОВР отдаёт электрон. Восстановитель – частица, которая принимает электрон. В ходе ОВР происходит перераспределение между реагирующих частиц, электронов и атомов, группировокатомов; ОВР очень чувствительна по характеру среде в которой она протекает.Основой ОВР – метод электронного баланса. Суть в том, что число электронов отданных восстановителю, должны быть равно числу электронов принятых окислителем (закон сохранения масс). Типы ОВР: 1) Межмолекулярная – такие реакции, в которых окислитель и восстановитель находятся в разных молекулах. 2) Внутримолекулярная – в которых окислитель и восстановитель находятся в пределах одной и той же молекулы- реакция термического разложения солей. 3) Самоокисление и самовосстановление (диспропорционирование) – такие ОВР, где и окислителем, и восстановителем является одна и та же частица. Из концентрированных кислот водород не выделяется!!!! Окислительно-восстановительный потенциал –мера способности химического вещества присоединять электроны (восстанавливаться). Окислительно восстановительный потенциал выражают в милливольтах (мВ).




Во время окислительных или восстановительных реакций изменяется электрический потенциал окисляемого или восстанавливаемого вещества: одно вещество, отдавая свои электроны и заряжаясь положительно, окисляется, другое, приобретая электроны и заряжаясь отрицательно - восстанавливается. Разность электрических потенциалов между ними и есть окислительно-восстановительный потенциал (ОВП).
 Окислительно-восстановительный потенциал является мерой химической активности элементов или их соединений в обратимых химических процессах, связанных с изменением заряда ионов в растворах. В переводе на более понятный неспециалисту язык это означает, что ОВП, называемый также редокс-потенциал (от английского RedOx - Reduction/Oxidation), характеризует степень активности электронов в окислительно-восстановительных реакциях, т.е. реакциях, связанных с присоединением или передачей электронов. При измерениях (в электрохимии) величина этой разности обозначается как Eh и выражается в милливольтах. Чем выше концентрация компонентов, способных к окислению, к концентрации компонентов, могущих восстанавливаться, тем выше показатель редокс-потенциала.
Окислительно-восстановительный потенциал является мерой химической активности элементов или их соединений в обратимых химических процессах, связанных с изменением заряда ионов в растворах. В переводе на более понятный неспециалисту язык это означает, что ОВП, называемый также редокс-потенциал (от английского RedOx - Reduction/Oxidation), характеризует степень активности электронов в окислительно-восстановительных реакциях, т.е. реакциях, связанных с присоединением или передачей электронов. При измерениях (в электрохимии) величина этой разности обозначается как Eh и выражается в милливольтах. Чем выше концентрация компонентов, способных к окислению, к концентрации компонентов, могущих восстанавливаться, тем выше показатель редокс-потенциала.
Любую ОВР можно использовать для получения электрического тока. А при помощи электрического тока можно осуществить химическую реакцию. Получения электрического тока, для того чтобы его получить надо разделить в пространстве процессы окисления и восстановления и пустить заряженные частицы по внешним цепям. Электродный потенциал
CuSO4 + Zn = Cu + ZnSO4
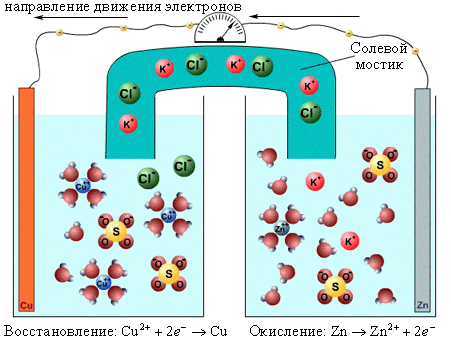 Если же процессы окисления и восстановления пространственно разделить, то любую окислительно-восстановительную реакцию можно использовать для получения электрической энергии. Такие устройства называют химическими источниками тока (ХИТ). Простейший ХИТ – гальваническая ячейка (рис. 7.1) – представляет собой сосуды, в которых два электрода, помещенные в раствор соответствующих электролитов, соединены солевым мостиком (проводником второго рода *), представляющим собой стеклянную трубку, заполненную раствором такого электролита, катионы и анионы которого характеризуются одинаковой подвижностью. При замыкании внешней цепи проводником первого рода начинается окислительно-восстановительная реакция, о чем свидетельствует возникновение электродвижущей силы (ЭДС).В нашем случае, если погрузить пластину металла меди в раствор содержащий ионы этого металла, то между металлом и раствором возникнет разность потенциалов (электродный потенциал(между электродом и электролитом)). Причина – контакт двух разных составляющих одной и той же частицы, атома Cu. Поскольку природа различна, то E1не равен E2, поэтому если соединить между собой медь и цинк, точки с разными потенциалами (первого и второго рода), то в системе возникнет электрический ток. Проводники второго рода – ионные проводники. ЭДС–электродвижущая сила, определяется как разница потенциалов окислителя и восстановителя. ЭДС = E0ОК - E0ВОС Изменение осуществляется относительно водородного электрода, для которого стандартный показатель E0298 Табличная величина. При использовании надо иметь в виду, чем больше положительное значение электродного потенциала системы, тем более выражается окислительные свойства и наоборот.Если положительное значение, то выступает в качестве окислителя и протекает в прямом направлении, а если о трицательное, то в качестве восстановителя и протекает в обратном направление.
Если же процессы окисления и восстановления пространственно разделить, то любую окислительно-восстановительную реакцию можно использовать для получения электрической энергии. Такие устройства называют химическими источниками тока (ХИТ). Простейший ХИТ – гальваническая ячейка (рис. 7.1) – представляет собой сосуды, в которых два электрода, помещенные в раствор соответствующих электролитов, соединены солевым мостиком (проводником второго рода *), представляющим собой стеклянную трубку, заполненную раствором такого электролита, катионы и анионы которого характеризуются одинаковой подвижностью. При замыкании внешней цепи проводником первого рода начинается окислительно-восстановительная реакция, о чем свидетельствует возникновение электродвижущей силы (ЭДС).В нашем случае, если погрузить пластину металла меди в раствор содержащий ионы этого металла, то между металлом и раствором возникнет разность потенциалов (электродный потенциал(между электродом и электролитом)). Причина – контакт двух разных составляющих одной и той же частицы, атома Cu. Поскольку природа различна, то E1не равен E2, поэтому если соединить между собой медь и цинк, точки с разными потенциалами (первого и второго рода), то в системе возникнет электрический ток. Проводники второго рода – ионные проводники. ЭДС–электродвижущая сила, определяется как разница потенциалов окислителя и восстановителя. ЭДС = E0ОК - E0ВОС Изменение осуществляется относительно водородного электрода, для которого стандартный показатель E0298 Табличная величина. При использовании надо иметь в виду, чем больше положительное значение электродного потенциала системы, тем более выражается окислительные свойства и наоборот.Если положительное значение, то выступает в качестве окислителя и протекает в прямом направлении, а если о трицательное, то в качестве восстановителя и протекает в обратном направление.
Электролиз - это окислительно-восстановительный процесс, который происходит на электродах во время прохождения электрического тока через расплав или раствор.Нужен источник тока, два электрода и, конечно, электролит. Электролит - это раствор, который проводит электрический ток.Различают электролиз растворов и электролиз расплавов. Оба эти процесса существенно отливаются друг от друга. Отличие - в наличии растворителя. При электролизе растворов кроме ионов самого вещества в процессе участвуют ионы растворителя. При электролизе расплавов - только ионы самого вещества. Электрод, заряженный положительно - анод. Электрод, заряженный отрицательно - катод. При электролизе происходит окисление анода (он растворяется) и восстановление катода. Электролиз растворов -результат:
При пропускании тока через раствор на положительном электроде - аноде - восстанавливаются отрицательно заряженные ионыОтрицательно заряженные ионы ещё называют анионами. На отрицательном электроде - катоде - восстанавливаются положительные ионы. Положительные ионы называют катионами. При электролизе расплавов в процессе участвуют только ионы вещества, которое подвергается электролизу. Например, если подвергнуть электролизу расплав поваренной соли (NaCl), то на аноде будет выделяться тот же газ - хлор, а вот на катоде вместо водорода будет восстанавливаться чистый металл - натрий (Na).Коррозией называется процесс разрушения металлов при их химическом, электрохимическом или биохимическом взаимодействии с окружающей средой. Процесс коррозии сопровождается окислением металла и превращением его в различные химические соединения (окислы, гидроокиси, карбонаты и т. п.).
Черные металлы — углеродистая сталь, Чугуны — наиболее интенсивно подвергаются коррозии, тогда как многие цветные металлы и легированные стали весьма устойчивы в атмосферных условиях и агрессивных средах. Виды: 1) Химическая коррозия - самопроизвольное разрушение металлических материалов вследствие их взаимодействия с коррозионной средой, при котором окисление металла и восстановление окислителя - пространственно неразделенные процессы.Процесс химической коррозии можно описать реакцией вида:4Fe + 3O2 → 2Fe2O3Химическая коррозия наблюдается при помещении металлических материалов в атмосферу раскаленных газов или в жидкость,не являющуюся электролитом (нефть, бензин и т.д.). Наиболее распространенный вид химической коррозии - газовая коррозия. 2) Разрушение металла под воздействием возникающих в коррозионной среде гальванических элементов называют электрохимической коррозией. При соприкосновении двух металлов с различными окислительно-восстановительными потенциалами и погружении их в раствор электролита, например, дождевой воды с растворенным углекислым газом CO2, образуется гальванический элемент, так называемый коррозионный элемент. Он представляет собой не что иное, как замкнутую гальваническую ячейку.
************************************************************************************* Химия S и P элементов.
Вещества состоящие из атома одного и того же элемента – простые степень окисления = 0. Элементы и простое вещество близки, но не тождественны. Проявления существования разных элементов в виде простого вещества, отличаются друг от друга составом, структурой и различными свойствами. Явление существования вещества в нескольких элементов – аллотропия.Соединения s- и р-элементов проявляют общие закономерности в свойствах, что объясняется прежде всего сходством электронного строения их атомов, а именно, все электроны внешнего слоя являются валентными и принимают участие в образовании химических связей. Поэтому максимальная степень окисления этих элементов в соединениях равна числу электронов во внешнем слое и соответственно равна номеру группы, в которой находится данный элемент. Основной противоположностью в химии простых веществ являются – металлы и не металлы! Важнейшие свойства металлов – восстановители, доноры, основная химическая природа. Неметаллы – проявляют окислительные свойства, акцепторные свойства, кислотная химическая природа. Чёткая граница между противоположностями нет и быть не может, появляются в том что существуют такие вещества, сочетающие в себе все эти противоположные качества – амфотерность. Реакции, помогающие разобраться в химической природе неизвестного простого вещества, это реакции простых веществ между собой, отношение простых веществ к воде, разбавление кислотой, щелочью, кислот-окислителями (серная), азотная кислота.
Химические Свойства: 1) Реакция простых веществ между собой: Реагирование противоположностей (металлов и неметаллов), эти реакции как правило экзотермичны, при этом элемент с большой электро-отрицательностью – окислитель, а с меньшей – восстановитель. Mg+S  MgS 2) Отношение простых веществ к воде: а) Окисление простого вещества водой, реагируют наиболее активные щелочные и щелочно-земельные металлы. Na+H2O
MgS 2) Отношение простых веществ к воде: а) Окисление простого вещества водой, реагируют наиболее активные щелочные и щелочно-земельные металлы. Na+H2O  NaOH+H2б) Неметаллы с водой, наиболее активно реагируют по механизму самоокислению и самовосстановлению (галогены, кроме F) Cl2+H2O
NaOH+H2б) Неметаллы с водой, наиболее активно реагируют по механизму самоокислению и самовосстановлению (галогены, кроме F) Cl2+H2O  HCl+HClOв) Окисление воды простым веществом: F2+H2O
HCl+HClOв) Окисление воды простым веществом: F2+H2O  HF+O2 3) Отношение простых веществ к раствору кислот. Главный окислитель в разбавленных кислотах, кроме азота является H+, прототипы – все металлы левее водорода(имеющие отрицательное значение электродного потенциала. Продукт – соль и водород! Mg+HCl
HF+O2 3) Отношение простых веществ к раствору кислот. Главный окислитель в разбавленных кислотах, кроме азота является H+, прототипы – все металлы левее водорода(имеющие отрицательное значение электродного потенциала. Продукт – соль и водород! Mg+HCl  MgCl2+ H2 4) Отношение простых веществ к раствору щелочей, поскольку щелочи с выраженной основной химической природой, то реагируют с ними вещества с кислотной химической природой – неметаллы. Активные (галогены, кроме F,P,S) – самоокисление и восстановление. Cl2+KOH
MgCl2+ H2 4) Отношение простых веществ к раствору щелочей, поскольку щелочи с выраженной основной химической природой, то реагируют с ними вещества с кислотной химической природой – неметаллы. Активные (галогены, кроме F,P,S) – самоокисление и восстановление. Cl2+KOH  KCl+KClO+H2O 5) Особый случай реакции с щелочным амфотерном металлом +AlAl+NaOH+H2O
KCl+KClO+H2O 5) Особый случай реакции с щелочным амфотерном металлом +AlAl+NaOH+H2O  Na2[Al2OH]+H2 6) Отношение вещества к кислотным окислительными металлами – Образуется либо соль, либо оксид, тогда при реакции с неметаллами – кислота неметаллов. Mg+HNO3
Na2[Al2OH]+H2 6) Отношение вещества к кислотным окислительными металлами – Образуется либо соль, либо оксид, тогда при реакции с неметаллами – кислота неметаллов. Mg+HNO3  Mg(NO3)2+NO+H2O
Mg(NO3)2+NO+H2O
 Оксиды – бинарные соединения, состоящие из 2х элементов, один из которых кислород, характерное окончание – ид. Кислород – один из наиболее электроотрицательных элементов. Кислород – активный окислитель и в состояние окислять подавляющее большинство других металлов, образуя многочисленные оксиды, в которых степень окисления -2. Кислород, как наиболее электроотрицательный – окислитель и переходит в низшую степень окисления -2, а его партнёр – восстановитель переходит в высшую степень совпадающий с номером группы, реакция протекает с большим выделение энергии!
Оксиды – бинарные соединения, состоящие из 2х элементов, один из которых кислород, характерное окончание – ид. Кислород – один из наиболее электроотрицательных элементов. Кислород – активный окислитель и в состояние окислять подавляющее большинство других металлов, образуя многочисленные оксиды, в которых степень окисления -2. Кислород, как наиболее электроотрицательный – окислитель и переходит в низшую степень окисления -2, а его партнёр – восстановитель переходит в высшую степень совпадающий с номером группы, реакция протекает с большим выделение энергии!
В щелочно земельных оксидах реализуется – ионная связь (большая разница в электро отрицательности). Тогда как в типичных не металлах реализуется ковалентная связь, так как разница электр. малая. Ионно-ковалентные оксиды имеют амфотерную природу.
Гидрооксиды–Бинарные соединения Sи Pэлементов, содержащие гидрооксидную группу OH. 
Известны гидроксиды почти всех химических элементов; некоторые из них встречаются в природе в виде минералов. Гидроксиды щелочных металлов называются щелочами.
Галоге́ны — элементы главной подгруппы VII группы.Все галогены проявляют высокую окислительную активность, которая уменьшается при переходе от фтора к иоду.Реагируют почти со всеми простыми веществами, кроме некоторых неметаллов. Все галогены — энергичные окислители, поэтому встречаются в природе только в виде соединений. С увеличением порядкового номера химическая активность галогенов уменьшается, химическая активность галогенид-ионов F−, Cl−, Br−, I− уменьшается.К галогенам относятся фтор F, хлорCl, бромBr, иод I, астатAt. Фтори́ды — соединения фтора с другими элементами: 1) металлов - Фториды щелочных, щелочноземельных металлов и переходных металлов в низших степенях окисления имеют ионную структуру и являются солямифтороводородной (плавиковой) кислотыHF. Для таких ионных фторидов характерны высокие значения энергии кристаллической решетки и, соответственно, высокие температуры плавления и кипения. 2) Неметаллов - жидкости или газы. Получение фторидов может быть выполнено путем взаимодействия фтора с элементами, воздействием фтороводорода на металлы и рядом других способов. Получение: Фториды большинства элементов можно получать взаимодействием простых веществ:
H2 + F2 → 2HF
Fe + F2 → FeF2
Высшие фториды обычно получают из низших действием фтора:
ClF3 + F2 → ClF5
Хлори́ды — бинарное соединение одним из которых является хлор, активный не метал, его электроотрицательность =3 ед. Хлор в состояние окислять большинство других металлов и неметаллов, образую хлориды, в которых степень окисления -1.MnO2+HCl  MnCl2+Cl2+HOH – получение хлора. В промышленности хлор получают путём электролиза расплава NaCl
MnCl2+Cl2+HOH – получение хлора. В промышленности хлор получают путём электролиза расплава NaCl
 Все реакции сильно экзотермичны, с выделением большого количества тепла, света.
Все реакции сильно экзотермичны, с выделением большого количества тепла, света.
Доказать это можно с помощью гидролиза и комплексообразования.Хлориды прекрасно растворяются в воде, кроме ионных хлоридов.
Галогениды водорода – бинарные соединения водорода и галогена. Оксокислоты тоже самое что Кетокислоты — это карбоновые кислоты, содержащие помимо карбоксильной группы -COOH ещё и карбонильную группу =CO. Примерами кетокислот являются пировиноградная и ацетоуксусная кислоты. Кетокислоты обладают химическими свойствами как кетонов, так и карбоновых кислот. Пировиноградная кислота — химическое соединение с формулой СН3СОСООН, органическая кетокислота.
************************************************************************************* Химия d элементов
Самый главный Fe!!! dэлементы - само пассирующие металлы, то есть покрыты слоями оксидной плёнкой (защита металла). Гидрофильность (способность вещества (материала) смачиваться водой) и гидрофобность (способность вещества (материала) не смачиваться водой)! Для dэлементов валентным слоем является внешний и пред внешний слой. Радиус атома слева направо уменьшается, но очень плавно (эффект d-сжатие). Эта близость радиусов создаёт условие для образования сплавов.В под группах при переходе от 1 элемента ко второму увеличивается квантовый слой. Энергия ионизации в периодах слева направо увеличивается (но более плавно), поскольку энергия увеличивается, а восстановительные свойства уменьшаются. В группах сверху вниз – ионизация увеличивается, а общая химическая активность уменьшается. Самый активный – медь, менее активны – золото, серебро. Сверху вниз возрастает у металлов неметаллические свойства. Низкие степени окисления характерны для металлов, а высокие – неметаллы. Химические свойства: Подходит весь набор инструментов, который разобран на примере sи pэлементов! Сюда можно приспособить реакцию комплекса образования, так как dэлементы - комплексных соединений. Особенности dэлементы - они активно растворяются в особых смесях реагентов, которые 1- окислительные сильный, 2 – хорош для образования комплекса. Царская вода: HF+HNO3