У преобладающего числа больных причиной заболевания является аденома гипофиза, поэтому обязательными инструментальными методами исследования считаются:
— рентгенография черепа в боковой проекции, позволяющая выявить увеличение размеров турецкого седла (в норме саггитальный размер составляет 12–15 мм, вертикальный — 8–9 мм), его двухконтурность, а также ряд косвенных рентгенографических признаков опухоли гипофиза;
— определение толщины мягких тканей стопы, величина которой выраженно коррелирует с уровнем СТГ (норма у мужчин — до 21 мм, у женщин — до 20 мм);
— КТ головного мозга и области гипофиза с обязательным контрастированием либо МРТ с контрастированием или без такового. МРТ является оптимальным методом визуализации аденомы гипофиза, особенно в сочетании с кистозным компонентом, «пустым» турецким седлом, а также в случае микроаденомы, позволяет точно определить степень вовлечения в процесс латероселлярных структур.
Основным в лабораторной диагностике является определение оценки секреции СТГ. Как правило, у больных акромегалией уровень СТГ натощак повышен, однако в 30–53 % случаев это повышение незначительно, при этом почти у 17 % больных уровень СТГ находится в пределах нормы. Оптимальным является частое (каждые 10–20 мин в течение 24 ч) определение уровня СТГ в крови, что позволяет четко дифференцировать здоровых лиц от больных акромегалией (в норме в 75 % проб содержание СТГ определяется на уровне нижней границы чувствительности метода, в 25 % проб допускаются высокие значения уровня СТГ: секреторные пики в полночь, ранние утренние часы). Однако нередко это практически трудновыполнимо.
В настоящее время надежными альтернативными методами диагностики являются:
|
|
— определение СТГ каждые 30 мин в течение 2 ч в сыворотке крови на фоне ОГТТ;
— однократное определение в сыворотке крови уровня ИФР-1 (соматомедина С).
Помимо этого, все пациенты подвергаются осмотру окулиста с целью оценки состояния глазного дна, области перекреста зрительных нервов, проведения периметрии на цвета и белый цвет.
Диагноз акромегалии подтверждается, если:
— базальный уровень СТГ превышает 0,4 нг/мл;
— минимальный уровень СТГ на фоне ОПТ более 1 нг/мл;
— повышен уровень ИФР-1 по отношению к данному полу и возрасту.
Дополнительные методы исследования включают:
— определение в крови уровня пролактина, ТТГ, свТ4, свТ3, АКТГ, свободного кортизола в суточной моче, ЛГ, ФСГ, эстрадиола, тестостерона;
— УЗИ щитовидной железы и органов малого таза;
— рентгенографию органов грудной клетки;
— ЭКГ, ЭхоКГ;
— исследование гликемического профиля, биохимический анализ крови.
В случае подозрения на эктопированную продукцию СТГ (особенно при отсутствии МРТ-признаков аденомы гипофиза) дополнительно необходимо проведение МРТ либо КТ грудной и брюшной полости. В лабораторной диагностике проводится определение содержания СТГ в крови, оттекающей из нижних кавернозных синусов.
ЛЕЧЕНИЕ
Как показывает богатый мировой опыт ведения больных акромегалией, все пациенты с верифицированным диагнозом, даже при мягком проявлении заболевания, за исключением очень редких случаев, когда имеются сопутствующие заболевания, вызывающие тяжелое состояние больного с неблагоприятным жизненным прогнозом, должны подвергаться лечению, и весьма активно.
|
|
Главные цели лечения акромегалии — устранение клинических симптомов заболевания, нормализация секреции СТГ и ИРФ-1, ликвидация источника избыточной продукции СТГ.
В настоящее время по-прежнему основными методами лечения являются хирургический (в большинстве случаев транссфеноидальная и очень редко — транскраниальная аденомэктомия), медикаментозный и лучевой.
Методы лечения акромегалии:
1. Хирургический (транскраниальная и транссфеноидальная аденомэктомия).
2. Лучевой (дистанционная гамма-терапия, протонотерапия, гамма-нож).
3. Медикаментозный (аналоги соматостатина, агонисты дофамина, антагонисты рецепторов гормона роста).
Основными факторами, определяющими метод лечения, являются: состояние зрения, размер и характер роста аденомы, уровень гормона роста, возраст больного, наличие сопутствующей патологии. Иногда врач вынужден избирать тот или иной вид лечения, учитывая желание больного.
Основные факторы, определяющие выбор метода лечения:
1. Состояние зрения.
2. Размеры и характер роста аденомы.
3. Уровень гормона роста.
4. Возраст больного.
5. Наличие тяжелых сопутствующих соматических нарушений.
6. Желание больного.
Эффективность лечения оценивается по определенным строгим критериям, установленным в мае 2000 года на основании консенсуса 68 ведущих нейроэндокринологов и нейрохирургов мира (табл. 2).
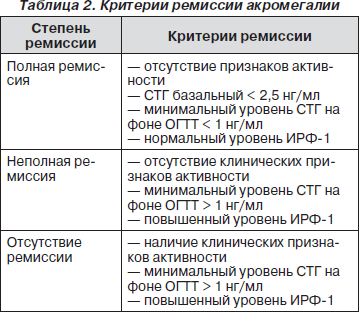
В настоящее время для оценки эффективности длительной терапии аналогами соматостатина дополнительно введено понятие «безопасного» уровня СТГ. Величина данного показателя получена в результате эпидемиологического мультицентрового ретроспективного исследования, проведенного на когорте из 1362 пациентов с акромегалией. В данном исследовании было показано, что если уровень СТГ после терапии был менее 2,5 нг/мл, общий уровень смертности не отличался от такового в общей популяции.
|
|
По-прежнему аденомэктомия является первичным методом лечения акромегалии, особенно в случаях, когда имеются признаки хиазмального синдрома, указывающего на сдавление опухолью гипофиза зрительных нервов. Степень восстановления зрения зависит от длительности предшествующей компрессии зрительных нервов и степени выраженности атрофии дисков.
Способ оперативного вмешательства определяется размерами аденомы и особенностями ее распространения.
Главным преимуществом оперативного вмешательства является быстрота наступления эффекта. В случае успешной (радикальной) операции уже в раннем послеоперационном периоде отмечается нормализация ответа СТГ на введение глюкозы (снижение менее 1 нг/мл), а также нормализация уровня ИРФ-1 через несколько недель.
Результаты оперативного вмешательства значительно варьируют и определяются многими факторами. В частности, одним из главных является размер и характер распространения аденомы. Так, наличие у пациента опухоли эндоселлярной локализации позволяет достичь ремиссии в 78–88 % случаев, при этом в случае экстраселлярных аденом, особенно гигантских, этот шанс практически сводится к нулю (табл. 3).

Отсутствие эффекта от оперативного вмешательства может быть также обусловлено инвазией в твердую мозговую оболочку СТГ-продуцирующих аденоматозных клеток, частота которой достигает 43 %, с возникновением истинного рецидива. Повторная операция нужна лишь в том случае, если она будет реальным шансом полного удаления аденомы.
Значительно влияет на исход оперативного вмешательства степень технического нейрохирургического оснащения, в частности использование эндоскопического контроля, нейронавигации; интраоперционный гормональный анализ и МРТ-контроль, а также опыт, квалификация нейрохирурга.
Условия успешной операции:
1. Размеры аденомы:
— микроаденома;
— макроаденома без экстраселлярного распространения.
2. Квалификация нейрохирурга — опыт не менее 200 операций с применением эндоскопического контроля, нейронавигации.
3. Отсутствие морфологических признаков «агрессии» опухоли (атипия клеток, множество митозов).
4. Отсутствие признаков инвазии (инфильтрация или перфорация диафрагмы турецкого седла, твердой мозговой оболочки, кливуса, кавернозных синусов).
В случае проведения операции квалифицированным нейрохирургом послеоперационные осложнения возникают менее чем в 2 % случаев. К ним относятся: зрительные нарушения, менингит, смертельный исход. Такие осложнения, как назальная ликворея, несахарный диабет, гипопитуитаризм, имеют место не более чем у 5 % больных. Если оперативное вмешательство произведено хирургом недостаточной квалификации, процент осложнений возрастает в 3–4 раза. С учетом вышеизложенного, все больные в послеоперационном периоде нуждаются в дополнительном обследовании с целью исключения гипопитуитаризма и при необходимости в адекватной и своевременной его коррекции, а также контрольном осмотре невропатологом, окулистом и отоларингологом, что является важным условием дальнейшей успешной реабилитации.
Уже почти 100 лет лучевая терапия используется в качестве метода лечения заболеваний гипофиза. Впервые А. Beclere в Париже, а Gramagna в Венеции в 1909 году применили данный вид лечения при акромегалии. Самые распространенные виды лучевой терапии — это гамма-терапия и протонотерапия. Традиционная дистанционная гамма-терапия проводится статическим либо ротационным методом. Используются несколько полей облучения: переднее, косое и два латеральных с целью максимальной концентрации дозы в области гипофиза и минимальной в окружающих тканях. Обычная доза облучения — 45–50 Гр в виде 25 фракционных доз. Ежедневная доза — 1,8 Гр 5 дней в неделю в течение 5 недель. Протонотерапия проводится многопольно-конвергентным методом с 15–25 полей в левой височной области способом «напролет» в дозе 50–80 Гр, как правило, в один сеанс.
Ранее широко используемые, данные виды лучевой терапии ввиду их существенных недостатков, с одной стороны, и совершенствования хирургической техники и видов медикаментозной терапии — с другой в настоящее время занимают третье место по значимости в лечении акромегалии. Главные их недостатки — отдаленность во времени производимого ими эффекта и осложнения.
Так, в случае гамма-терапии ингибирующий эффект в отношении секреции СТГ и ИРФ-1 возникает не ранее чем через 2 года от момента проведения облучения. В частности, «безопасный» уровень СТГ (менее 2,5 нг/мл) может быть получен у 36 % больных через 2 года от момента проведения облучения, у 44 % — через 5 лет и у 59 % пациентов — через 10 лет. В отношении нормализации уровня ИРФ-1 были получены следующие результаты: через 3 года — у 27 % больных, через 7 лет — у 53 % и через 10 лет — у 56 % лиц. По другим данным, полученным при анализе результатов гамма-терапии у 560 пациентов со сроками наблюдения от 5 до 15 лет, нормализация уровня ИРФ-1 была достигнута лишь у 199 (36 %) человек. При этом в исследованиях с длительностью периода наблюдения менее 7 лет эффективность составила 29 % (61 человек из 210), с длительностью катамнеза более 10 лет данный показатель возрастает до 39 % (138 человек из 350). Однако с увеличением времени от момента проведения лучевой терапии уменьшается количество пациентов, подвергшихся мониторингу, и количество больных с длительностью наблюдения 15–20 лет составляет не более 10 % от общего количества, ограничивая тем самым возможности для анализа. Более того, пациенты без ремиссии заболевания умирают преждевременно, при этом для длительного наблюдения сохраняются лишь хорошо контролируемые по гормональным критериям пациенты, что, в свою очередь, создает искаженное, ложное оптимистическое мнение об эффективности лучевой терапии. В случае протонотерапии начало супрессивного эффекта отмечается через 6–8 месяцев от момента облучения, в сроки от 3 до 8 лет у 46 % пациентов, значительное снижение уровня СТГ с полной его нормализацией у 39 % лиц.
Гипопитуитаризм — наиболее частое позднее осложнение лучевой терапии. Предполагается, что это является следствием поражения гипоталамуса. Все исследователи указывают на появление вновь обнаруженных случаев гипопитуитаризма у значительного количества больных. Частота данного осложнения зависит от величины фракционной дозы (более 2 Гр), а также предшествующего хирургического вмешательства. Степень гипопитуитаризма положительно коррелирует с длительностью постлучевого периода: через 10 лет у 50–60 % пациентов возникают новые проявления гипопитуитаризма, требующие применения заместительной гормональной терапии. В исследовании, проведенном в условиях ЭНЦ РАМН (Россия, г. Москва), частота вновь выявленного гипопитуитаризма после гамма-терапии составляла: гипотиреоз — 15 %, надпочечниковая недостаточность — 11 %, гипогонадизм — 11 %.
Помимо вышеуказанных осложнений с меньшей частотой возникает поражение сосудов головного мозга, что в 2–4 раза увеличивает риск инсульта и значительно повышает показатель смертности по сравнению как с общей популяцией, так и с пациентами, не получившими данный вид лечения. Причем не выявлено зависимости данного показателя от уровней СТГ и ИРФ-1, размера опухоли, ее распространения за пределы турецкого седла или наличия гипопитуитаризма. В 1–2 % случаев возможно развитие индуцированных злокачественных опухолей мозга, а также височной эпилепсии, поражения зрительных нервов, появление синдрома «пустого» турецкого седла. Есть предположения, что лучевая терапия может приводить к нейропсихологическим изменениям, нарушению когнитивных функций ЦНС: снижению памяти, депрессии и т.д. Однако отсутствует достаточное количество исследований с применением специальных психометрических тестов у идеально контролируемых пациентов, находящихся на заместительной гормональной терапии, включая гормон роста.
В связи с вышеизложенным показания к проведению данных видов лечения весьма ограничены. Гамма-терапия как первичный метод лечения применяется только при невозможности проведения аденомэктомии ввиду отсутствия специализированной нейрохирургической службы либо категорическом отказе больного. Как дополнительный метод — при агрессивных опухолях гипофиза с инвазией в окружающие структуры, включая кавернозные синусы и даже височные доли, в случае неполного удаления аденомы, особенно в сочетании с неблагоприятной гистологической картиной с целью подавления дальнейшей клеточной пролиферации и гиперпродукции СТГ. Протонотерапия применяется как первичный метод лечения при аденоме гипофиза до 1,5 см в диаметре у лиц до 55 лет с относительно невысокой активностью (уровень СТГ не более 20 нг/мл).
Лучевая терапия показана также пациентам, резистентным к терапии аналогами соматостатина либо когда есть серьезные противопоказания к проведению данных видов лечения.
Противопоказаниями для проведения лучевой терапии являются: 1) близкое расположение аденомы к перекресту зрительных нервов, особенно при наличии дефектов полей зрения, т.к. после проведения лучевой терапии возникает отек, способный усугублять имеющиеся нарушения зрения. При наличии такого расположения аденомы перед планируемым облучением идеальным является проведение хирургического лечения (аденомэктомии) с целью удаления супраселлярного компонента опухоли; 2) наличие «пустого» турецкого седла.
Ввиду отсроченного эффекта от лучевой терапии после облучения все больные нуждаются в назначении медикаментозной терапии на длительный период.
В последние годы нашел применение новый метод лучевой терапии — стереотактическая радиохирургия (техника линейного ускорения и гамма-нож). Ее главное отличие от дистанционной гамма-терапии — возможность направить однократно очень большую дозу узким фокусирующим пучком на четко ограниченную зону (участок), что значительно уменьшает число осложнений и повышает эффективность данного вида лучевой терапии. Так, по данным ряда исследователей, ремиссия заболевания может быть достигнута у 54 % лиц через 6 лет после облучения. При этом частота развития гипопитуитаризма не превышает 7 %. Однако, как показал анализ отдаленных результатов данного вида облучения у 270 больных в сроки наблюдения от 6 месяцев до 10 лет, нормализация уровня ИРФ-1 была достигнута лишь у 90 (33 %) пациентов. Сравнительный анализ сходных когорт по длительности катамнеза (от 2 до 10 лет) указывает на практическую идентичность результата: 33 % (77 из 232 человек) в группе больных, получивших в качестве метода лечения стереотактическую радиохирургию, и 29 % (99 из 341) в группе, получившей гамма-терапию. Требуется дальнейшее накопление опыта для разработки четких показаний к проведению данного вида лучевой терапии.
Особенностью состояния после проведения лучевой терапии является развитие постлучевой гиперпролактинемии, частота которой в случае гамма-терапии в два раза выше, чем после проведения протонотерапии (соответственно у 52 и 23 % больных). Назначение небольших доз агонистов дофамина приводит к нормализации содержания пролактина.
В настоящее время в качестве медикаментозной терапии при акромегалии применяются три класса препаратов: агонисты дофамина, длительно действующие аналоги соматостатина и антагонисты рецепторов гормона роста.
Агонисты дофамина применяются в лечении больных акромегалией с 1972 года благодаря способности связываться с дофаминовыми рецепторами 2-го типа на уровне гипофиза и вызывать подавление секреции СТГ у части больных акромегалией. Точный механизм действия остается неясным. Как показал 30-летний клинический опыт, самый древний агонист дофамина — бромкриптин — способен вызывать нормализацию уровня СТГ менее чем у 20 % пациентов и менее чем у 10 % больных нормализацию уровня ИРФ-1. Увеличение дозы препарата выше 20 нг/мл не вызывает усиления его действия. Кроме того, лишь у единичных больных бромкриптин вызывает незначительное уменьшение размера опухоли гипофиза. В настоящее время практически не применяется в мировой практике лечения акромегалии, особенно в качестве монотерапии.
Селективный Д2-дофаминовый агонист квинаголид (норпролак) по сравнению с бромкриптином обладает одновременно более выраженным эффектом в отношении супрессии СТГ, а также меньшими побочными эффектами благодаря отсутствию стимуляции Д1-допаминовых рецепторов. Препарат вызывает нормализацию уровня СТГ и ИРФ-1 не более чем у 40 % больных. Дозы препарата — 0,3 мг в день (0,15 мг 2 раза в день), возможно увеличение дозы до 0,6 мг в день.
Созданный в последние годы новый дофаминовый агонист каберголин (достинекс) обладает более длительным периодом действия (до 72 часов) и значительно меньшим количеством побочных эффектов, чем бромкриптин и квинаголид. В дозе от 1 до 3,5 мг (в среднем — 1,75 мг) в неделю либо 0,5 мг ежедневно терапия каберголином вызывает снижение уровня ИРФ-1 у 47–67 % больных, а его нормализацию — в 28–50 % случаев. Максимальный эффект отмечен в случае смешанных аденом гипофиза (СТГ и пролактин-секретирующих). Ингибирующий эффект каберголина зависит также от степени функциональной активности аденомы, в частности исходного уровня ИРФ-1. Исследования показали, что оптимальный эффект отмечен при исходном уровне ИРФ-1 не более 750 нг/мл. В отличие от бромкриптина терапия каберголином вызывает различной степени уменьшение размера аденомы гипофиза в 16–20 % случаев, а при наличии смешанной аденомы — до 50 % исходного объема опухоли.
Таким образом, показанием к назначению терапии агонистами дофамина является наличие у больного смешанной (СТГ-пролактин-секретирующей) аденомы гипофиза с умеренной функциональной активностью. Препарат можно рекомендовать пациентам, не чувствительным к аналогам соматостатина либо отказавшимся от их применения. Возможна комбинация терапии агонистами дофамина с аналогами соматостатина.
Благодаря успехам фармакологии были созданы длительно действующие селективные аналоги природного соматостатина (октреотид, ланреотид, сандостатин-ЛАР).
Октреотид (сандостатин, SMS-201995) — первый аналог соматостатина, используемый в клинической практике с середины 1980-х годов. Обладает высоким сродством к соматостатиновым рецепторам 2-го подтипа, по своей СТГ-ингибирующей активности превышает нативный гормон в 45 раз. В суточной дозе 100 мкг 3 раза в день подкожно вызывает нормализацию уровня СТГ и ИРФ-1 соответственно у 50 и 40 % пациентов, значительно снижая секрецию данного гормона у 85 % больных. Как показало большое количество исследований, терапия октреотидом приводит к быстрому выраженному клиническому эффекту. Улучшение общего состояния наступает уже через несколько дней от начала лечения. У 95 % больных значительно уменьшается степень проявления таких клинических симптомов, как головная боль, отечность, потливость, артралгии, общая слабость.
В последние годы создана пролонгированная форма октреотида — сандостатин-ЛАР, а также ланреотид (соматулин). Заключение лекарства в специальные микросферы из поли-DL-лактид-когликолид-глюкозного полимера обусловливает их особенности фармакокинетики, благодаря чему количество инъекций в отличие от сандостатина составляет не три в день, а всего 2–3 в месяц (30 мг в/м — одна инъекция) в случае соматулина и одна инъекция в 28 дней (10–30 мг в/м) в случае сандостатина-ЛАР.
В химической структуре ланреотида присутствие группы 3-(2-naftyl)-D-A1a вне кольца привело к более высокой избирательности по отношению к соматостатиновым рецепторам по сравнению с нативным соматостатином и медленному ферментному расщеплению. Длительность действия ланреотида PR достигается при помощи того, что ланреотид помещен на поверхности и внутри биодеградирующих микросфер. Непосредственно после инъекции препарат высвобождается с поверхности микросфер, что сопровождается быстрым подъемом концентрации ланреотида в крови через 2 часа после в/м введения и последующим медленным снижением его уровня в течение примерно 48 часов. Затем происходит постепенное высвобождение ланреотида из микросфер по мере их биологического распада, что сопровождается новым подъемом концентрации ланреотида в крови и сохранением его уровня не менее 1 нг/л на 9–14-й день после инъекции.
При введении сандостатина-ЛАР концентрация препарата также быстро нарастает благодаря высвобождению с поверхости микросфер, затем снижается и остается на низком уровне в течение 7 дней с новым подъемом уровня октреотида в течение 7 дней с последующим сохранением высокой концентрации препарата в течение 28–42 дней.
Терапия аналогами соматостатина приводит к обратному развитию нарушений со стороны сердечно-сосудистой системы: значительному регрессу симптомов акромегалической кардиомиопатии, снижению системной артериальной гипертензии, левожелудочковой гипертрофии, улучшает функциональные гемодинамические параметры. Уменьшается частота ночных апноэ.
Лечение аналогами соматостатина также приводит к быстрому улучшению деятельности сердечно-легочной системы во время физических нагрузок, снижению факторов риска сердечно-сосудистых заболеваний и уменьшению толщины intima media сонных артерий. Достижение стабильно нормального уровня ИРФ-1 и супрессии СТГ ниже 1 нг/мл в течение 1 года на фоне терапии сандостатином-ЛАР приводит к практически полному восстановлению функции миокарда левого желудочка.
Сравнительная оценка эффективности различных аналогов соматостатина указывает на преимущества сандостатина-ЛАР (октреотида-ЛАР) в отношении воздействия на размеры опухоли как в качестве первичной, так и дополнительной терапии.
Увеличение длительности терапии сандостати- ном-ЛАР более трех лет приводит к возрастанию числа пациентов с «безопасным» уровнем СТГ до 72 % и нормализации уровня ИРФ-1 у 79 % лиц, что полностью совпадает с результатами радикального хирургического лечения в случае эндоселлярных аденом. Выявлена прямая корреляционная зависимость длительности терапии аналогами соматостатина и степени снижения ИРФ-1. Более того, не исключается, что длительная терапия сандостатином-ЛАР может приводить к изменению биологической активности молекулы СТГ. Феномена тахифилаксии во время лечения отмечено не было.
Эффективность терапии аналогами соматостатина при акромегалии не зависит от пола пациента, предыдущего хирургического или лучевого лечения. В некоторых исследованиях лучший контроль достигался у пациентов с невысокими исходными гормональными показателями и/или у пожилых пациентов. При помощи регрессионного анализа было показано, что уровень СТГ/ИРФ-1 соответственно через 3–6 месяцев терапии является самым точным прогностическим фактором для финального исхода терапии, более точным, чем базальный уровень СТГ/ИРФ-1 до начала терапии, длительность наблюдения или доза препарата.
Аналоги соматостатина в настоящее время являются препаратами первой линии в медикаментозном лечении акромегалии. Применяются в случае не-удачного хирургического вмешательства и лучевой терапии как дополнительная терапия, особенно если пациент нечувствителен к терапии агонистами дофамина либо они абсолютно противопоказаны. В отличие от агонистов дофамина аналоги соматостатина являются эффективными средствами в качестве первичного метода лечения, особенно у пожилых, ослаб-ленных больных. Наконец, благодаря способности вызывать уменьшение размера опухоли гипофиза они являются эффективным средством предоперационной подготовки.
С начала 2000 года в практику лечения акромегалии вошел принципиально новый препарат — пегвисомант (сомаверт), являющийся генно-инженерным аналогом эндогенного гормона роста с 9 мутациями, антагонистом рецепторов гормона роста. Определяющей функциональные особенности молекулы пегвисоманта является замена глицина на аланин в положении 120 в области связывания (сайта) 2, блокирующая связывание с рецептором. Одновременно восемь аминокислотных замен в области связывания (сайта) 1 значительно повышают аффинность молекулы антагониста к рецептору. Конформационные изменения, возникающие благодаря данной перестройке, приводят к нарушению связывания молекулы антагониста с рецептором, что, в свою очередь, вызывает нарушение процесса димеризации рецептора и индукции синтеза и секреции ИРФ-1. Это позволяет предупредить периферические эффекты избытка СТГ на клеточном уровне вне зависимости от присутствия соматостатиновых или дофаминовых рецепторов в опухоли гипофиза.
Терапия пегвисомантом уже через 2 недели от момента введения препарата приводит к значительному регрессу клинических симптомов, снижению уровня ИРФ-1 на 75 % от исходного, через 3 месяца — к нормализации данного показателя у 82 %, а через 12 месяцев — у 97 % пациентов при коррекции дозы препарата в процессе лечения.
Одним из самых важных эффектов пегвисоманта является его способность к коррекции различных метаболических нарушений, которые всегда имеются у больных акромегалией и являются основной причиной их инвалидизации и повышенной смертности. В частности, данный препарат приводит к ликвидации гиперинсулинемии и снижению инсулинорезистентности, являющейся фактором риска развития сердечно-сосудистых заболеваний. Пегвисомант восстанавливает показатели липидного обмена, а также уровни лептина и показатели костного ремоделирования. Применяется в дозе 10–30 мг подкожно ежедневно. Побочные эффекты минимальные. Могут проявляться покраснением в месте инъекции, незначительной тошнотой (до 10 % больных). В течение первого месяца лечения отмечается существенное повышение уровня СТГ в сыворотке крови, коррелирующее с дозой вводимого препарата без существенного последующего возрастания, несмотря на продолжающуюся терапию. Имеются данные о единичных случаях незначительного продолженного роста аденомы на фоне терапии данным препаратом, преимущественно у лиц, не получивших в анамнезе лучевую терапию. Есть указания на 6 случаев значительного повышения уровня трансаминаз (АЛТ и ACT) через несколько недель терапии, при этом у 4 больных наступила спонтанная нормализация на фоне продолжающейся терапии пегвисомантом, у 2 — нормализация после прекращения лечения. На фоне лечения в 7–16 % случаев отмечается появление антител к СТГ в низком титре, а также антител к пегвисоманту, без отрицательного влияния на степень нормализации ИРФ-1. С учетом вышесказанного при назначении терапии пегвисомантом необходим контроль размеров аденомы гипофиза (1 раз в 6 месяцев), функции печени (1 раз в месяц). Контроль уровня ИРФ-1 необходимо проводить каждые 4–6 недель с возможной коррекцией дозы препарата. Начальная доза составляет 10 мг в сутки, максимальная ежедневная доза 30 мг.
Несмотря на высокую эффективность препарата, ввиду недостаточной изученности его безопасности и действия на размеры опухоли гипофиза, показаниями к его применению являются: 1) отсутствие эффективности аналогов соматостатина при сроке лечения ими не менее 3 месяцев; 2) сохранение выраженных побочных эффектов после 6 и более месяцев терапии аналогами соматостатина, несмотря на их клинико-гормональную эффективность.
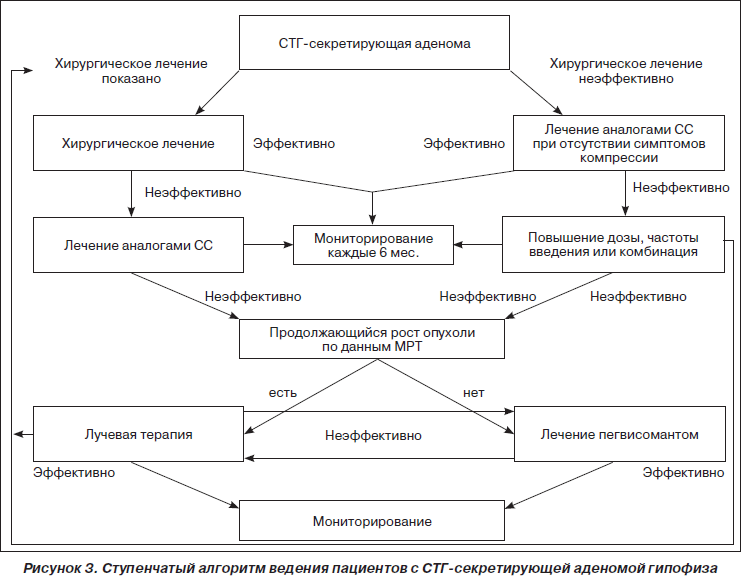
В 2009 г. опубликован консенсус по лечению акромегалии, в котором представлен ступенчатый алгоритм ведения пациентов с СТГ-секретирующей аденомой гипофиза (рис. 3).
Симптоматическая терапия акромегалии определяется в каждом конкретном случае и зависит от характера и степени вовлечения в патологический процесс того или иного органа или системы организма (коррекция изменений со стороны сердечно-сосудистой системы, опорно-двигательного аппарата, метаболических нарушений, лечение осложнений лучевой терапии).