Основные положения теории Шпитальского – Кобозева.
Основные положения теории Шпитальского:
1) катализатор это соединение, которое переводит исходное вещество в промежуточное соединение – активный промежуточный комплекс;
2) образование промежуточного соединения – быстрый равновесный процесс;
3) распад промежуточного вещества протекает медленно с образованием конечного продукта и восстановлением kat;
4) скорость каталитического процесса пропорциональна концентрации катализатора.
При исследовании гомогенно каталитический реакций было замечено, что при определенный условиях скорость каталитической реакции перестает зависеть от концентрации kat, а иногда от концентрации одного из субстратов. Кобозев назвал это явление "скрытым катализом". В основе этой теории лежит представление о необходимости предварительной активации молекулы субстрата S перед ее взаимодействием с катализатором.
Вывод уравнения скорости гомогенного катализа для мономолекулярной реакции.
Допустим суммарная формально мономолекулярная реакция представляется уравнением:
S→P
S-субстрат
P-продукт реакции
Субстрат образует с катализатором нестойкий промежуточный продукт М, который характеризуется константой равновесия:
S+kat↔M
K=K1/K-1=[M]/([S]*[kat])
K1 константа скорости прямой реакции образования промежуточного продукта
K-1 константа скорости обратного разложения на катализатор и субстрат.
Разложение промежуточного продукта на конечный продукт реакции и катализатор происходит медленно:
M→Р...+kat
Скорость процесса пропорциональна концентрации промежуточного вещества:
V=K2*[M]
Разложение промежуточного продукта М протекает медленно и его концентрация определяется константой равновесия с исходным веществом и свободным катализатором:
K= K1/K-1=[M]/([S]-[M])*([kat]-[M])
В условиях катализа имеет место соизмеримость концентраций катализатора и промежуточного вещества, а так как [kat]«[S], то и [М]«[S]. Пренебрегая [M] по сравнению с [S] получаем:
K=K1/K-1=[M]/([S]*[kat]-[M])
[M]=K*[S]*[kat]/(1+K*[S])
V=K2*[M]=K2*K*[S]*[kat]/(1+K*[S])
Из уравнения следует что 1) для формально мономолекулярной реакции кинетический порядок по субстрату может быть нулевым, дробным и первым
2) скорость процесса пропорциональна концентрации катализатора.
Вывод уравнения скорости гомогенного катализа для бимолекулярной реакции.
1) Допустим суммарная формально бимолекулярная реакция представляется уравнением:
2S→P1+P2+...
S-субстрат
P-продукт реакции
Субстрат образует с катализатором нестойкий промежуточный продукт М, который характеризуется константой равновесия:
2S+kat↔M
Разложение промежуточного продукта на конечный продукт реакции и катализатор происходит медленно
M→P1+P2+...+kat
Упрощенное выражение для К в этом случае имеет вид:
K=[M]/[S]2*{[kat]-[M]}
скорость реакции:
V=k2[M]=(k2*K*[S]2*[kat])/(1+K*[S]2)
из уравнения следует что для формально бимолекулярной реакции кинетический порядок по субстрату изменяется от нулевого K*[S]2»1, до второго при K*[S]2«1.
Принцип структурного соответствия в катализе.
В течение нескольких лет были сформулированы основные положения мультиплетной теории катализа и, прежде всего, принцип структурного соответствия, суть которого сводится к следующим постулатам.
1)Активные центры представляют собой фрагменты кристаллических решѐток и состоят из нескольких атомов, как правило, двоек, троек и шестѐрок (мультиплетов).
2)Если два атома реагента хемосорбируются на одном атоме, входящем в состав активного центра, то между ними возникает химическая связь; если на двух атомах – то имеющаяся между ними связь разрывается.

3)При гидрировании двойной связи С=С олефин хемосорбируется на двух атомах металла. При этом наиболее активными для катализа гидро-дегидрирования углерод-углеродной связи будут металлы, для которых угол МСС в образующемся комплексе будет близок к тетраэдрическому, т.е. к 109о
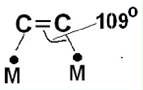
Принцип структурного соответствия в катализе устанавливает соответствие орбиталей молекул субстрата и орбиталей активного центра.