Тема 15.
Лекция 23. Биохимия мышц
Белки миофибрилл, молекулярная структура: миозин, актин, актомиозин, тропомиозин, тропонин. Биохимические механизмы мышечного сокращения и расслабления.
Особенности энергетического обмена в мышцах; креатинфосфат. Биохимические изменения при мышечных дистрофиях и деинервации мышц. Креатинурия.
| Краткое содержание | Конспект | |||||||
| 1. Белки миофибрилл, молекулярная структура: миозин, актин, актомиозин, тропомиозин, тропонин. Биохимические механизмы мышечного сокращения и расслабления | ||||||||
Саркомер – это функциональная единица мышцы. Саркомеры следуют друг за другом вдоль оси фибриллы, повторяясь через каждые 1500-2300 нм. Поперечнополосатая мышца состоит из многоядерных клеток (мышечных волокон), окруженных электровозбудимой мембраной – сарколеммой.
При исследовании миофибриллы в электронном микроскопе выявляется чередование темных и светлых дисков (диски А и I). Центральная область диска А (зона Н) выглядит менее плотной, чем остальная его часть. Диск I делит пополам очень плотная и узкая линия Z.
Каждая миофибрилла состоит из двух типов продольных филаментов (нитей). Первый тип («толстые» нити) ограничены А-диском, они состоят главным образом из белка миозина, имеют около 16 нм в диаметре.
Второй тип филаментов («тонкие» нити) занимает I-диск, распространяется на диск А, но не достигает его Н-зоны. Диаметр тонких нитей составляет около 6 нм. Они содержат белки актин, тропомиозин и тропонин. Толстые и тонкие филаменты взаимодействуют при посредстве поперечных мостиков, расположенных вдоль толстого филамента с промежутками в 14 нм.
Во время сокращения мышцы длина толстых и тонких филаментов не меняется, но Н-зона и I-диски укорачиваются, следовательно, переплетающиеся филаменты должны скользить относительно друг друга.
Мышечные белки
Два главных мышечных белка – актин и миозин. Мономерный (глобулярный) актин (G-актин) – это глобулярный белок с молекулярной массой 43000, на долю которого приходится 25% общей массы мышечного белка. При физиологической величине ионной силы и в присутствии магния G-актин подвергается нековалентной полимеризации с образованием нерастворимого двойного спирального филамента, получившего название F-актин.
 Тропомиозин представляет собой вытянутую в виде тяжа молекулу, состоящую из двух цепей - α и β.
Характерной особенностью именно поперечнополосатых мышц является наличие в них тропониновой системы, включающей три разных белка: тропонин Т, тропонин I и тропонин С.
Актомиозин образуется при соединении миозина с F-актином и он обладает АТФазной активностью.
Тропомиозин представляет собой вытянутую в виде тяжа молекулу, состоящую из двух цепей - α и β.
Характерной особенностью именно поперечнополосатых мышц является наличие в них тропониновой системы, включающей три разных белка: тропонин Т, тропонин I и тропонин С.
Актомиозин образуется при соединении миозина с F-актином и он обладает АТФазной активностью.
|
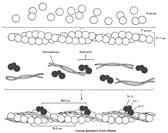
Расположение филаментов в поперечнополосатой мышце.
 А. Расслабленная мышца.
Б. Сокращенная мышца.
Схематическое изображение тонкого филамента. Показана пространственная конфигурация трех главных белковых компонентов: актина, тропомиозина и тропонина.
Актин-миозиновые взаимодействия в поперечнополосатых и гладких мышцах
А. Расслабленная мышца.
Б. Сокращенная мышца.
Схематическое изображение тонкого филамента. Показана пространственная конфигурация трех главных белковых компонентов: актина, тропомиозина и тропонина.
Актин-миозиновые взаимодействия в поперечнополосатых и гладких мышцах

| |||||||
| 2. Особенности энергетического обмена в мышцах; креатинфосфат. Биохимические изменения при мышечных дистрофиях и деинервации мышц. Креатинурия | ||||||||
Мышечное сокращение состоит из циклов присоединения и отсоединения глобулярной «головки» миозина от нити F-актина.
Присоединение сопровождается изменением актин-миозинового взаимодействия, так что актиновые и миозиновые филаменты скользят относительно друг друга. Энергия для этого скольжения поставляется за счет гидролиза АТР.
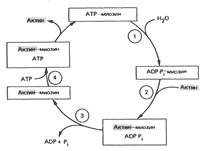 Гидролиз АТР миозиновой АТРазой значительно ускоряется при связывании миозиновой «головки» с F-актином. Биохимический цикл мышечного сокращения состоит из пяти стадий:
1) Миозиновая головка сама по себе может гидролизовать АТР до ADP и неорганического фосфата, но не обеспечивает освобождение продуктов гидролиза. Следовательно, этот процесс носит скорее стехиометрический, чем каталитический характер.
2) Миозиновая головка, содержащая ADP и неорганический фосфат, может свободно вращаться под большими углами и (при достижении нужного положения) связываться с F-актином, образуя с осью фибриллы угол около 90°.
3) Это взаимодействие обеспечивает высвобождение ADP и неорганического фосфата из актин-миозинового комплекса. Поскольку наименьшую энергию актомиозиновая связь имеет при величине угла 45°, миозин изменяет свой угол с осью фибриллы с 90° на примерно 45°, продвигая актин (на 10-15 нм) в направлении центра саркомера.
4) Новая молекула АТР связывается с комплексом миозин-F-актин.
5) Комплекс миозин-АТР обладает низким сродством к актину и поэтому происходит отделение миозиновой (АТР) головки от F-актина.
Последняя стадия и есть собственно расслабление, которое таким образом отчетливо зависит от связывания АТР с актин-миозиновым комплексом. АТР вновь гидролизуется миозиновой головкой без высвобождения ADP и неорганического фосфата, и цикл возобновляется.
Процессом, непосредственно связанным с работающим механизмом поперечно-полосатого мышечного волокна, является распад АТФ с образованием АДФ и неорганического фосфата. Возникает вопрос: каким образом мышечная клетка может обеспечить свой сократительный аппарат достаточным количеством энергии в форме АТФ, т.е. каким образом в процессе мышечной деятельности происходит непрерывный ресинтез этого соединения?
Ресинтез АТФ обеспечивается трансфосфорилированием АДФ с креатинфосфатом. Данная реакция катализируется ферментом креатинкиназой:
Креатинфосфат + АДФ ↔ Креатин + АТФ
Креатинкиназа
Креатинкиназный путь ресинтеза АТФ является чрезвычайно быстрым и максимально эффективным (за счет каждой молекулы креатинфосфата образуется молекула АТФ). Запасы креатинфосфата в мышце невелики, а доступность энергии креатинфосфата имеет ценность для работающей мышцы только в том случае, если расход его постоянно возмещается синтезом АТФ в процессе метаболизма.
Креатинфосфат в мышечной ткани (в частности, в сердечной мышце) способен выполнять не только роль как бы депо легкомобилизуемых макроэргических фосфатных групп, но также роль транспортной формы макроэргических фосфатных связей, образующихся в процессе тканевого дыхания и связанного с ним окислительного фосфорилирования
Биохимические изменения в мышцах
Общими для большинства заболеваний мышц (прогрессирующие мышечные дистрофии, атрофия мышц в результате их денервации, тенотомия, полимиозит, некоторые авитаминозы и т.д.) являются резкое снижение в мышцах содержания миофибриллярных белков, возрастание концентрации белков стромы и некоторых саркоплазматических белков, в том числе миоальбумина. Наряду с изменениями фракционного состава мышечных белков при поражениях мышц наблюдается снижение уровня АТФ и креатинфосфата. Например, через 12 дней после денервации содержание АТФ в денервированной икроножной мышце кролика снижается более чем в 2 раза. Отмечаются также снижение АТФазной активности контрактильных белков (миозина), уменьшение количества имидазолсодержащих дипептидов.
При прогрессирующих мышечных дистрофиях и других заболеваниях, связанных с распадом мышечной ткани, часто отмечаются сдвиги в фосфолипидном составе мышц: значительно снижается уровень фосфатидилхолина и фосфатидилэтаноламина, концентрация сфингомиелина и лизофосфатидилхолина повышается. До сих пор истинные механизмы изменения фосфолипидного состава мышечной ткани при патологии не выяснены, неизвестна также роль этих сдвигов в патогенезе мышечных дистрофий.
Гидролиз АТР миозиновой АТРазой значительно ускоряется при связывании миозиновой «головки» с F-актином. Биохимический цикл мышечного сокращения состоит из пяти стадий:
1) Миозиновая головка сама по себе может гидролизовать АТР до ADP и неорганического фосфата, но не обеспечивает освобождение продуктов гидролиза. Следовательно, этот процесс носит скорее стехиометрический, чем каталитический характер.
2) Миозиновая головка, содержащая ADP и неорганический фосфат, может свободно вращаться под большими углами и (при достижении нужного положения) связываться с F-актином, образуя с осью фибриллы угол около 90°.
3) Это взаимодействие обеспечивает высвобождение ADP и неорганического фосфата из актин-миозинового комплекса. Поскольку наименьшую энергию актомиозиновая связь имеет при величине угла 45°, миозин изменяет свой угол с осью фибриллы с 90° на примерно 45°, продвигая актин (на 10-15 нм) в направлении центра саркомера.
4) Новая молекула АТР связывается с комплексом миозин-F-актин.
5) Комплекс миозин-АТР обладает низким сродством к актину и поэтому происходит отделение миозиновой (АТР) головки от F-актина.
Последняя стадия и есть собственно расслабление, которое таким образом отчетливо зависит от связывания АТР с актин-миозиновым комплексом. АТР вновь гидролизуется миозиновой головкой без высвобождения ADP и неорганического фосфата, и цикл возобновляется.
Процессом, непосредственно связанным с работающим механизмом поперечно-полосатого мышечного волокна, является распад АТФ с образованием АДФ и неорганического фосфата. Возникает вопрос: каким образом мышечная клетка может обеспечить свой сократительный аппарат достаточным количеством энергии в форме АТФ, т.е. каким образом в процессе мышечной деятельности происходит непрерывный ресинтез этого соединения?
Ресинтез АТФ обеспечивается трансфосфорилированием АДФ с креатинфосфатом. Данная реакция катализируется ферментом креатинкиназой:
Креатинфосфат + АДФ ↔ Креатин + АТФ
Креатинкиназа
Креатинкиназный путь ресинтеза АТФ является чрезвычайно быстрым и максимально эффективным (за счет каждой молекулы креатинфосфата образуется молекула АТФ). Запасы креатинфосфата в мышце невелики, а доступность энергии креатинфосфата имеет ценность для работающей мышцы только в том случае, если расход его постоянно возмещается синтезом АТФ в процессе метаболизма.
Креатинфосфат в мышечной ткани (в частности, в сердечной мышце) способен выполнять не только роль как бы депо легкомобилизуемых макроэргических фосфатных групп, но также роль транспортной формы макроэргических фосфатных связей, образующихся в процессе тканевого дыхания и связанного с ним окислительного фосфорилирования
Биохимические изменения в мышцах
Общими для большинства заболеваний мышц (прогрессирующие мышечные дистрофии, атрофия мышц в результате их денервации, тенотомия, полимиозит, некоторые авитаминозы и т.д.) являются резкое снижение в мышцах содержания миофибриллярных белков, возрастание концентрации белков стромы и некоторых саркоплазматических белков, в том числе миоальбумина. Наряду с изменениями фракционного состава мышечных белков при поражениях мышц наблюдается снижение уровня АТФ и креатинфосфата. Например, через 12 дней после денервации содержание АТФ в денервированной икроножной мышце кролика снижается более чем в 2 раза. Отмечаются также снижение АТФазной активности контрактильных белков (миозина), уменьшение количества имидазолсодержащих дипептидов.
При прогрессирующих мышечных дистрофиях и других заболеваниях, связанных с распадом мышечной ткани, часто отмечаются сдвиги в фосфолипидном составе мышц: значительно снижается уровень фосфатидилхолина и фосфатидилэтаноламина, концентрация сфингомиелина и лизофосфатидилхолина повышается. До сих пор истинные механизмы изменения фосфолипидного состава мышечной ткани при патологии не выяснены, неизвестна также роль этих сдвигов в патогенезе мышечных дистрофий.
|
Гидролиз АТР запускает цикл ассоциации и диссоциации актина и миозина в пяти реакциях.
Рi— неорганический фосфат.
Характеристика быстрых и медленных скелетных мышц
 Множественные источники АТФ в мышце
Множественные источники АТФ в мышце
 Для многих форм патологии мышечной ткани характерны нарушение метаболизма креатина и его усиленное выделение с мочой (креатинурия). Несмотря на многочисленные исследования и обилие фактического материала, вопрос о причинах креатинурии при заболеваниях мышц не может считаться окончательно решенным. Принято считать, что креатинурия у больных миопатией является результатом нарушения в скелетной мускулатуре процессов фиксации (удержания) креатина и его фосфорилирования. Если нарушен процесс синтеза креатинфосфата, то не образуется и креатинина; содержание последнего в моче резко снижается. В результате креатинурии и нарушения синтеза креатинина резко повышается креатиновый показатель (креатин/креатинин) мочи.
Для многих форм патологии мышечной ткани характерны нарушение метаболизма креатина и его усиленное выделение с мочой (креатинурия). Несмотря на многочисленные исследования и обилие фактического материала, вопрос о причинах креатинурии при заболеваниях мышц не может считаться окончательно решенным. Принято считать, что креатинурия у больных миопатией является результатом нарушения в скелетной мускулатуре процессов фиксации (удержания) креатина и его фосфорилирования. Если нарушен процесс синтеза креатинфосфата, то не образуется и креатинина; содержание последнего в моче резко снижается. В результате креатинурии и нарушения синтеза креатинина резко повышается креатиновый показатель (креатин/креатинин) мочи.
| |||||||
 НОРМА ДИСТРОФИЯ
Печень Мышца Печень Мышца НОРМА ДИСТРОФИЯ
Печень Мышца Печень Мышца
Глицин Креатин Креатин Глицин Креатин Креатин
Метионин Фосфокреатин Метионин Фосфокреатин
Креатинин Креатинин ↓ ↓ М о ч а М о ч а |



