Для определения состава некоторого минерала был проведен следующий эксперимент. Навеску вещества массой 10,00 г сплавили со смесью гидроксида и пероксида натрия. Плав обработали горячей водой. При этом получился бесцветный раствор и черный осадок.
Полученный раствор нейтрализовали азотной кислотой и обработали избытком раствора ляписа. Образовалось 27,75 г осадка шоколадного цвета, обработка смеси которого с цинковыми стружками соляной кислотой привела к выделению газа с запахом чеснока. К оставшемуся раствору добавили избыток баритовой воды, при этом образовалось 14,00 г белого осадка, нерастворимого в минеральных кислотах.
Полученный после обработки водой черный осадок растворили в избытке соляной кислоты. При этом выделился газ и получился зеленый раствор, не меняющий цвета при разбавлении водой. При добавлении к раствору реактива Чугаева (диметилглиоксима) выпал красный объемистый осадок, масса которого после высушивания составила 17,33 г.
Определите состав минерала и напишите уравнения описанных превращений.
Решение
Определим качественный состав минерала. Образование шоколадно-коричневого осадка с ионом серебра, возможность восстановления полученного осадка водородом в момент выделения с образованием газообразного продукта с запахом чеснока указывают на присутствие в минерале мышьяка. (2 балла)
Зеленый цвет раствора хлорида металла характерен, в первую очередь, для хлоридов меди и никеля. Отсутствие изменения окраски с разбавлением позволяет сделать вывод в пользу никеля. На это же указывает образование красного осадка с реактивом Чугаева. (2 балла)
Определим соотношение никеля и мышьяка в исходном минерале.
ν (As) = ν (Ag3AsO4) = 27,75: 463 = 0,06 моль (1 балл)
ν (Ni) = ν (Ni(HONC(CH3)C(CH3)NO)2) = 17,33:289 = 0,06 моль (1 балл)
На эти два элемента приходится 8,04 г от взятого образца минерала.
Образование нерастворимого в кислоте белого осадка соли бария указывает на присутствие в минерале серы, селена или фосфора. Проверка показывает, что наиболее вероятно образование сульфата бария. (2 балла) Тогда в исходном образце содержалось также 0,06 моль серы, что соответствует общей масе образца 9,96 г (ошибка в 0,4% лежит в пределах ошибок аналитических определений – каждое из гравиметрических определений дает погрешность 0,2%). (1 балл)
Таким образом, состав исходного минерала NiAsS. (1 балл)
Реакции:
2NiAsS + 15Na2O2 = 2NiO2 (черный осадок) + 2Na3AsO4 + 2Na2SO4 + 10Na2O (2 балла)
Na2O + 2HNO3 = 2NaNO3 + H2O (1 балл)
Na3AsO4 + 3AgNO3 = Ag3AsO4 (шкоколадно-коричневый осадок) + 3NaNO3 (1 балл)
Ag3AsO4 + Zn + HCl = AgCl + ZnCl2 + AsH3 (газ с запахом чеснока) (2 балла)
NiO2 + 4HCl = NiCl2 (зеленый раствор) + Cl2 + 2H2O (1 балл)
NiCl2 + 2HONC(CH3)C(CH3)NO = Ni(HONC(CH3)C(CH3)NO)2 (красный объемистый осадок) (2 балла)
Na2SO4 + Ba(OH)2 = BaSO4 + 2NaOH (1 балл)
Задача №4. «Четыре ампулы». (20 баллов)
В четыре ампулы одинакового объема 50 см3 поместили навески, вакуумировали и нагрели. Через некоторое время измерили давление, установившееся в ампулах. Данные о составе навесок, температуре и давлении приведены в таблице.
| Ампула №1 | Ампула №2 | Ампула №3 | Ампула №4 | |
| Состав навески | 10 мг CaCO3 | 10 мг CaCO3 | 10 мг CaCO3 + 10 мг графита | 20 мг CaCO3 + 10 мг графита |
| Температура, 0С | ||||
| Давление, атм | 2,14∙10-4 | 6,33∙10-2 | 1,11∙10-3 | 0,303 |
Твердую смесь извлекли из ампул, охладили и промыли теплой водой.
1. Определить массы твердых остатков, оставшихся после промывания.
2. Оцените, какую минимальную массу графита нужно поместить в ампулы объемом 100 см3, содержащим по 50 мг карбоната кальция, чтобы при нагревании до температур 500 и 7000С, давление оказалось таким же, как и в описанном эксперименте?
3. Почему с ростом температуры давление в ампулах растет?
4. К растворам, полученным после промывания 10 мл воды твердых остатков добавили по 10 мг сульфата натрия. Определите массы образовавшихся осадков. Произведение растворимости, являющееся константой равновесия процесса растворения ионного соединения, для сульфата кальция равно  .
.
Решение
1. Запишем уравнения равновесных процессов, подтекающих в ампулах:
В ампулах №№1 и 2 разлагается карбонат кальция:
 (реакция 1) (0,5 балла)
(реакция 1) (0,5 балла)
В ампулах №№ 3 и 4 кроме предыдущего равновесия наступает еще одно:
 (реакция 2) (1 балл)
(реакция 2) (1 балл)
Запишем выражения для констант этих равновесий через парциальные давления газов. Концентрации твердых веществ в записи констант равновесия отсутствуют:


Найдем количества веществ, помещенных в ампулы:
 (ампулы №№1-3) (0,5 балла)
(ампулы №№1-3) (0,5 балла)
 (ампула №4) (0,5 балла)
(ампула №4) (0,5 балла)
 (0,5 балла)
(0,5 балла)
Зная объем ампул, давление и температуру, по уравнению Менделеева-Клапейрона можно найти суммарное количество газов, находящихся в ампулах (не забывайте следить за размерностями!):

В ампуле №1:
 (0,5 балла)
(0,5 балла)
Аналогично можно найти давление и в остальных ампулах:
 (0,5 балла)
(0,5 балла)
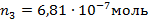 (0,5 балла)
(0,5 балла)
 (0,5 балла)
(0,5 балла)
Причем n1 и n2 – это количества углекислого газа, образовавшегося в результате разложения карбоната кальция (т.к. других газов в системе нет), а n3 и n4 – суммарное количество CO2 и CO.
Теперь можно рассчитать состав равновесных твердых смесей, оставшихся в ампулах.
В ампуле №1:
Количество оксида кальция, образовавшееся в ампуле равно количеству углекислого газа (реакция 1), количество оставшегося карбоната кальция равно исходному количеству соли за вычетом разложившегося карбоната (равного количеству СО2):
n(CaCO3) = 10-4 – 1,96∙10-7 = 9,998∙10-5 моль
n(СaO) = 1,96∙10-7 моль (1 балл)
В ампуле №3:
Расчет аналогичен случаю для ампулы №1.
n(CaCO3) = 10-4 – 6,81∙10-7 = 9,993∙10-5 моль
n(СaO) = 6,81∙10-7 моль (1 балл)
Расчет количества твердых остатков в ампулах №№2 и 4 несколько сложнее. В ампуле №3 температура такая же, как и в ампуле №1, следовательно, константа равновесия разложения карбоната кальция (реакция 1) не изменилась (константа равновесия зависит только от температуры). Таким образом парциальное давление (и количество) углекислого газа будет таким же, как и в ампуле №1. Добавление в систему углерода приводит к появлению угарного газа (реакция 2), то есть часть углекислого газа должна прореагировать с графитом. Но его суммарное количество в ампуле осталось прежним, значит, в результате добавления графита некоторое количество карбоната кальция подверглось разложению, чтобы компенсировать образование угарного газа по реакции 2. По сути, добавление графита в ампулу привело к смещению равновесия 1 вправо, поддерживая постоянное парциальное давление СО2.
Другими словами
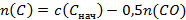


Аналогично можно рассчитать состав твердого остатка в ампуле №4. (6 баллов)
Полученные количества веществ приведены в таблице:
| Ампула №1 | Ампула №2 | Ампула №3 | Ампула №4 | |
| CO2 | 1,69∙10-7 | 3,96∙10-5 | 1,69∙10-7 | 3,96∙10-5 |
| CO | - | - | 7,06∙10-7 | 1,504∙10-4 |
| CaCO3 | 9,98∙10-5 | 6,04∙10-5 | 9,95∙10-5 | 3,7∙10-5 |
| CaO | 1,69∙10-7 | 3,96∙10-5 | 5,22∙10-7 | 1,69∙10-4 |
| C | - | - | 8,326∙10-4 | 7,58∙10-4 |
После промывания теплой водой из смеси уходит оксид кальция:
CaO + H2O = Ca(OH)2 (реакция 3) (1 балл)
Таким образом, в состав твердых смесей входят только графит и карбонат кальция (см. таблицу)
2. Поскольку объем ампул равен 100 см3, то количества газов, которые будут находиться в ампулах при данных температурах в раза больше, чем в п.1. Таким образом, количество СО будет равно 1,4∙10-7 моль при 5000С и 3∙10-4 моль при 7000С. (1 балл) Для образования такого количества угарного газа нужно в два раза меньше графита (реакция 2). Следовательно, при 5000С минимальная масса графита составляет 8,4∙10-3 мг, а при 7000С 1,8 мг. (1 балл)
3. Давление в ампулах с ростом температуры растет по дум причинам. Во-первых, при повышении температуры при сохранении объема растет давление (уравнение Менделеева-Клапейрона). (1 балл) Во-вторых, при повышении температуры происходит рост констант равновесия, то есть равновесие смещается в сторону продуктов реакций, что приводит к увеличению числа газовых моль и, соответственно, росту давления. (1 балл)
4. При добавлении сульфата натрия к растворам может протекать реакция
Na2SO4 + Ca(OH)2 = 2NaOH + CaSO4 (1 балл)
Однако осадок будет образовываться когда произведение молярных концентраций катионов кальция и сульфатных анионов превысит  . Найдем концентрации этих ионов (первая ампула).
. Найдем концентрации этих ионов (первая ампула).

 (1 балл)
(1 балл)

Следовательно, осадок образовываться не будет. (1 балл)
Задача №5. «Кому все это нужно?!» (20 баллов) (в каждом задании было по 6 веществ)
Заполните предлагаемую таблицу, используя подсказки об агрегатных состояниях и областях применения веществ:
| Вещество | Агрегатное состояние при н.у. | Применение |
| UF6 | ||
| SnCl4 | ||
| SF6 | ||
| Формальдегид | ||
| Этиленгликоль | ||
| Диметилсульфоксид |
При н.у. два вещества из представленных являются газообразными, два жидкими и два твердыми.
Применение: Антифриз в автомобилях; Добавка для закаливания стекла; Для консервации биологических материалов; Местное противовоспалительное и обезболивающее; Для разделения изотопов; Изолятор и теплоноситель в высоковольтной технике
По 2 балла за каждое верно определённое агрегатное состояние (суммарно не более 10 баллов); по 2 балла за каждое верно определённое применение (суммарно не более 10 баллов).
Ответ на все варианты:
| Вещество | Агрегатное состояние при н.у. | Применение |
| BCl3 | ж | Флюс для пайки |
| SnCl4 | ж | Добавка для закаливания стекла |
| SF6 | газ | Изолятор и теплоноситель в высоковольтной технике |
| UF6 | тв | Для разделения изотопов |
| XeF2 | тв | Фторирующий агент |
| HF | ж | При производстве алюминия |
| CrF5 | Разл. | Практического значения не имеет |
| ClF5 | Газ | Практического значения не имеет |
| ICl | тв | Реактив в органическом синтезе |
| Глицерин | Тв | Используется для производства взрывчатых веществ |
| Этиленгликоль | жидк | Антифриз в автомобилях |
| Уксусная кислота | Тв | Пищевая добавка Е260 |
| Бензол | тв | Добавка для повышения октанового числа |
| Формальдегид | газ | Для консервации биологических материалов |
| Диметилсульфоксид | тв | Местное противовоспалительное и обезболивающее |