Задача №1. «Раз изотоп, два изотоп» (25 баллов)
В некоторой параллельной Вселенной, имеющей тот же набор химических элементов, что и наша, фтор представлен в виде двух изотопов с массовыми числами 14 и 17. Известно, что изотопный состав остальных элементов такой же, как и в нашей Вселенной. 6,0 г такого фтора может прореагировать либо с 9,2 г металла А, либо с 0,4 г неметалла В. Определите металл А и неметалл В. Установите среднюю молярную массу атома фтора и соотношение его изотопов. Какой порядковый номер имел бы такой атом? Ответ поясните. Напишите уравнение реакции металла А с неметаллом В.
Решение
Сначала установим, какие элементы взаимодействуют со фтором. Проще определить неметалл В, поскольку в реакцию вступает очень маленькая масса этого элемента.
Для этого запишем взаимодействие В со фтором в общем виде:
хF2 + 2B = 2BFx, где х – степень окисления элемента В (2 балла)
Согласно уравнению реакции можно связать количество фтора и количество элемента В:
 (2 балла)
(2 балла)
Мы можем рассмотреть два крайних случая, считая молярную массу фтора 14 и 17, в результате получим неравенство:

Преобразуя неравенство получим

Единственный элемент, который удовлетворяет неравенству – это водород (М = 1 при x = 1). (3 балла)
Теперь можно записать уравнение реакции водорода со фтором и определить молярную массу атома фтора:
H2 + F2 = 2HF


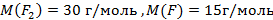 (3 балла)
(3 балла)
Определив молярную массу фтора, мы можем рассчитать изотопный состав этого элемента (то есть массовые доли фтора-14 и фтора-17):

Обозначив за x массовую долю фтора-14 получим


То есть массовая доля фтора-14 – 67%, а массовая доля фтора-17 – 33%. (3 балла) Соответственно, соотношение изотопов равняется 2:1. (3 балла)
Теперь установим металл В. Для этого запишем реакцию со фтором в общем виде
хF2 + 2A = 2AFx, где х – степень окисления элемента A (2 балла)



При х = 1 получаем М(А)=23 г/моль, это Na (2 балла)
Теперь запишем уравнение реакции натрия с водородом:
2Na + H2 = 2NaH (1 балл)
Порядковый номер любого элемента зависит только от заряда ядра, а не от изотопного состава, следовательно, в этой параллельной Вселенной порядковый номер фтора будет так же 9. (4 балла)
Задача №2. «Догадливый, но неумелый» (25 баллов)
При ликвидации химического склада Юному Химику досталась плотно закупоренная склянка с полустершейся надписью «Гидроксид…». Для определения состава соединения Юный Химик поставил следующий опыт: он растворил в 100 г воды 2,5 г реактива и определил плотность раствора – она составила 1,00 г/мл. Далее Юный Химик отобрал пробу раствора объемом 5,00 мл, разбавил водой, добавил фенолфталеин и стал добавлять с помощью пипетки Мора (т.е., порциями по 1 мл) раствор азотной кислоты с концентрацией 0,10 моль/л. После добавления 16 мл раствора он заметил, что фенолфталеин уже обесцветился. Юный Химик повторил опыт, заменив фенолфталеин на метилоранж. Он закончил эксперимент, добавив 14 мл раствора кислоты, но после перемешивания раствор вновь стал желтым. Определите из полученных результатов титрования, какое вещество находилось в склянке.
Решение
Запишем уравнение реакции нейтрализации в общем виде:
M(OH)x + xHNO3 = M(NO3)x + xH2O (4 балла)
Определим, в каких пределах находится молярная масса этого гидроксида.
В первом случае на титрование пошло 16∙0,10 = 1,6 ммоль кислоты. (3 балла) Во втором – 1,4 ммоль кислоты. (3 балла)
Следовательно, в исходной навеске содержалось либо от 28,7 (1,4∙102,5/5) до 32,8 ммоль гидроксида одновалентного металла (5 баллов), либо от 14,35 до 16,4 ммоль гидроксида двухвалентного металла. (5 баллов)
В первом случае молярная масса гидроксида металла находится в диапазоне 76 – 87 г/моль (такого металла нет), во втором – 152 – 174 г/моль. Тогда искомое вещество – гидроксид бария. (5 баллов)
Задача №3. «Ленивый студент» (25 баллов)
В качестве контрольной задачи по качественному анализу студенту был выдан раствор, содержащий 6 ионов (4 катиона и 2 аниона ) из следующего списка: сульфат, хлорид, иодид, хлорат, гипохлорит; катионы алюминия, железа(II), железа(III), свинца, хрома(II), марганца, хрома(III) (не считая ионов водорода и гидроксид-ионов). Студент немного подумал и решил ограничиться определением реакции среды раствора: проба с индикаторной бумажкой показала сильно кислую среду. После этого студент сразу сдал правильный ответ преподавателю. Какие же ионы присутствовали в задаче? Ответ подтвердите уравнениями реакций.
Решение
Поскольку среда кислая, существование гипохлорит-иона представляется крайне маловероятным.
H+ + ClO- = HClO (3 балла)
Точно также в кислом растворе не существует ион Cr2+.
2Cr2+ + 2H+ = 2Cr3+ + H2 (3 балла)
Рассмотрим остальные комбинации:
| SO42- | Cl- | ClO3- | I- | |
| Cr3+ | – | |||
| Fe2+ | – | |||
| Pb2+ | ↓ | ↓ | ↓ | |
| Al3+ | ||||
| Mn2+ | – |
Pb2+ + SO42- = PbSO4 (2 балла)
Pb2+ + 2Cl- = PbCl2 (2 балла)
Pb2+ + 2I- = PbI2 (2 балла)
2Cr3+ + 2I- = 2Cr2+ + I2 (4 балла)
6Fe2+ + ClO3- + 6H+ = 6Fe3+ + Cl- + 3H2O (4 балла)
3Mn2+ + ClO3- + 3H2O = 3MnO2 + Cl- + 6H+ (4 балла)
Таким образом, выданный раствор содержал катионы хрома (III), железа(II), алюминия и марганца, анионы сульфат и хлорид. (1 балл)
Задача №4 «Кому все это нужно?!» (25 баллов) в варианте было по 6 веществ из общего списка.
Заполните предлагаемую таблицу, используя подсказки об агрегатных состояниях и областях применения веществ:
| Вещество | Агрегатное состояние при н.у. | Применение |
| ClF5 | ||
| SF6 | ||
| UF6 | ||
| ICl | ||
| SnCl4 | ||
| N2H4 |
При н.у. два вещества из представленных являются газообразными, одно жидким и три твердыми.
Применение: Добавка для закаливания стекла; Реактив в органическом синтезе; Изолятор и теплоноситель в высоковольтной технике; Практического значения не имеет; Для разделения изотопов; Ракетное топливо.
По 2,5 балла за каждое верно определённое агрегатное состояние (суммарно не более 12,5 баллов); по 2,5 балла за каждое верно определённое применение (суммарно не более 12,5 баллов).
Ответ на все варианты:
| Вещество | Агрегатное состояние при н.у. | Применение |
| HCN | ж | Боевое отравляющее вещество |
| HN3 | ж | Производные используются в качестве взрывчатых веществ |
| NF3 | г | При травлении кремниевых пластин |
| SO3 | тв | При производстве кислоты |
| OsO4 | тв | Краситель в микроскопии |
| Ga | тв | Производство полупроводников |
| SO2 | г | Консервант в виноделии |
| N2H4 | тв | Ракетное топливо |
| H2O2 | ж | Антисептик |
| BCl3 | ж | Флюс для пайки |
| TiCl4 | ж | Для постановки дымовых завес |
| SnCl4 | ж | Добавка для закаливания стекла |
| SF6 | газ | Изолятор и теплоноситель в высоковольтной технике |
| UF6 | тв | Для разделения изотопов |
| XeF2 | тв | Фторирующий агент |
| CF4 | г | В системах автоматического пожаротушения |
| HF | ж | При производстве алюминия |
| COCl2 | г | Боевое отравляющее вещество |
| ClF5 | Газ | Практического значения не имеет |
| Cs | тв | При производстве фотоэлементов и фотоумножителей |
| ICl | тв | Реактив в органическом синтезе |
Задача №5. «Верю – не верю» (25 баллов) – в варианте было по 5 утверждений из перечисленного списка.
Дорогие школьники! Давайте сыграем в игру «верю – не верю». Определите, справедливы ли следующие утверждения:
а) “Во избежание гидролиза продукта чистый карбонат аммония получают при взаимодействии газообразного аммиака с газообразной двуокисью углерода” (из ответа студента на экзамене).
б) «Медь никогда не вытесняет водород из растворов кислот» (из школьного учебника)
в) «Ртуть не растворяется ни в каких кислотах, кроме концентрированной серной и азотной кислот» (из школьного учебника);
г) «Ионы железа окисляют металлическую медь» (из ответа школьника);
д) «При взаимодействии кислоты и соли никогда не может получиться основание» (прописная истина)
е) «В соответствии с рядом активности металлов металлический литий способен восстанавливать ион калия в водном растворе» (из ответа школьника).
Ответ поясните.
Ответ
а) Утверждение неверно (2 балла): в этих условиях образуется карбаминат аммония NH2COONH4. (3 балла)
б) Утверждение неверно (2 балла): например, медь растворяется в горячей концентрированной соляной кислоте с выделение водорода:
2Cu + 4HCl = 2H[CuCl2] + H2
в) Утверждение неверно (2 балла): ртуть, например, растворяется в царской водке (смеси кислот)
3Hg + 2HNO3 + 6HCl = 3HgCl2 + 2NO + 4H2O (3 балла)
г) Утверждение верно (2 балла): ионы Fe3+ окислят металлическую медь
2Fe3+ + Cu = 2Fe2+ + Cu2+ (3 балла)
д) Утверждение неверно (2 балла): например, при взаимодействии нитридов с кислотой образуется аммиак (основание):
Na3N + 3HCl = 3NaCl + NH3 (3 балла)
е) Утверждение неверно (2 балла): во-первых, литий будет реагировать с водой
2Li + 2H2O = 2LiOH + H2
Во-вторых, даже если бы литий вытеснил калий, то последний так же прореагировал бы с водой и «вернулся» в состояние катиона:
2K + 2H2O = 2KOH + H2 (3 балла)