Термодинамический аспект теории активированного комплекса
Константа скорости бимолекулярной реакции можно записать таким образом
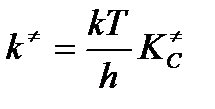
Если реагирующие вещества – идеальные газы, то мы можем перейти к константе равновесия, выраженной через парциальные давления, обобщив реакцию на взаимодействие х частиц так, что изменение числа молей при образовании единичного активированного комплекса 1–х. В таком случае 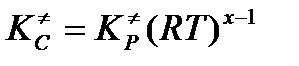 .
.
Из термодинамической теории химических равновесий известно, что 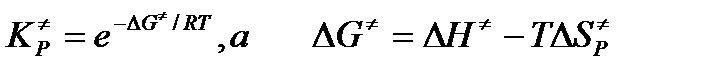
Здесь величины ΔG≠ (изменение энергии Гиббса или т.н. свободной энергии, ΔН≠ изменение энтальпии и ΔS≠P изменение энтропии активации. Индекс Р у энтропии активации означает ее стандартизацию по давлению (1 атм или 1 бар). Напомним, что энтальпия идеального газа не зависит от давления. В таком случае константа скорости в термодинамическом аспекте ТАК определится уравнением
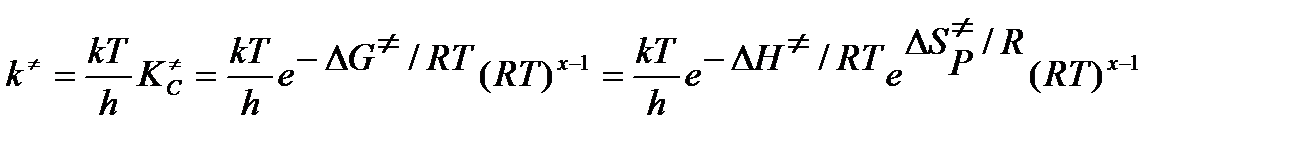
Таким образом, полученное уравнение вносит существенную корректировку в классическое уравнение Аррениуса – скорость химической реакции определяется не энергией активации, а стандартной свободной энергией активации. Полученное уравнение следует преобразовать так, чтобы оно включало опытную величину аррениусовской энергии активации. Для этого примем за основу утверждения, что опытная константа скорости k′ и теоретическая константа скорости k≠идентичны в том смысле, что рассматриваемая элементарная или простая реакция полностью соответствует всем постулатам ТАК. Прологарифмировав уравнение т/д аспекта ТАК и взяв производную по температуре (энтропийный член принимаем не зависящим от температуры) получим
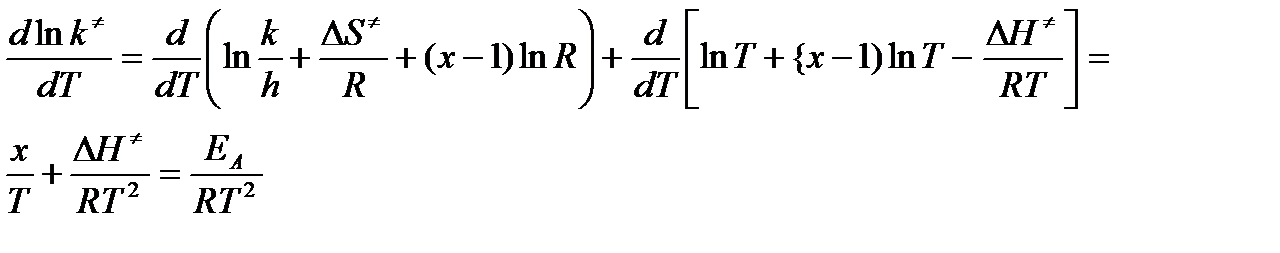
или
ΔH≠ = EA – xRT
Вводя в уравнение для константы скорости аррениусовскую энергию активации, получим
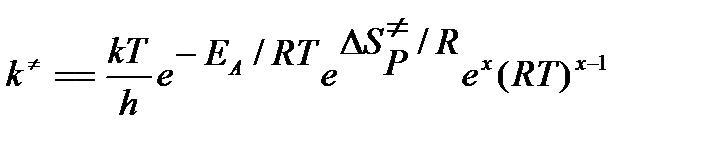
Из термодинамики известно, что энтропия зависит от давления
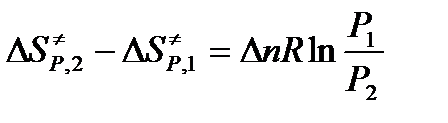 , где Δn изменение числа молей в результате реакции
, где Δn изменение числа молей в результате реакции
Учтем, что Р2 = СRT. Примем Р2 = 1 (например, атм) и С = 1 (например, моль/см3). Тогда Р1 = RT и, окончательно
ΔSP = ΔSC + (1 – x) R ln RT
Выражение для константы скорости можно теперь переписать в виде
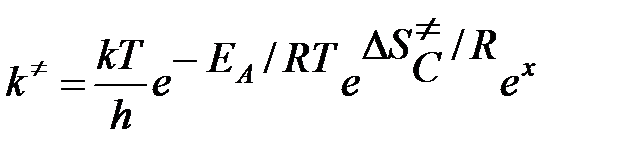
Как определяется размерность констант скорости в т/д аспекте ТАК?.
Трансмиссионный коэффициент
Условие адиабатичности, которое вводится в теории переходного состояния, означает, что переход реагентов в продукты происходит в результате перестройки ядерной конфигурации, но без скачкообразного изменения электронного состояния системы. Такое изменение могло бы быть, в частности, результатом обмена энергией между электронами и ядрами, и именно на этот обмен ТАК налагает определенный, хотя и не абсолютный, запрет; отсюда термин «адиабатичность», заимствованный из термодинамики. Другими словами, условие адиабатичности означает, что реакционная система при своем движении все время остается на одной и той же ППЭ. В то же время, данная ППЭ вовсе не является единственной, и вблизи нее вполне могут находиться другие ППЭ, отвечающие возбужденным состояниям. Так, в реакции СО + О → СО2 происходит изменение спинового состояния, поскольку у атома О спин равен 1, а у молекулы СО2 спин нулевой. Это означает, что исходная и конечная системы описываются разными волновыми функциями, им соответствуют разные ППЭ, и, следовательно, в переходном состоянии неизбежен неадиабатический переход с одной ППЭ на другую. Вероятность переходов такого рода сравнительно невелика и зависит от разницы энергий в точке наибольшего сближения двух ППЭ и от топологических особенностей каждой из них вблизи этой точки, а также скорости движения ядер.
Неадиабатические процессы часто имеют место в случае фотохимических реакций, а также при хемилюминесценции, когда происходит переход системы из основного в электронно- возбужденное состояние за счет внешнего источника энергии.
Для того чтобы учесть возможность неадиабатического перехода, в теории активированного комплекса вводится трансмиссионный коэффициент κ (греческая «каппа»), на который умножается основное уравнение ТАК
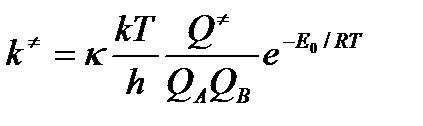
Следует отметить, что, кроме рассмотренной выше существуют и другие причины, по которым в уравнение Эйринга иногда вводится трансмиссионный коэффициент. В частности, если на ППЭ вблизи перевальной точки имеется небольшое углубление, в котором активированный комплекс совершает несколько колебаний и в конце концов находит выход, но не в долину продуктов, а реагентов. Кроме того, при бимолекулярных столкновениях атомов трансмиссионный коэффициент может учитывать необходимость участия в этом элементарном акте третьей частицы, принимающей на себя избыток кинетической энергии сталкивающихся частиц, без чего двухатомная молекула не может образоваться. В то же время в большинстве случаев трансмиссионный коэффициент принимают равным единице.