К оценке стерического множителя в статистическом аспекте теории активированного комплекса.
1. Исходим из того, что все статистические суммы по состояниям, приходящиеся на один и тот же вид движения имеют одну и ту же величину. Т.е. в расчете на одну степень свободы все поступательные суммы qt, вращательные qr, колебательные qv.
2. Оцениваем некую реперную величину, к которой затем относим нашу рассматриваемую систему. Она представляет собой взаимодействие двух атомов (только поступательные составляющие) с образованием 2-х атомного активированного комплекса (одна поступательная и две вращательных составляющих):
А + А →[A-A] ≠
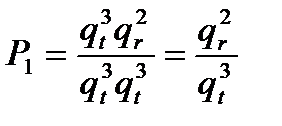
3. Пусть рассматривается ситуация, в которой атом взаимодействует с 2-х атомной молекулой с образованием нелинейного активированного комплекса (три поступательных, три вращательных и две колебательных составляющих сумм; одна колебательная сумма комплекса ушла на поступательную сумму по координате реакции).
A
A + A-B → A B
Тогда:
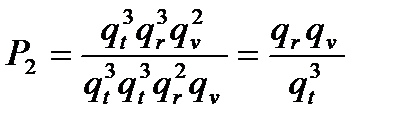
4. Порядок величины стерического множителя оценивается как отношение Р2/Р1 и будет зависеть только от числа атомов в реагирующих молекулах и геометрии исходных молекул и активированного комплекса. В данном случае
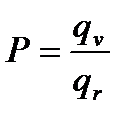
В термодинамическом аспекте ТАК стерический множитель можно оценить по величине
ехр (ΔSC/R)
Задача
Реакцию N2O4 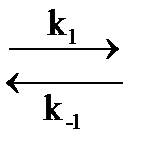 2 NO2 ведут в закрытой системе. Получена зависимость константы скорости прямой реакции от температуры:
2 NO2 ведут в закрытой системе. Получена зависимость константы скорости прямой реакции от температуры:
Т, К 300 310 320 330 340 350
k1×10-6, c-1 3,288 6,652 12,59 23,98 42,95 74,47
Рассчитать стерический множитель для обратной реакции, используя теорию соударений и термодинамический аспект теории активированного комплекса, при температуре 300 К, если известно: константа равновесия указанной реакции при 300 К равна Кр = 0,1618, тепловой эффект DrH 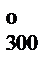 = 57268 Дж/моль, критические параметры для молекул NO2 Ткр = 431 К, Ркр = 99 атм, точность экспериментального определения энергии активации ± 0,5 кДж/моль, k » 1.
= 57268 Дж/моль, критические параметры для молекул NO2 Ткр = 431 К, Ркр = 99 атм, точность экспериментального определения энергии активации ± 0,5 кДж/моль, k » 1.
Решение
Определим энергию активации прямой реакции
| Т, K | ||||||
| 1/Т | 0,00333 | 0,003226 | 0,003125 | 0,00303 | 0,00294 | 0,00286 |
| ln k | 15,0058 | 15,7104 | 16,3484 | 16,9927 | 17,5755 | 18,1259 |
По зависимости lnk от 1/T определяем 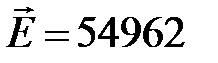 Дж/моль
Дж/моль
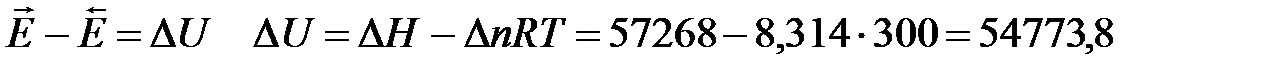 Дж/моль
Дж/моль
 Дж/моль. Величина энергии активации обратной реакции меньше ошибки измерения и ее можно принять равной нулю.
Дж/моль. Величина энергии активации обратной реакции меньше ошибки измерения и ее можно принять равной нулю.
т/д ТАК: 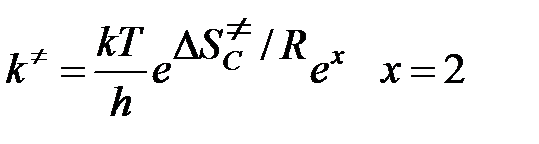
Определим константу скорости обратной реакции:
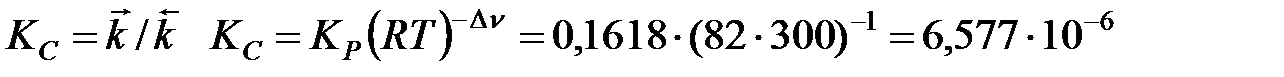 см3/моль
см3/моль
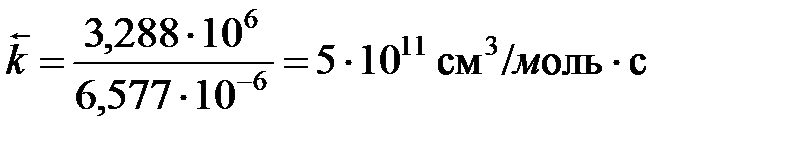
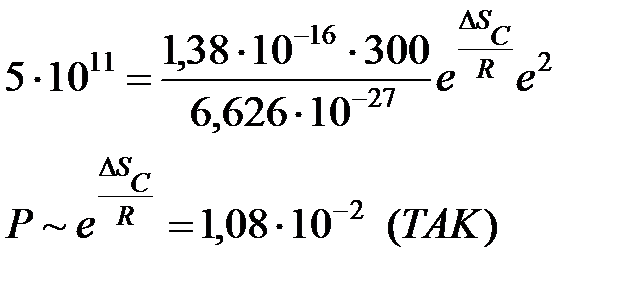
ТАС 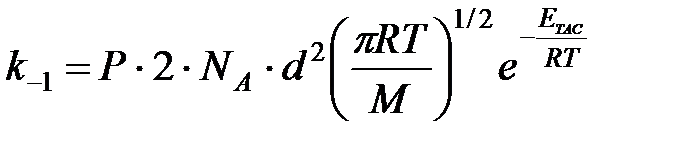
Оценим эффективный диаметр соударений молекул NO2
Из термодинамической части курса для частиц, подчиняющихся уравнению состояния газа Ван-дер-Ваальса, известно:
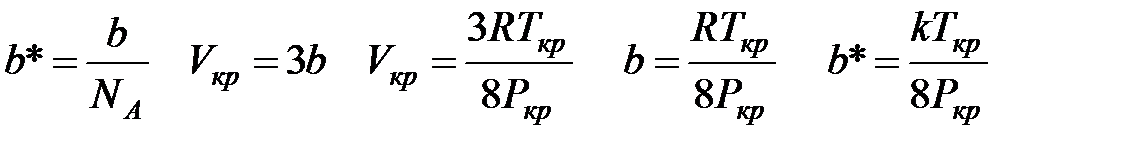
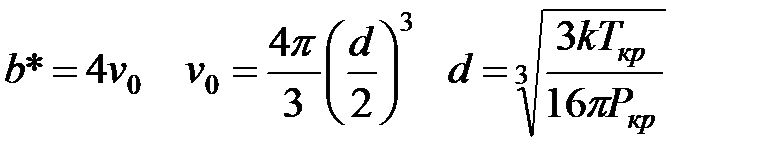
Чтобы получить d в см, подставляем k в эргах, а Р в динах /см2 1 дина = г·см/с2 1 эрг = г·см2/с2
 см
см
ЕТАС = ЕА– 0,5 RT
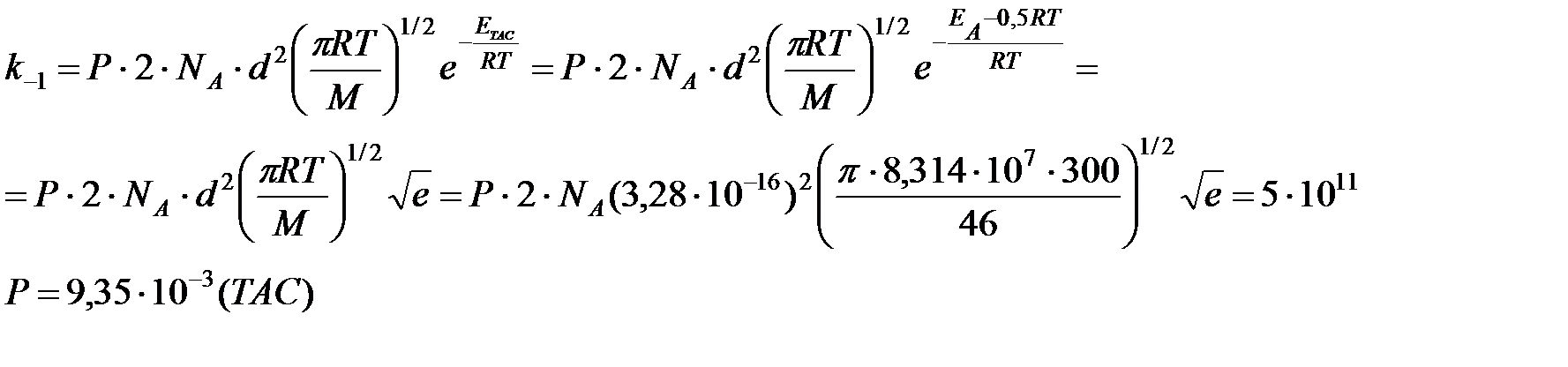
Задача
Для диссоциации димера циклопентадиена в газовой фазе предэкспоненциальный множитель в уравнении Аррениуса равен 1,3×1013 с-1, а энергия активации ЕА = 35 ккал/моль. Вычислить константу скорости при 100оС и энтропию активации, приняв трансмиссионный коэффициент k = 1.
Решение
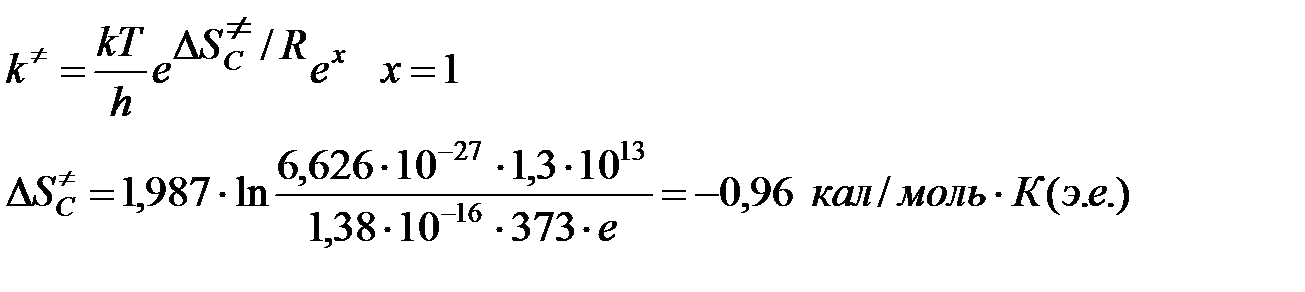
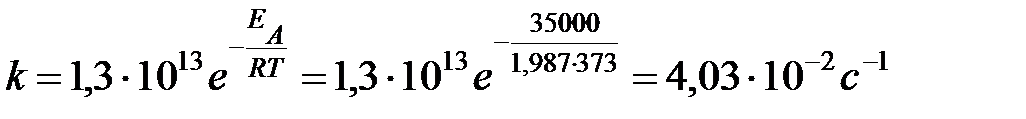
Задача
В газовой фазе вещество A мономолекулярно превращается в вещество B; k = 1,806×10-4 c-1 при 120оС и 9,14×10-4 с-1 при 140оС. Рассчитать среднюю энтропию активации и среднюю теплоту активации в данном температурном интервале. Трансмиссионный коэффициент принять равным 1.
Решение
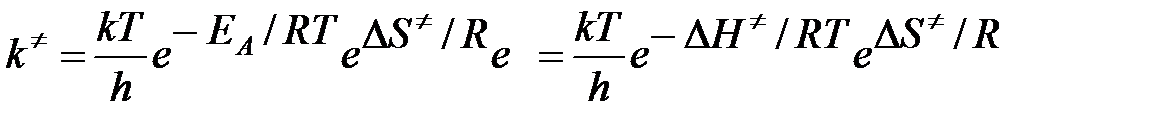
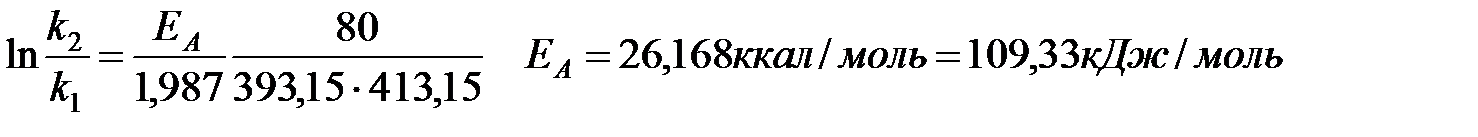
EA = ΔH≠ + RT
Для температур: Т = 393,15 К ΔH≠ = ЕА – 1,987·393,15 = 25,387 ккал/моль
Т = 413,15 К 25,347 ккал/моль
Среднее значение энтальпии активации 25, 367 ккал/моль = 106,03 кДж/моль
Среднее значение энтропии активации ΔS≠= –11,66 э.е. = –48,76 Дж/моль·К
Задача
Зависимость константы скорости разложения винилэтилэфира (С2Н3ОС2Н5) на этилен и ацетальдегид имеет вид:
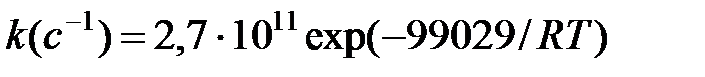 ЕА в Дж/моль
ЕА в Дж/моль
Определить ΔS≠ при 5300С
Решение
Константа скорости при 803 К:
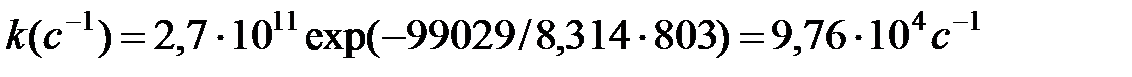
ΔS≠ 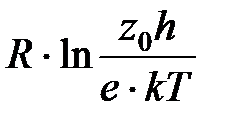 z0 – предэкспоненциальный множитель в уравнении Аррениуса
z0 – предэкспоненциальный множитель в уравнении Аррениуса
ΔS≠ = 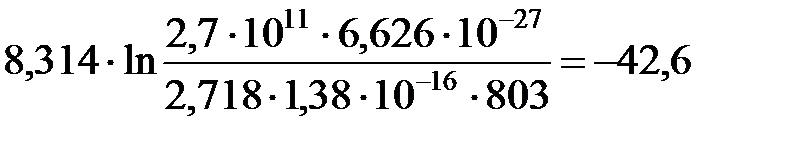 Дж/моль·К
Дж/моль·К
Задача
Реакция H2 + Br идет через образование линейного переходного комплекса с конфигурацией:
H 1,5  ®H 1,42
®H 1,42  ® Br
® Br
Полагая, что эффективный диаметр столкновения равен расстоянию между атомом Br и центром связи H-H в переходном комплексе, рассчитать стерический множитель при Т = 500 К. Молек. масса Br = 80, ro в молекуле Н2 0,74  . Все колебания, кроме дважды вырожденного колебания с w = 460 см-1 переходного комплекса считать замороженными.
. Все колебания, кроме дважды вырожденного колебания с w = 460 см-1 переходного комплекса считать замороженными.
Решение
Br – только поступательная составляющая
Вращательная постоянная для Н2
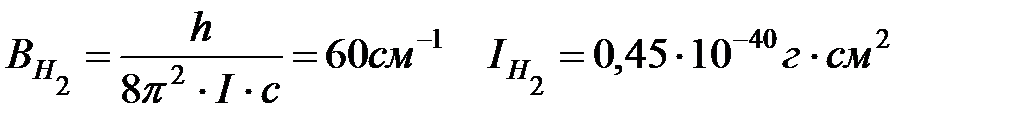
Стерический множитель в данном случае 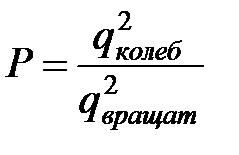
qвращат = 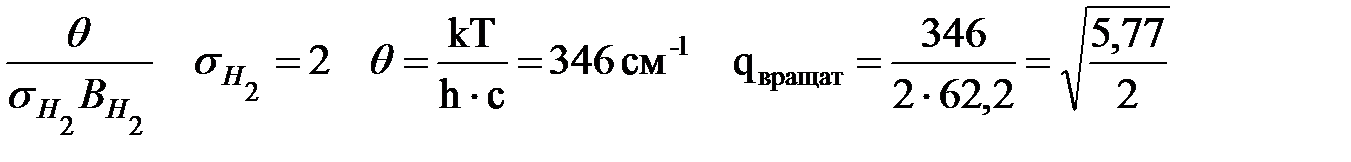
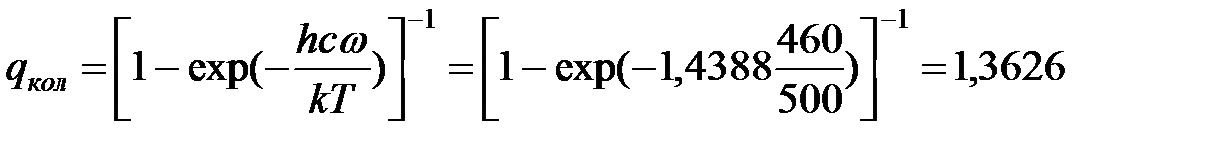
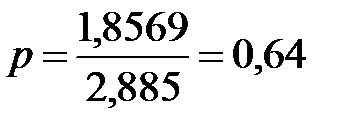
Дом. задание 8
1. Рассчитайте константу скорости и стерический множитель реакции:
N2 + O2 ® 2 NO (1)
при температуре 25оС, если известно, что для реакции N2O + O ® N2 + O2 (2)
lg k (см3/моль×с) = 10,48 - 3168/T, а для реакции 2 NO ® N2 + O2 (3) энергия активации 75,6 ккал/моль. Принять, что реакции (1) и (2) имеют одинаковый активированный комплекс, DfH  (NO) = 91,236 кДж/моль, значения стандартных энтропий S
(NO) = 91,236 кДж/моль, значения стандартных энтропий S 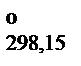 N2O, атома O, O2 и N2 соответственно составляют 219,896; 160,946; 191,498; 205,035 Дж/моль×К. Эффективные диаметры молекул N2 и O2 соответственно равны 3,74
N2O, атома O, O2 и N2 соответственно составляют 219,896; 160,946; 191,498; 205,035 Дж/моль×К. Эффективные диаметры молекул N2 и O2 соответственно равны 3,74 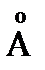 и 3,60
и 3,60 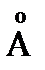 .
.
2. Константа скорости бимолекулярной реакции 2 HJ ® H2 + J2 составляет при 400оС 3,55×10-4 л/моль×с, а при 450оС 3,76×10-3 л/моль×с. Оцените среднее значение энтропии активации для этого температурного интервала, если за стандартное принято состояние идеального газа при Р = 1 атм и трансмиссионный коэффициент равен 1.
3. Аррениусовская энергия активации тримолекулярной реакции атом + двухатомная молекула + двухатомная молекула жесткий нелинейный переходной комплекс продукты составляет 25 кДж/моль при 200 К. При какой температуре кажущаяся энергия активации станет нулевой? Колебания считать замороженными.
4. Начальная скорость бимолекулярной реакции 2 NO2 → 2 NO + O2 при 2000С и давлении 0,101 МПа равна 1,09·105 моль/л·с. Оценить начальную скорость этой реакции при 3000С и давлении 0,103 МПа, если стандартная энтропия активации (Р = 1 атм) в этом интервале –92,6 Дж/моль·К, ӕ = 1.
5. Найдите значения энергии активации в ТАК и аррениусовской ЕА, а также величину энтропии активации мономолекулярного превращения при 400 К:
(СООН)2 → НСООН + СО2, если частота разрываемой связи ν≠ = 9,7·1012 с–1, трансмиссионный коэффициент ӕ = 0,03, период полупревращения τ1/2 = 5,13 ч. Температурной зависимостью колебательной составляющей суммы по состояниям - пренебречь.