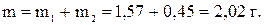Пример 1. Напишите уравнения электродных процессов, протекающих при электролизе водного раствора MgSO4 с инертными электродами.
Решение. Стандартный электродный потенциал системы Mg2+ + 2 e ® Mg равен –2,363 В. Сульфат магния является солью, обра-зованной слабым основанием и сильной кислотой, поэтому вследствие гидролиза среда в его водном растворе будет слабокислотной (рН < 7). Следовательно, потенциал водородного электрода

На катоде будет происходить процесс с наибольшим значением потенциала, т.е. электрохимическое восстановление воды с выделением водорода:
2Н2О + 2 е ® Н2 + 2ОН–,
а ионы Мg2+ будут накапливаться в прикатодном пространстве.
На аноде будет происходить электрохимическое окисление воды, приводящее к выделению кислорода:
2Н2О – 4 е ® О2 + 4Н+,
поскольку отвечающий этой системе электродный потенциал кислородного электрода в слабокислотной среде

значительно меньше, чем стандартный потенциал, характеризующий систему:
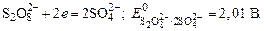
Ионы  будут накапливаться в прианодном пространстве.
будут накапливаться в прианодном пространстве.
Умножая уравнение катодного процесса на 2 для подведения баланса по электронам и складывая его с уравнением анодного процесса, получают суммарное уравнение процесса электролиза:
6Н2О = 2Н2 + 4ОН– + О2 + 4Н+
Принимая во внимание, что одновременно происходит накопление ионов магния в прикатодном пространстве и сульфат-ионов в прианодном пространстве, итоговое уравнение процесса можно записать так:
6 Н2О + 2MgSO4 = 2H2 + 2Mg(OH)2¯ + O2 + 4H+ + 2 
Следует учитывать, что гидроксид магния – малорастворимое соединение.
Пример 2. Написать уравнения процессов, протекающих при электролизе водного раствора, содержащего смесь солей Cu(NO3)2 и ZnBr2. Электроды графитовые.
Решение. На катоде возможно протекание следующих процессов:
Cu2+ + 2 e = Cu  = 0,337 B;
= 0,337 B;
Zn2+ + 2 e = Zn  = –0,763 B;
= –0,763 B;
2H2O + 2 e ® H2 + 2OH–  > –0,413 B (в слабокислотной среде).
> –0,413 B (в слабокислотной среде).
Необходимо учитывать, что выделение водорода протекает со значительным перенапряжением.
Наибольший потенциал у первого процесса, поэтому на катоде будут восстанавливаться ионы меди:
Сu2+ + 2 e = Cu
На аноде возможно протекание следующих процессов:
2Br– – 2 e = Br2, E 0Br2/2Br – = 1,087 B;
2H2O – 4 e = O2 + 4H+  < 0,81 В (в слабокислотной среде).
< 0,81 В (в слабокислотной среде).
Нитрат-ионы в водных растворах на аноде не окисляются. Несмотря на то, что потенциал второго процесса меньше, но из-за значительного перенапряжения выделения кислорода при больших плотностях тока осуществляется окисление бромид-ионов:
2Br– – 2 e = Br2
В прианодном пространстве накапливаются нитрат–ионы.
Суммарное уравнение процесса электролиза можно получить сложением уравнений катодного и анодного процессов:
Сu2+ + 2Br– = Cu + Br2
Принимая во внимание, что одновременно происходит накопление ионов цинка в прикатодном пространстве и нитрат-ионов в прианодном, итоговое уравнение процесса можно записать так:
Сu(NO3)2 + ZnBr2 = Cu + Br2 + Zn2+ + 2 
Пример 3. Какие процессы будут протекать на железных электродах при электролизе водного раствора Al2(SO4)3 в атмосфере воздуха в нейтральной среде?
Решение. Al2(SO4)3 ® 2Al3+ + 3SO42–.
В атмосфере воздуха рН »7.
A(+) Fe, SO42–, H2O Fe2+, Al3+, H2O (–)K
На катоде возможно протекание следующих процессов:
Fe2+ + 2 e = Fe 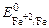 = –0,44 B;
= –0,44 B;
2H2O + 2 e ® H2 + 2OH–  > –0,413 B (в слабокислотной среде);
> –0,413 B (в слабокислотной среде);
Al3+ + 3 e = Al  = –1,662 B.
= –1,662 B.
Вследствие того, что выделение водорода сопровождается перенапряжением, наибольший потенциал становится у первого процесса, поэтому на катоде будут восстанавливаться ионы железа: Fe2+ + 2 e = Fe.
В прикатодном пространстве накапливаются ионы алюминия Al3+.
На железном аноде возможно протекание следующих процессов:
Fe – 2 e = Fe2+ 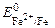 = –0,44 B;
= –0,44 B;

 В;
В;
2H2O – 4 e = O2 + 4H+  < 0,81 В (в слабокислотной среде).
< 0,81 В (в слабокислотной среде).
Вследствие того, что выделение кислорода на железном аноде сопровождается перенапряжением, железный анод будет окисляться в первую очередь.
Пример 4. Определим время, необходимое для получения 150 г металлического натрия при электролизе расплава хлорида натрия, если сила тока 2000 А, а выход по току 55 %. Сколько литров хлора при этом образуется?
Решение. NaCl ó Na+ + Cl–
При электролизе расплава хлорида натрия на электродах протекают процессы
A(+): 2Cl– – 2 e ® Cl2
K(–): Na+ + e ® Na.
Согласно первому закону Фарадея, время, необходимое для получения 150 г металлического натрия, определяем по формуле
 с
с
где M эк.(Na) – молярная масса эквивалента натрия, г/моль; z – число электронов, участвующих в электродном процессе; I – сила тока, А; F – постоянная Фарадея; h – выход по току.
Объем хлора образуется в количестве 1 моль и составляет

Пример 5. Серебрение изделий ведется в растворе азотнокислого электролита с плотностью тока 3 А/дм3. Рассчитать толщину серебряного слоя, образующегося за 2 мин, если выход по току h = 0,90. Плотность серебра r = 10 490 кг/м3.
Решение. Согласно закону Фарадея, масса выделившегося серебра
 .
.
После преобразований находим толщину покрытия


где i = I / S – плотность тока; r – плотность металла.

Пример 6. Определите выход по току водорода, выделенного на электроде при нормальных условиях, если объем его составил 112 л при прохождении через электрод 1000 А×ч.
Решение. Объем моль эквивалента водорода при н.у. составляет 22,4/2 = 11,2 л. Для выделения такого объема водорода требуется количество электричества, равное 1 F, или 26,8 А×ч., следовательно, для выделения 112 л потребуется 268 А×ч. Найдем выход по току водорода:
 или 26,8 %.
или 26,8 %.
Пример 7. При электролизе водного раствора меди сульфата  (графитовые электроды) на аноде выделился кислород О2 объёмом 280 мл при н.у. Сколько г меди и какой объем кислорода выделилось на электродах
(графитовые электроды) на аноде выделился кислород О2 объёмом 280 мл при н.у. Сколько г меди и какой объем кислорода выделилось на электродах
Решение задачи следует начинать с описания объекта изучения – электрохимических реакций. До электролиза в растворе прошли реакции:
а) диссоциация 
б) гидролиз 
Электрохимическая система: (-) К С  .
.
Процессы на катоде (–) и на аноде (+) А при электролизе:


Определим массу кислорода  , выделившегося на аноде.
, выделившегося на аноде.
Молярная масса эквивалентов кислорода  (О2) = 8 г/моль. Для определения эквивалентного объёма V
(О2) = 8 г/моль. Для определения эквивалентного объёма V 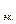 составим пропорцию:
составим пропорцию:
5,6 л 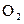 весит 8 – 0,28 л О2 весит х г,
весит 8 – 0,28 л О2 весит х г,
х = 
На аноде выделилось 0,28/5,6 = 0,05 моль эквивалентов О2.
Вычислим массу меди  , выделившейся на катоде. Молярная масса эквивалентов меди:
, выделившейся на катоде. Молярная масса эквивалентов меди:

Согласно второму закону Фарадея:

Пример 8. Через щелочной раствор, содержащий комплексные ионы двух- и четырехвалентного олова,  и
и  пропустили ток I = 2А в течение часа. Определить массу выделившегося на катоде олова, если выход по току
пропустили ток I = 2А в течение часа. Определить массу выделившегося на катоде олова, если выход по току  Анод оловянный
Анод оловянный
Решение. Процессы диссоциации комплексных ионов в растворе:
 ;
;  .
.
Электрохимическая система: (–) К: Sn  A (+)
A (+)
Примем, что электроосаждение происходит из ионов Sn4+ и Sn2+:
(–) К:  ;
; 


 ;
; 
“Sn” (+) A: Sn 
Масса олова 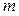 , осаждённого из ионов
, осаждённого из ионов 


Масса олова 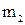 , осаждённого из ионов
, осаждённого из ионов 


Общая масса выделившегося на катоде олова m: