Практическая работа № 8
Решение задач по теме «Основы МКТ»
Цель работы:
- Повторить основные термины и формулы раздела «Основы МКТ
- Сформировать умение применять формулы при решении задач.
- Развивать логическое мышление, память, внимание; умение рассуждать и выделять главное.
- Развивать навыки самоконтроля и взаимоконтроля.
Теоретические сведения.
В газе молекулы удалены на большие расстояния друг от друга, поэтому силы взаимодействия между молекулами очень малы. Это позволяет построить модель идеального газа молекулы которого можно считать материальными точками. Взаимодействие между молекулами полностью отсутствует, а соударения между молекулами и стенками сосуда происходят по законам упругого удара. Расчет показывает, что давление идеального газа равно:
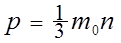
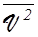 ,
,
где m0 - масса молекулы, n - концентрация молекул,  - средняя квадратичная скорость движения молекул:
- средняя квадратичная скорость движения молекул:
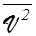 =
=  , где N - число молекул.
, где N - число молекул.
Вводят понятие средней кинетической энергии поступательного движения молекул: 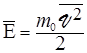 , тогда основное уравнение МКТ можно переписать в виде:
, тогда основное уравнение МКТ можно переписать в виде:
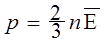 .
.
Давление идеального газа прямо пропорционально концентрации молекул и их средней кинетической энергии. Основное уравнение можно преобразовать к виду:  ;
; 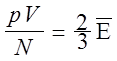 .
.
Экспериментально установлено, что для любых идеальных газов после установления теплового равновесия 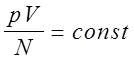 . При изменении температуры отношение
. При изменении температуры отношение  меняется у этих газов одинаковым образом, поэтому величина
меняется у этих газов одинаковым образом, поэтому величина 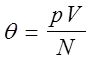 является энергетической мерой температуры газа. Поскольку температуру принято измерять в градусах, то для измерения температуры пользуются величиной пропорциональной
является энергетической мерой температуры газа. Поскольку температуру принято измерять в градусах, то для измерения температуры пользуются величиной пропорциональной 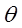 , а именно,
, а именно,  , где
, где 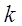 - постоянная Больцмана
- постоянная Больцмана 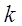 = 1,38×10-23 Дж/К, Т - абсолютная температура или температура в градусах Кельвина. В этой шкале температур градус равен температурному градусу Цельсия, а начало отсчета смещено на
= 1,38×10-23 Дж/К, Т - абсолютная температура или температура в градусах Кельвина. В этой шкале температур градус равен температурному градусу Цельсия, а начало отсчета смещено на
-273о относительно 0о Цельсия, поэтому Т = 273 + t o C.
В шкале Кельвина получим  , откуда
, откуда 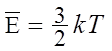 , т.е. кинетическая энергия молекул идеального газа прямо пропорциональна абсолютной температуре идеального газа; абсолютная температура является мерой средней кинетической энергии.
, т.е. кинетическая энергия молекул идеального газа прямо пропорциональна абсолютной температуре идеального газа; абсолютная температура является мерой средней кинетической энергии.
Основное уравнение МКТ можно представить в следующем виде:
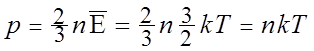 ,
, 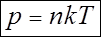 .
.
Примеры решения задач.
Задача 1. Какое давление на стенки сосуда производит кислород, если V =400m/c, n =2,7*1019m-3
| Дано: | Решение: |
| O2 Mмол=16*2*10-3кг/моль Мг=32 V=400m/c N=2,7*1019m-3 __________________ Опр: р-? | p = 1/3 *mo*n*v2, m0=m/NA, M =MЧ*10-3 m 0= MЧ*10-3/ NA p = 1|3 * MX*10-3 |NA*v2& p = 1/3 *2,7*1019m-3 *32*10-3кг/моль/6,02*1023 моль-1* (400м/с)2 =72000Па Ответ:72 кпа |
Задача 2. Найдите среднюю кинетическую энергию поступательного движения молекул гелия, если при давлении 0,5*105Па их концентрация n=1,5*109m-3
| Дано: | Решение: |
| He Mч=4 Ммол=4*10-3кг/моль Р=0,5*105Па n= 1,5*109м-3 Опр: Е-? | p = 2/3 n *Е Е=3р/2 n Е=3*0,5*105Па/2*1,5*109м-3 = Е= 5*10-21дш Ответ: 5*10-21дш |
Задача 3. Рассчитайте давление, которое производят молекулы газа на стенки сосуда, если масса газа составляет 3 г, объем равен 5·10-3 м3, а средняя квадратичная скорость молекул – 500 м/с.


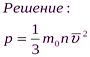

 p n
p n 
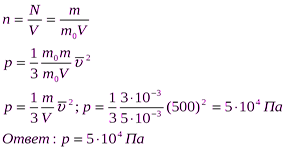
Практические задания.
1. Каково давление азота, если средняя квадратичная скорость его молекул 500 м/с, а его плотность 1,35 кг/м3?
2. Найти концентрацию молекул кислорода, если его давление 0,2 МПа, а средняя квадратичная скорость молекул равна 700 м/c.
3. Вычислить среднюю квадратичную скорость атомов гелия при температуре 27оС.
4. Определить концентрацию молекул идеального газа при нормальном давлении и температуре t=23оС. Сколько таких молекул будет содержаться в колбе емкостью V= 200 мл?
5. Найти среднюю кинетическую энергию молекулы одноатомного газа при давлении 20 кПа. Концентрация молекул этого газа при указанном давлении составляет 3 
Практическая работа № 9
Решение задач по теме «Основы термодинамики»
Цель работы:
- Повторить основные термины и формулы раздела «Основы термодинамики».
- Сформировать умение применять формулы при решении задач.
- Развивать логическое мышление, память, внимание; умение рассуждать и выделять главное.
- Развивать навыки самоконтроля и взаимоконтроля.
Теоретические сведения.
Внутренняя энергия одного моля одноатомного идеального газа:
 .
.
Изменение внутренней энергии идеального одноатомного газа:
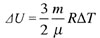 .
.
Работа газа: A = p 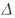 V.
V.

| Работа А численно равна площади под графиком зависимости давления от объема. |
Первый закон термодинамики:
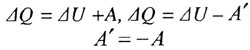 ,
,
А - работа, совершаемая системой над внешними телами; А' - работа совершаемая внешними телами над системой.
I закон термодинамики, адиабатный процесс: 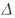 U = - A.
U = - A.
Адиабатным называется процесс, происходящий без теплообмена с окружающей средой (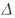 Q = 0).
Q = 0).
I закон термодинамики, изохорный процесс:
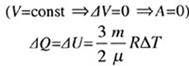 .
.
I закон термодинамики, изотермический процесс:
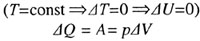 .
.
I закон термодинамики, изобарный процесс (p = const):
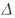 Q =
Q = 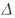 U +
U + 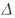 U + p
U + p 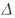 V.
V.
Второй закон термодинамики:
невозможен процесс, при котором теплота переходила бы произвольно от тел более холодных к более нагретым:
При адиабатном процессе система может выполнять работу над внешними телами (расширение газа) только за счет своей внутренней энергии.
Если при адиабатном процессе внешние тела совершают работу над системой, то ее внутренняя энергия увеличивается.
КПД теплового двигателя: 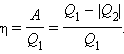
КПД идеальной тепловой машины, работающей по циклу Карно: 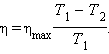
Практические задания.
| Вариант 1 | Вариант 2 |
| 1. Какова внутренняя энергия водорода, заполняющего сосуд объемом 160 м3 при давлении 100кПа? | 1. Насколько изменится внутренняя энергия 15 моль одноатомного газа при увеличении температуры на 50 0с? |
| 2. Какую работу совершил воздух массой 580 г при его изобарном нагревании на 40 К? | 2. Какое количество теплоты сообщили воздуху массой 200 г при его изобарном нагревании на 20 К? |
| 3. Температура нагревателя идеальной тепловой машины 217 0с, а холодильника 17 0с. Количество теплоты получаемое за 1 с, равно 80 кДж. Вычислите КПД машины и количество теплоты, отдаваемое холодильнику за 1 с. | 3. В идеальной тепловой машине за счет каждого килоджоуля энергии, получаемой от нагревателя, совершается работа 600 ДЖ. Определите КПД машины и температуру нагревателя, если температура холодильника 17 0с. |