Факторы, влияющие на скорость реакций
| Факторы | Характер влияния | Пример |
| Природа реагирующих веществ | Металлы с кислотами взаимодейст-вуют по-разному: чем левее металл по отношению к водороду (в элект-рохимическом ряду напряжений), тем выше скорость. | Mg + 2HCl ® MgCl2 + H2↑
урно выделяется газ
2Fe + 6HCl ® 2FeCl3+3H2↑
реакция почти незаметна
 Cu + 2HCl ® не идет Cu + 2HCl ® не идет
|
| Концентрация реагирующих веществ | При постоянной температуре ско-рость химической реакции прямо пропорциональна произведению молярных концентраций реагирую-щих веществ (закон действующих масс): v = k [A] m · [B]n | Для гомогенных систем: 3H2 + N2 = 2NH3 v = k [H2]3 · [N2] Для гетерогенных систем: 4P + 5O2 = 2P2O5 скорость горения фосфора пропорциональ-на только концентрации кислорода: v = k [О2]5. |
| Поверхность взаимодействия реагирующих веществ | В пробирке с измельченным мелом идет более бурное выделение газа, чем в пробирке с крупными кусками мела. | СaCO3 + 2HCl = CaCl2 + H2O + CO2↑ |
| Присутствие катализаторов и ингибиторов | Вещества, увеличивающие скоро-сть реакции, но сами в результате нее не расходующиеся, называют катализаторами. Скорость гетеро-генного катализа зависит от степе-ни измельчения катализатора. Важно, чтобы катализатор обладал адсорбциионными способностями. Вещества, замедляющие скорость реакции, называют ингибиторами. | Различают гомогенный (в однородной среде) и гетерогенный катализ (на границе раздела фаз) Гомогенный катализ: H2SO4 C3H7COOH + CH3OHDC3H7COOCH3+H2O Гетерогенный катализ: V2O5 2SO2 + O2 D 2SO3 + Q |
| Температура | При повышении температуры на каждые 10º С скорость реакции увеличивается в 2-4 раза (правило Вант-Гоффа). Это правило математически выразиться так:
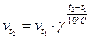
| где 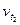 - скорость реакции после повышения температуры до t2; - скорость реакции после повышения температуры до t2; 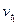 - начальная скорость реакции при температуре t1; γ – температурный коэффициент реакции, т.е. число показывающее, во сколько раз увеличивается скорость реакции при повышении температуры реагирующих веществ на 10˚ С. - начальная скорость реакции при температуре t1; γ – температурный коэффициент реакции, т.е. число показывающее, во сколько раз увеличивается скорость реакции при повышении температуры реагирующих веществ на 10˚ С.
|
Решение задач
Образец 1:
Химическая реакция протекает в растворе, согласно уравнению: А + В = С. Исходные концентрации: вещества А - 0,80 моль/л, вещества В - 1,00 моль/л. Через 20 мин концентрация вещества А снизилась до 0,74 моль/л. Определите: а) среднюю скорость реакции за этот промежуток времени; б) концентрацию вещества В через 20 мин.
| Дано: С (А1) = 0,80 моль/л С (В1) = 1,00 моль/л С (А2) = 0,74 моль/л Δ t = 20 мин=1200 с |
| Найти: а) υгомоген -? б) С (В2) -? |
Решение:
а) определение средней скорости реакции в растворе производится по формуле:
υгомоген = 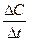 =
= 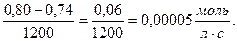
б) определение количеств реагирующих веществ:
А + В = С
По уравнению 1 моль 1 моль
По условию 0,06 моль 0,06 моль
Следовательно, С (В2) = С (В1) – ΔС = 1,00 – 0,06 = 0,94 моль/л
Ответ: υгомоген = 5٠10-5 моль/л٠с, С (В2) = 0,94 моль/л
Образец 2.
Как изменится скорость некоторой реакции при повышении температуры от 10 до 50 °С, если
температурный коэффициент равен З?
| Дано: t1 = 10 °C t2 = 50 °C |
Найти: 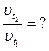 раз раз
|
Решение:
По правилу Вант-Гоффа:
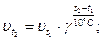
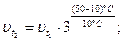
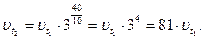
Ответ: скорость реакции увеличится в 81 раз.
Задания
Вариант 1.
1. Составьте формулу для расчета скоростей следующих реакций: 4P + O2 = 2P2O5; 2H2+O2= 2H2O
2. Химическая реакция протекает в растворе, согласно уравнению: А + В = С. Исходные концен-трации: вещества А - 0,78 моль/л, вещества В - 1,20 моль/л. Через 30 мин концентрация вещества А снизилась до 0,72 моль/л. Определите: а) среднюю скорость реакции за этот промежуток време-ни; б) концентрацию вещества В через 30 мин.
3. Во сколько раз возрастет скорость реакции, если температура увеличится на 60 °С? Температурный коэффициент равен 2.
Вариант 2.
1. Составьте формулу для расчета скоростей следующих реакций: 4NH3 + 5O2 = 4NO + 6H2O;
Fe2O3 + 3H2 = 2Fe + 3H2O.
2. Химическая реакция протекает в растворе, согласно уравнению: А + В = С. Исходные концен-трации: вещества А - 2,7 моль/л, вещества В - 2,5 моль/л. Через 30 мин концентрация вещества В снизилась до 2,2 моль/л. Определите: а) среднюю скорость реакции за этот промежуток времени; б) концентрацию вещества А через 30 мин.
3. Во сколько раз возрастет скорость реакции, если температура увеличится с 10 до 60 °С? Температурный коэффициент равен 4.
Вариант 3.
1. Во сколько раз следует увеличить концентрацию вещества В2 в системе 2А2 + В2 → 2А2В, чтобы при уменьшении концентрации вещества А в 4 раза скорость реакции не изменилась?
2. В реакции 2NO+Cl2D2NOCl, концентрации NOи Cl2 составляли 0,4 и 0,3моль/л соответственно. Через 40 мин концентрация NO стала 0,2 моль/л. Определите: а) среднюю скорость реакции за этот промежуток времени; б) концентрацию вещества Сl2 через 40 мин.
3. Две реакции протекают при 20°С с одинаковой скоростью. Температурный коэффициент ско-рости первой реакции 2, а второй – 4. Чему равно отношение скоростей этих реакций при 70°С?
Критерии оценки: оценка «3» - задание № 1; оценка«4» - № 1 и № 2; оценка «5» - № 1, 2, 3.
Урок № Скорость химических реакций
(Билет № 6, вопрос 1).
Цели: знать факторы, влияющие на скорость реакции; находить скорость реакции с исполь-зованием закона действующих масс и правила Вант-Гоффа.
Реакции, протекающие в однородной среде, называются гомогенными (смесь газов, раствор, расплав). Скорость гомогенной реакции может быть определена количеством вещества, образующимся или расходующимся в единицу времени в единице объема. Математическое выражение: 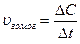

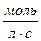
Реакции, протекающие в неоднородной среде, называются гетерогенными (вода со льдом, раствор с осадком). Скорость гетерогенной реакции может быть определена количеством вещества, образующимся или расходующимся в единицу времени на единице поверхности раздела реагирующих веществ.
Математическое выражение: 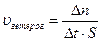
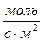
Скорость реакции определяется числом активных столкновений между молекулами реагирующих веществ.
Факторы, влияющие на скорость реакций
| Факторы | Характер влияния | Пример |
| Природа реагирующих веществ | Металлы с кислотами взаимо-действуют по-разному: чем левее металл по отношению к водороду (в электрохимическом ряду напряжений), тем выше скорость. | Mg + 2HCl ® MgCl2 + H2↑
бурно выделяется газ
2Fe + 6HCl ® 2FeCl3+3H2↑
реакция почти незаметна
 Cu + 2HCl ® не идет Cu + 2HCl ® не идет
|
| Концентрация реагирующих веществ | При постоянной температуре ско-рость химической реакции прямо пропорциональна произведению молярных концентраций реаги-рующих веществ (закон дейст-вующих масс): v = k [A] m · [B]n | Для гомогенных систем: 3H2 + N2 = 2NH3 v = k [H2]3 · [N2] Для гетерогенных систем 4P + 5O2 = 2P2O5 скорость горения фосфора пропорцио-нальна только концентрации кислорода: v = k [О2]5. |
| Поверхность взаимодействия реагирующих веществ | В пробирке с измельченным ме-лом идет более бурное выделение газа, чем в пробирке с крупными кусками мела. | СaCO3 + 2HCl = CaCl2 + H2O + CO2↑ |
| Присутствие катализаторов и ингибиторов | Вещества, увеличивающие ско-рость реакции, но сами в резуль-тате нее не расходующиеся, назы-вают катализаторами. Скорость гетерогенного катализа зависит от степени измельчения катализато-ра. Важно, чтобы катализатор об-ладал адсорбциионными способ-ностями. Вещества, замедляющие скорость реакции, называют инги-биторами. | Различают гомогенный (в однородной среде) и гетерогенный катализ (на границе раздела фаз) Гомогенный катализ: H2SO4 C3H7COOH + CH3OHDC3H7COOCH3+H2O Гетерогенный катализ: V2O5 2SO2 + O2 D 2SO3 + Q |
| Температура | При повышении температуры на каждые 10º С скорость реакции увеличивается в 2-4 раза (правило Вант-Гоффа). Это правило математически выразиться так:
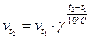
| где 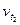 - скорость реакции после повышения температуры до t2; - скорость реакции после повышения температуры до t2; 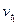 - начальная скорость реакции при температуре t1; γ – температурный коэффициент реакции, т.е. число показывающее, во сколько раз увеличивается скорость реакции при повышении температуры реагирующих веществ на 10˚ С. - начальная скорость реакции при температуре t1; γ – температурный коэффициент реакции, т.е. число показывающее, во сколько раз увеличивается скорость реакции при повышении температуры реагирующих веществ на 10˚ С.
|
Решение задач
Образец 1:
Химическая реакция протекает в растворе, согласно уравнению: А + В = С. Исходные концентрации: вещества А - 0,80 моль/л, вещества В - 1,00 моль/л. Через 20 мин концентрация вещества А снизилась до 0,74 моль/л. Определите: а) среднюю скорость реакции за этот промежуток времени; б) концентрацию вещества В через 20 мин.
| Дано: С (А1) = 0,80 моль/л С (В1) = 1,00 моль/л С (А2) = 0,74 моль/л Δ t = 20 мин=1200 с |
| Найти: а) υгомоген -? б) С (В2) -? |
Решение:
а) определение средней скорости реакции в растворе производится по формуле:
υгомоген = 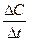 =
= 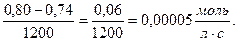
б) определение количеств реагирующих веществ:
А + В = С
По уравнению 1 моль 1 моль
По условию 0,06 моль 0,06 моль
Следовательно, С (В2) = С (В1) – ΔС = 1,00 – 0,06 = 0,94 моль/л
Ответ: υгомоген = 5٠10-5 моль/л٠с, С (В2) = 0,94 моль/л
Образец 2.
Как изменится скорость некоторой реакции при повышении температуры от 10 до 50 °С, если
температурный коэффициент равен З?
| Дано: t1 = 10 °C t2 = 50 °C |
Найти: 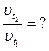 раз раз
|
Решение:
По правилу Вант-Гоффа:
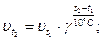
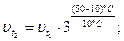
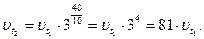
Ответ: скорость реакции увеличится в 81 раз.
Задания
Вариант 1.
1. Составьте формулу для расчета скоростей следующих реакций: 4P + O2 = 2P2O5; 2H2+O2= 2H2O
2. Химическая реакция протекает в растворе, согласно уравнению: А + В = С. Исходные концен-трации: вещества А - 0,78 моль/л, вещества В - 1,20 моль/л. Через 30 мин концентрация вещества А снизилась до 0,72 моль/л. Определите: а) среднюю скорость реакции за этот промежуток време-ни; б) концентрацию вещества В через 30 мин.
3. Во сколько раз возрастет скорость реакции, если температура увеличится на 60 °С? Температурный коэффициент равен 2.
Вариант 2.
1. Составьте формулу для расчета скоростей следующих реакций: 4NH3 + 5O2 = 4NO + 6H2O;
Fe2O3 + 3H2 = 2Fe + 3H2O.
2. Химическая реакция протекает в растворе, согласно уравнению: А + В = С. Исходные концен-трации: вещества А - 2,7 моль/л, вещества В - 2,5 моль/л. Через 30 мин концентрация вещества В снизилась до 2,2 моль/л. Определите: а) среднюю скорость реакции за этот промежуток времени; б) концентрацию вещества А через 30 мин.
3. Во сколько раз возрастет скорость реакции, если температура увеличится с 10 до 60 °С? Температурный коэффициент равен 4.
Критерии оценки: оценка «3» - задание № 1; оценка«4» - № 1 и № 2; оценка «5» - № 1, 2, 3.
Вариант 3.
1. Во сколько раз следует увеличить концентрацию вещества В2 в системе 2А2 + В2 → 2А2В, чтобы при уменьшении концентрации вещества А в 4 раза скорость реакции не изменилась?
2. В реакции 2NO+Cl2D2NOCl, концентрации NOи Cl2 составляли 0,4 и 0,3моль/л соответственно. Через 40 мин концентрация NO стала 0,2 моль/л. Определите: а) среднюю скорость реакции за этот промежуток времени; б) концентрацию вещества Сl2 через 40 мин.
3. Две реакции протекают при 20°С с одинаковой скоростью. Температурный коэффициент ско-рости первой реакции 2, а второй – 4. Чему равно отношение скоростей этих реакций при 70°С?
Критерии оценки: оценка «3» - задание № 1; оценка«4» - № 1 и № 2; оценка «5» - № 1, 2, 3.