Результаты пригодности воды для питьевых и рыбохозяйственных нужд приведены в таблице 8.
Сравнивая результаты гидрохимического анализа природной воды со значениями ПДК, видно, что пробы воды не пригодны для питьевых нужд, так как не соответствуют по показателям свинца (превышение значения ПДК для питьевых нужд в 1,7 раза), фтора (превышение значения ПДК для питьевых нужд в 3 раза), марганца (превышение значения ПДК для питьевых нужд в 2 раза), и не пригодны для рыбохозяйственных целей, так как показатели анионов SO42- и F-, тяжелых металлов – железа, свинца, цинка, меди превышают значения ПДК: показатель SO42- - в 2,07 раза, показатель F- – в 30 раз, показатель Pb2+ – в 5 раз, показатель Fe – в 20 раз, показатель Zn2+ – в 20 раз, показатель K+ – в 2 раза, показатель Cu2+ – в 85,75 раз.
Таким образом, делаем вывод, что происходит фторирование и загрязнение природной воды тяжелыми металлами.
3 Оценка агрессивности подземных вод
3.1 Методика оценки агрессивности подземных вод
Агрессивность воды связана с присутствием в ней ионов водорода, свободного диоксида углерода, сульфатов и магния. Агрессивные свойства воды проявляются по отношению к бетону и металлам.
Агрессивность воды по отношению к бетону выражается в разрушительном воздействии подземных вод определенного состава на бетонные сооружения. Оценка качества воды по отношению к бетону производится по нормам и техническим условиям Н 114-54 «Бетон гидротехнический. Признаки и нормы агрессивности воды-среды». Эти нормы учитывают воздействие на бетон следующих видов агрессивности: выщелачивающую, углекислую, общекислотную, сульфатную и магнезиальную.
1 Выщелачивающая агрессивность связана с выщелачиванием карбонатов, главным образом кальция.
Если вода, контактирующая с бетоном, содержит низкие концентрации Са2+, а также НС03- и СО32-, то карбонат кальция бетона переходит в раствор. В зависимости от типа цемента в составе бетона вода считается агрессивной при карбонатной жесткости, меньшей 0,54—2,14 мг-экв/дм3.
2 Углекислая агрессивность обусловлена высокими концентрациями растворенной в воде углекислоты СО2.
Эта агрессивность проявляется как в отношении металла (коррозия), так и бетона. Разрушение бетона, как и при выщелачивающей агрессивности, сводится к растворению карбоната кальция. Воды, обладающие карбонатной жесткостью менее 1,4 мг-экв/дм3, следует считать агрессивными, независимо от всех других показателей.
3 Общекислотная агрессивность воды связана с повышенной концентрацией иона водорода (пониженная величина рН).
При этом бетон разрушается из-за растворения в кислой среде защитной карбонатной корки. Вода считается агрессивной для всех типов цементов: при рН < 7, если карбонатная жесткость меньше 8,6 мг-экв/дм3; при рН < 6,7, если карбонатная жесткость больше 8,6 мг-экв/дм3 (в пластах высокой проводимости). Для слабопроницаемых пластов вода считается агрессивной при рН < 5.
4Сульфатная агрессивность обусловлена присутствием в воде иона SO42-.
По сульфатной агрессии для обычных цементов воду относят к слабоагрессивной при содержании иона SO42- от 250 до 800 мг/дм3 и к агрессивной при содержании более 800 мг/дм3. В породах высокой проводимости для бетона на портландцементе вода считается агрессивной при следующих попарных содержаниях ионов (в мг/дм3):
Таблица 10 - Сульфатная агрессивность
| С1- | 0—3000 | 3001—5000 | |
| SO42- | 250—500 | 501—1000 |
В породах слабой водопроводимости вода считается агрессивной при содержании иона SO42> 1000 мг/дм3, а для бетонов на пуццолановом, шлаковом и песчано-пуццолановом портландцементе - при содержании иона SO42- > 4000 мг/дм3 независимо от содержания С1-.
5 Магнезиальная агрессивность вызывает разрушение и вспучивание бетонных конструкций под воздействием Mg2+.
Для портландцемента, находящегося в сильно проницаемых породах, вода считается агрессивной при содержании иона Mg2+ > 5000 мг/дм3, для других видов цемента — при содержании ионов Mg2+ и SO42-, превышающем следующие попарные соединения ионов (в мг/дм3):
Таблица 11 - Магнезиальная агрессивность
| SO42- | 0—1000 | 1001—2000 | 2001—3000 | 3001—4000 |
| Mg2+ | 3001—5000 | 2001—3000 | 1000—2000 |
Агрессивность воды по отношению к металлу связана с корродирующей способностью вод. Агрессивными по отношению к металлу являются воды: углекислые; сероводородные кислые; обогащенные кислородом. Корродирующая способность воды может быть определена при помощи коэффициента коррозии:
— для вод с кислой реакцией
Кк = rH+ + rAl3+ + rFe2+ + rMg2+ - rCO32- - rHC03-;
— для щелочных вод
Кк = rMg2+ - гНС03-.
По величине коэффициента коррозии различают следующие группы вод (содержание Са2+ в мг/дм3):
— коррозирующие, Кк > 0;
— полукоррозирующие, Кк < 0, но Кк + 0,05 Са2+ > 0;
— некоррозирующие, Кк + 0,05 Са2+ < 0.
3.2 Расчет и оценка агрессивности подземных вод
Оценка качества воды по отношению к бетону производится по нормам и техническим условиям Н 114-54 «Бетон гидротехнический. Признаки и нормы агрессивности воды-среды».
1 Выщелачивающая агрессивность
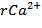 = 5,2894 мг-экв/дм3
= 5,2894 мг-экв/дм3
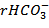 = 2,1528 мг-экв/дм3
= 2,1528 мг-экв/дм3
Вода является агрессивной по отношению к бетону, при карбонатной жесткости меньше 0,54-2,14 мг-экв/ дм3, следовательно, вода неагрессивная;
2 Углекислая агрессивность
Исследуемая вода имеет карбонатную жесткость более 1,4 мг-экв/ дм3, следовательно, в ней не проявляется агрессивность в отношении металла (коррозия) и бетона.
3 Общекислотная агрессивность
Показатели исследуемой воды:
pH = 5,7
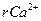 = 5,2894 мг-экв/дм3
= 5,2894 мг-экв/дм3
 = 2,1528 мг-экв/дм3
= 2,1528 мг-экв/дм3
Можно сделать вывод, что вода агрессивная для всех видов цементов.
4 Сульфатная агрессивность
 = 207 мг/ дм3, вода является неагрессивной, т.к. содержание иона
= 207 мг/ дм3, вода является неагрессивной, т.к. содержание иона  меньше 250 мг/ дм3.
меньше 250 мг/ дм3.
5 Магнезиальная агрессивность
 = 25 мг/ дм3, вода является неагрессивной, т.к. содержание ионов
= 25 мг/ дм3, вода является неагрессивной, т.к. содержание ионов  меньше 5000 мг/ дм3.
меньше 5000 мг/ дм3.
Корродирующая способность воды:
Для кислотных вод вычисляется по формуле:
Кк = rH+ + rAl3+ + rFe2+ + rMg2+ - rCO32- - rHC03-;
r  = 2,0550 мг-экв/ дм3
= 2,0550 мг-экв/ дм3
 = 2,1528 мг-экв/ дм3
= 2,1528 мг-экв/ дм3
rFe2+ =0,0358 мг-экв/ дм3
Коэффициент коррозии:
Кк = rFe2+ + rMg2+ - rHC03- =0,0358+2,0550 – 2,1528= - 0,062
 = - 0,062+0,05*106 = 5,238
= - 0,062+0,05*106 = 5,238
Т.к.  >0, следовательно, исследуемая вода относится к полукоррозирующей группе вод.
>0, следовательно, исследуемая вода относится к полукоррозирующей группе вод.
Исследование пробы по формуле Курлова (в %-экв)
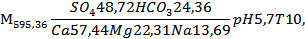
где М – минерализация воды в мг/дм3.
Исходя из полученных данных, можно сделать вывод, что данная вода пресная, сульфатная, магниево – кальциевая, слабокислая. Температура равна 10oC, следовательно, вода холодная.
4 Расчет ионного стока (для сетки тока)
Ионный сток для безнапорных вод рассчитывается по формуле
Ис = Сi*Qбезнап.вод,
где 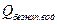 = 4,65
= 4,65 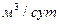
Таблица 12 - Расчет ионного стока (для сетки тока)
| Показатель | Ис для безнапорных вод, т/год |

| 0,034 |
| Mn2+ | 0,00034 |

| 0,198 |
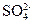
| 0,351 |

| 0,124 |
| Сумма | 0,70734 |
5 Расчет токсичности потока и токсичной массы (для сетки тока)
Токсичность потока определяется по формуле:
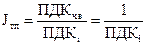 .
.
Токсичность массы определяется по формуле:
Jтм = Jтп*Сi*V = Ci*Jтп*Q;
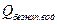 = 4,65
= 4,65 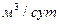
Таблица 13 - Расчет токсичности потока и токсичной массы
| Показатель | ПДК для питьевых нужд, (мг/дм3) | ПДК для рыбохозяйственных целей, (мг/дм3) | Результаты химического анализа природной воды, (мг/дм3) | 
|  (мг/дм3*сут)
для
безнапорных
вод
(мг/дм3*сут)
для
безнапорных
вод
|
| Fe | Не более 0,3 | 0,05 | 0,100 | 9,30 | |

| Не более 0,03 | 0,01 | 0,050 | 23,25 | |

| - | 0,05 | 1,000 | 93,00 | |

| 0,0059 | 0,500 | 169,49 | 394,06 | |

| 0,5 | 0,05 | 1,500 | 139,50 | |
| As3+ | Не более 0,3 | 0,05 | 0,010 | 0,93 | |
| Hg | - | 0,00001 | 0,001 | 465,00 | |
| Сумма | 1125,04 |
Заключение
В ходе работы были построены гидродинамические схемы напорных и безнапорных вод, разрез по скважинам 8 – 14, проведен анализ гидрохимического стока подземных вод.
1 Глубина залегания грунтовых вод в точке А: безнапорный горизонт h = 4,6 м; в точке В: безнапорный горизонт h = 3 м; гидравлический уклон J=0,007
2 Расход потока безнапорных вод Qi = 4,65 м3/сут, расход потока напорных вод Qi = 37,00 м3/сут.
Результаты анализа природной воды были переведены из весовой в эквивалентную и процент-эквивалентную форму.
3 Погрешность анализа составляет не более 5 %, Е = ± 2,05 %.
4 Сумма минеральных веществ воды составляет 595,36 мг/дм3. Жесткость воды определяется содержанием солей Са 2+ и Mg2+ равна 7,3444 мг-экв/дм3.
5 Анализ воды показал, что она считается жесткой.
6 Оценка качества воды по отношению к бетонным и металлическим конструкциям показала, что:
1) Вода агрессивная в отношении металла (коррозия) и бетона;
2) Вода агрессивная для всех видов цементов;
3) Сульфатная и магнезиальная агрессивности отсутствуют.
4) Исследуемая вода относится к полукоррозирующей группе вод.
7 Исследование пробы по формуле Курлова показало, что данная вода пресная, сульфатная, магниево–кальциевая, слабокислая и холодная.
8 Токсичная масса для безнапорного потока равна  = 1125,04 мг/дм3*сут, а для напорного потока
= 1125,04 мг/дм3*сут, а для напорного потока  = 7556,78 мг/дм3*сут. Сумма ионного стока равна
= 7556,78 мг/дм3*сут. Сумма ионного стока равна  = 0,70734 т/год.
= 0,70734 т/год.
9 Пробы воды превышают ПДК по показателям анионов SO42- и F-, и по показателям тяжелых металлов, поэтому вода не пригодна для питьевых нужд и для рыбохозяйственных целей.
10 Происходит фторирование и загрязнение природной воды тяжелыми металлами (Fe, Pb, Zn, Hg, Cu).
Анализ полученных данных показал, что накопитель сточных вод влияет на гидрохимический состав подземных вод, тем самым негативно воздействуя на реку.
Необходимо изолировать накопитель, построив противофильтрационные экраны с использованием полимер-минеральной вязкоупругой смеси, тем самым предотвратить негативное влияние на качество воды. Тампонажные смеси и пасты широко используются в практике геологоразведочного и нефтяного бурения. Изготавливаются на основе нетвердеющих глинистых материалов, твердеющих вяжущих веществ и водорастворимых полимеров.
Загрязнение пресных подземных вод, используемых для хозяйственно-питьевого водоснабжения, не только сказывается на здоровье людей и состоянии окружающей среды, но и приводит к необходимости колоссальных затрат на очистку воды, ремонт и реконструкцию очистных сооружений, дополнительных затрат на здравоохранение. Это происходит на фоне недостаточной изученности и состояния загрязнения, и влияния многих вредных компонентов на здоровье людей и животных, и неразвитости методов исследований многих новых видов загрязнения.
Список используемых источников
1 Бродская Н.А., Воробьев О.Г., Маковский А.Н. и др., под. Ред. Воробьева О.Г. и Николайкина Н.И.,Экология. Сборник задач, упражнений и примеров, учеб. Пособие для вузов,– 2-е изд., перераб и доп. – М.: Дрофа, 2006. – 508с.
2 Михайлов Л.Е., Бродская Н.А., Гидрогеология, учебник – Спб, изд. РГГМУ, 2003.- 410 с.
3 Цыгельнюк Е.Ю., Хуснулина А.Р. Укрепление слабых оснований при строительстве шламовых амбаров [Электрон. ресурс]. – 2013. – URL: https://ores.su/index.php/-2142013/366-2013-03-20-15-45-32 (дата обращения 15.03.2013).
4 Общие понятия о гидрогеологии [Электрон. ресурс]. – 2013. – URL: https://otherreferats.allbest.ru/geology/00106890_0.html (дата обращения 24.04.13).
5 Епифанцев О.Г., Шипилова А.М. Построение карты гидроизогипс. Анализ гидрогеологических условий района: Практикум [Электрон. ресурс]. – 2005. – URL: https://window.edu.ru/resource/117/71117.
6 Конспект лекций.