Опыт выполняется под руководством лаборанта.
Схема измерения величины рН раствора показана.на рисунке.

Схема измерения величины рН раствора
1-полый шарик из электродного (литиевого) стекла;
2-стеклянный электрод;
3-внутренний контактный электрод;
4-вспомогательный электрод;
5-электролитический ключ;
6-пористая перегородка;
7-рН-метр рН-673.
При погружении электрода в раствор между поверхностью шарика стеклянного электрода и раствором происходит обмен ионами, в результате которого ионы лития в поверхностных слоях замещаются ионами  и стеклянный электрод приобретает свойства водородного электрода. Между поверхностью стекла и контрольным раствором возникает разность потенциалов
и стеклянный электрод приобретает свойства водородного электрода. Между поверхностью стекла и контрольным раствором возникает разность потенциалов  ,величина которой определяется концентрацией ионов
,величина которой определяется концентрацией ионов  в растворе и температурой раствора:
в растворе и температурой раствора:

Перед каждым погружением в контрольный раствор электроды надо тщательно промыть дистиллированной водой и удалить с поверхности избыток воды фильтровальной бумагой.
Отсчет величины рH по шкале прибора следует производить после того, как показания примут установившееся значение.
Результаты измерений также внести в табл. 1.
По значению рН раствора, вычислить его молярную концентрацию, зная что [Н+] = 10-рН.
Опыт № 4. Расчет рН растворов электролитов
Для четырех растворов электролитов с указанными концентрациями рассчитать величину рН.
Для этого необходимо: пересчитать данную для электролита концентрацию в молярную; исходя из силы электролита выбрать формулу для расчета молярной концентрации иона, определяющего кислотность, и сделать расчет; рассчитать значение рН. Проанализировать полученные значения.
Результаты расчетов также внести в табл. 1.
СОДЕРЖАНИЕ ОТЧЕТА О РАБОТЕ
Отчет о работе должен быть оформлен грамотно, аккуратно, в срок. При оформлении результатов каждого опыта необходимо указать его название, написать уравнения реакций, отметить наблюдения, ответить на поставленные вопросы. Образец отчета прилагается.
КОНТРОЛЬНЫЕ ВОПРОСЫИ ЗАДАЧИ
1. Что такое ионное произведение воды?
2. Что означают понятия: нейтральная, кислая, щелочная среда? Каково
значение рН в этих средах?
3. Каково значение рН воды при температурах 273, 323, 353 и 373К?
4.Какая зависимость существует между зарядом и размерами катиона и его способностью к гидролизу?
5.Какая существует взаимосвязь между склонностью катиона к
гидролизу и способностью его гидроксида к основной ионизации
(сила основания)?
6.Какая зависимость существует между зарядом и размером аниона и его склонностью к гидролизу?
7.Какая существует взаимосвязь между склонностью аниона к гидролизу и способностью образованной им кислота к кислотной ионизации (сила кислоты)?
8. Вычислить рН 0,05М НСl и 0,05М СН3С00Н.
9. В 200мл раствора едкого натра содержится 0,2г NaOH. Вычислите
рН этого раствора.
10. Определите концентрации Н+ и ОH- в некотором растворе, если его
рН 4,7.
11. Рассчитайте рН 0,01H Н2СО3 (Диссоциацией по второй ступени
можно пренебречь).
12. Какие из солей Na2CО3, FeCl3, Na2SО4, CuSО4 при растворении в
воде создают кислую реакцию среды?
13. Какое значение рН (больше или меньше 7) имеют растворы солей:
NiSО4, Al2(SO4)3 и K2CО3 ?
14. Какое значение рН (больше или меньше 7) имеют растворы солей:
Na3PO4, K2CO3, FeCI3?
15. Составьте ионные и молекулярные уравнения гидролиза солей CH3COOK, ZnCI2, KCN.
Приложение
Таблица 1
Зависимость между pH и окраской различных индикаторов.
| pH | 3.1 | 4.4 | |||||
| Метиловый оранжевый | Красный | Оранжевый | Желтый | ||||
| pH | 8,2 | 10,0 | |||||
| Фенолфталеин | Бесцветный | Розовый | Малиновый | ||||
Таблица 2
Константы диссоциации слабых электролитов(25  С)
С)
| Название электролита | Формула | Константа диссоциации |
| Азотистая кислота | 
| 
|
| Сернистая кислота | 
| 

|
| Сероводородная кислота | 
| 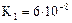

|
| Угольная кислота | 
| 

|
| Уксусная кислота | 
| 
|
| Фосфорная кислота | 
| 

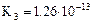
|
| Гидроксид аммония | 
| 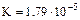
|
| Гидроксид цинка | 
| 
|
| Гидроксидмагния | Mg(OH)2 | 
|
| Щавелевая кислота | 
| 

|
Литература
1. Ахметов, Н.С. Общая и неорганическая химия: Учеб.для вузов / Н. С. Ахметов. - 7-е изд.,стер. - М.: Высшая школа, 2008. – 742 с.
2. Гельфман, М.И. Неорганическая химия: Учеб.для вузов / М. И. Гельфман, В. П. Юстратов. - 2-е изд.,стер. - СПб.: Лань, 2009. – 527 с.
3. Суворов, А.В. Вопросы и задачи по общей химии: Учеб.пособие для вузов / А. В. Суворов, А. Б. Никольский. - СПб.: Химиздат, 2002. – 304 с.
4. Ахметов, Н.С. Лабораторные и семинарские занятия по общей и неорганической химии: Учеб.пособие для студентов ун-тов,хим.-технол.и пед.вузов / Н. С. Ахметов, М. К. Азизова, Л. И. Бадыгин. - 5-е изд.,испр. - М.: Высшая школа, 2003(2002). – 366 с.