1. Общие замечания. Известно, что все организмы состоят, из клеток и продукта их жизнедеятельности = внеклеточного вещества. Причем прокариоты, простейшие и грибы, встречаются в виде отдельных клеток или их колоний. Многоклеточные же эукариоты, типа высших растений и животных, обычно состоят из множеств клеточных дифферонов, структурно сопряженных друг с другом в ткани, согласованные в своем метаболизме и жизненных циклах в интересах организмов, их популяций и сообществ. Залог успеха разрушающего биохимического анализа – рациональный выбор биообъекта, щадящие и верные приемы изъятия из организма образца ткани, его фиксации, хранения и обработки. Различия же в целях и методах анализа (рис. 1) проявились к началу ХХ в.

Рис. 1. Схема целей и этапов биохимических исследований
Изучение структуры и функций биомолекул потребовало их выделения и очистки до минимума примесей, а в идеале – до однородного состояния. Но быстрота разрушения части молекул, например, с функцией медиаторов, как и высокая вероятность денатурации белков, часто вынуждают хранить и вести выделение препаратовна холоде. Для извлечения = экстракции большинства белков из клеток животных, обычно достаточно механической гомогенизации в водной среде выделения. Разрушение же клеточных стенок растений и, особенно микроорганизмов, требует шаровых мельниц, ультразвука и других жестких приемов. Удаление из гомогенатов обрывков волокон, фрагментов клеточных структур и т.п., ведут с помощью их отстаивания, фильтрации или центрифугирования, а для удаления или замены низкомолекулярных веществ, пользуются диализом,ультрафильтрацией или молекулярными ситами. Трудоемкость процедур препаративной биохимии и обилие специфических терминов поясняет схема (рис.2).
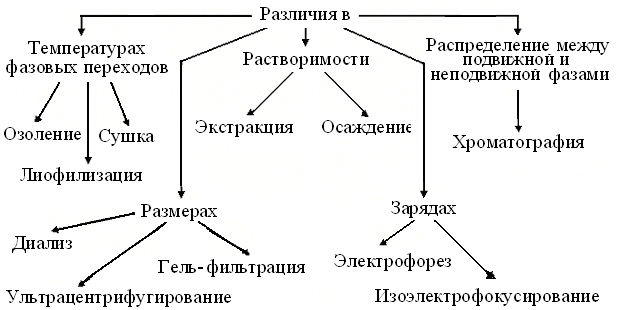
Рис. 2. Схема методов препаративной биохимии
Очевидно, что процесс выделения и очистки препарата почти неизбежно связан с его разбавлением, требующим потом, адекватного задаче концентрирования раствора. Часто для этого применяют высаливание белков, то есть их осаждение из раствора с помощью больших концентраций нейтральных солей: NaCl, (NH4)2SO4, MgSO4 и т.д., в соответствии с положением ионов в ряду Гофмейстера. Этот прием основан на: 1) нейтрализации зарядов молекул белка с помощью противоионов и 2) обратимом разрушении их гидратных оболочек. Т.к. высаливание зависит от размеров и гидрофобности макромолекул, то глобулины плазмы крови оседают при 50 % концентрации сульфата аммония, а осаждение сывороточного альбумина = СА, требует его 100 % насыщения. Т.о., высаливание позволяет не только концентрировать целевой продукт, но и обеспечивает его дополнительную очистку. Осадки белков после этого, растворяют добавлением воды или повторным диализом, добиваясь 50-80 % концентрации препарата. Такой продукт называют сырцом и подвергают заключительным этапам очистки и проверки гомогенности, с помощью разных вариантов хроматографии и электрофореза.
Для диагностики состояний животных и людей, физиологи и врачи неоднократно пытались применять доступные покровные ткани, секреты и экскреты, но быстро убеждались в их ограниченной информативности. Поэтому, уже свыше 100 лет, основным источником информации служит химический анализ слюны, желудочного сока, желчи, молока и, особенно крови, получаемых с помощью малоболезненных и относительно простых и безопасных процедур. Понятно, что точность основных аналитических процедур, уже рассмотренных на предыдущих занятиях, зависит от правильного взятия проб, например, крови – натощак и т.д. и точного выполнения приемов хранения и подготовки материалов к анализу, в основном совпадающих с вышеописанными методами препаративной биохимии.
К сожалению, большинство диагностических лабораторий РФ, как и 100 лет назад, ведет эти анализы вручную, трудоемкими методами микроскопии и классической биохимии. Поэтому, относительно точные = эталонные результаты диагностических показателей выдаются через часы или сутки, а на их получение, идет свыше трети трудозатрат соответствующих лабораторий. Тем не менее, именно они дают от 80 до 100 % объективной и полезной информации о молекулярно-клеточном состоянии и системах управления внутренней средой организма.
2. Дополнительная литература
2.1. Фрайфелдер Д. Физическая биохимия. – М.: Мир, 1980. – С. 154 –170, 247 – 382.
2.2. Остерман Л. А. Методы исследования белков и нуклеиновых кислот. – М.: Наука, 1981. – 285 с.
2.3. Скоупс Р. Методы очистки белков. – М.: Мир, 1985. – 358с.
2.4. Геккелер К., Х. Экштайн Аналитические и препаративные лабораторные методы. – М.: Химия, 1994. – 416 с.
2.5. Цыганенко А. Я. и др. Клиническая биохимия. – М.: Триада-Х, 2002. – 504 с.
2.6. Глик Б., Пастернак Дж. Молекулярная биотехнология. Принципы и применение. – М.: Мир, 2002. – 589 с.
2.7. Нельсон Д., Кокс М. Основы биохимии Ленинджера Т.1 М.: Бином, 2012
Экспериментальная часть
Проводится в соответствии со схемой на рис. 3 (делает только дежурная пара) – берем пластиковые пробирки

Рис.3. Схема деления крови на фракции (пояснения в тексте)
3.1. Деление плазмы и форменных элементов крови (ФЭК)
1. В маркированную пластиковую пробирку внести 1-2 мл крови с добавкой антикоагулянта: 0,5 % гепарина; 0,2-0,5 % Трилона Б = динатриевой соли этилендиаминотетраацетата = ЭДТАNa2 и т.п.
2. Зафиксировав в протоколе занятия исходный объем крови, поместить пару пластиковых гильз центрифуги на чашки центрифужных весов и вставить в них пробирки с кровью.
3. Определить, какая чашка легче и, в ее гильзу, но не пробирку, добавить для уравновешивания из пипетки по каплям дистиллят. ВНИМАНИЕ! Во избежание повторения процедуры с другой чашкой, опасаться передозировки!
4. Уравновесив гильзы с пробирками, установить их в противоположные по диаметру гнезда ротора центрифуги ОПН-3.
5. Дежурный студент, убедившись, что на задней панели центрифуги переключатель скорости вращения находится в положении 2 – 3000 об/мин и, дождавшись повторения пп. 2-4 всей подгруппой, закрывает прибор крышкой и, вставив его вилку в сетевую розетку, клавишей на передней панели включает вращение ротора. Затем, повернув по часовой стрелке рычаг на циферблате таймера, устанавливает время – 7 мин., убедившись по звуку, что он действует.
6. По звонку таймера, клавишей на передней панели центрифуги – отключить прибор.
7. Дождавшись полной остановки ротора и, сняв затем крышку центрифуги, осторожно, чтоб не взмутить рыхлый осадок ФЭК, перенести свою пробирку из гильзы в штатив на столе. При наличии воды в гильзе – выплеснуть ее в раковину водопровода.
8. С помощью полуавтоматического дозатора или пипетки с грушей, аккуратно отсосать из центрифужной пробирки по возможности весь надосадок, перенося чистую плазму крови в новую маркированную пробирку для выполнения работы 6.3.3.
9. Зафиксировав в протоколе занятия полученные объемы плазмы и эритроцитов, осторожно, чтобы не вызвать гемолиза, к осадку последних добавить 2-3 мл физиологического раствора, суспендировать его и повторить операции пп. 2-7.
10. Слив надосадок в раковину водопровода, использовать однократно промытый осадок ФЭК в работе 6.3.2.
3.2. Разделение гемоглобина и теней эритроцитов (дежурная пара)
1. Добавить к осадку ФЭК 2 объема дистиллята и 1 каплю хлороформа для ускорения осмотического гемолиза.
2. Закрыв горло пробирки пробкой, обернутой полиэтиленовой пленкой или алюминиевой фольгой, энергично встряхнуть ее содержимое и поставить пробирку в штатив на 30 мин., периодически встряхивая для ускорения полноты гемолиза.
3. Уравновесив пробирки на центрифужных весах аналогично пп. 2-7 работы 6.3.1, центрифугировать гемолизаты 15 мин. при 3000 об/мин.
4. Красный надосадок водного раствора гемоглобина количественно перенести в чистую, четко промаркированную пробирку и, закрыв ее пробкой, сдать на хранение в холодильнике лаборанту, для работ на следующих занятиях.
5. Перевернув пробирку вверх дном, подсушить плотный белесый осадок на фильтровальной бумаге.
6. Аналогично п. 4 данной работы, четко маркировать пробирку и, закрыв ее пробкой, сдать на хранение лаборанту, как препарат теней (уст. – стромы) эритроцитов. При желании, небольшую часть материала стоит микроскопировать с большим увеличением.
3.3. Высаливание белковых фракций плазмы крови и их количественная нефелометрия (делают все)
Основаны на способности белков, в зависимости от прочности их гидратных оболочек, оседать из раствора при определенных концентрациях фосфатных солей. Степень помутнения растворов, определенная нефелометрией на ФЭКе КФК-2, пропорциональна содержанию белка в соответствующей фракции.
1л основного фосфатного буферного раствора содержит: 67 г. NaOH и 463,6 г. К3РО4. Соотношение объемов рабочих буферных растворов – в таблице 1.
Таблица 1
Состав рабочих буферных растворов.
| На 100 мл рабочего | Основной фосфатный буфер, мл |
| 92,0 | |
| 74,9 | |
| 59,2 | |
| 48,7 |
1. В соответствии с таблицей 2 поместить в 6 пронумерованных центрифужных пробирок:
2. Пробы тщательно перемешать и, точно через 15 мин с момента добавки препаратов, измерить величины А растворов на ФЭКе с красным светофильтром, в кювете толщиной 5 мм против контроля.
3. Убедившись в надежной маркировке проб, плотно закрыть их пробками и сдать образца на хранение лаборанту для работы на следующих занятиях.
Таблица 2.
Состав проб, мл для высаливания белковых фракций плазмы
| Высаливание | Дистиллят | Фосфатный буфер по 3,0 | Образец плазмы крови |
| 1. Контроль | 4,0 | - | - |
| 2. Исходная | 0,5 | Основной | 0,250 |
| 3.Все белки | - | Рабочий-1 | Перекат по 0,25 мл смеси из предыдущей пробирки |
| 4.Все глобулины | - | Рабочий-2 | |
| 5. β и γ глобулины | - | Рабочий-3 | |
| 6. Только γ глобулины | - | Рабочий-4 |
4. Для каждой фракции белков плазмы рассчитать истинное значение А по формулам: Сывороточный альбумин (СА) = А3 - А4;
α–глобулины = А4 - А5;
β–глобулины = А5 - А6;
γ–глобулины = А6.
5. Полученные истинные значения А для всех фракций суммировать и, приняв найденную величину за 100 %, рассчитать по формуле:

В норме, плазма крови млекопитающих содержит 60-80 г/л белка, из которых 35-50 г/л СА и 25-30 г/л глобулинов. Т.е. отношение альбумина к глобулинам = индекс А/Г лежит в пределах 1,5-2,3. Отсюда, относительное содержание CА в плазме крови составляет 55%, α–глобулинов – 10-18%, β–глобулинов – 8-14% и γ – глобулинов – 12-22%. Данные величины, как важнейшие константы гомеостаза, изменяются лишь при тяжелых кровопотерях, воспалительных и инфекционных заболеваниях и, крайней степени белкового голодания – маразме.
Вопросы для самоконтроля
1. С позиций биологии, определите понятие «ткань».
2. Какие разновидности биотканей вам известны?
3. Определите понятие «дифферон» и приведите их примеры.
4. Можно ли биохимические методы анализа назвать неразрушающими?
5. Чем различаются основные подходы к биохимическому анализу и в чем состоит залог его успеха?
6. В чем могут заключаться подготовительные операции при биохимическом анализе?
7. В каком температурном режиме хранят материал и выделяют биохимические препараты?
8. Почему нет единого алгоритма для выделения биомолекул?
9. Сформулируйте основные этапы препаративной биохимии.
10. Назовите основные этапы диагностической биохимии.
11. Какие способы разрушения тканей и клеток вам известны?
12. Почему ткани животных разрушать проще, чем клетки прокариот и ткани растений?
13. Какими приемами удаляют из гомогенатов недостаточно разрушенный материал?
14. Какие принципы могут лежать в основе разделения смеси биомолекул?
15. Какие факторы нужно учитывать при экстракции или осаждении биополимеров из смеси?
16. Что такое «высаливание» и зачем оно применяется?
17. Какие методы применимы для удаления или замены низкомолекулярных веществ в гомогенатах?
18. Что такое «молекулярные сита» и на каком принципе основано их применение? Назовите синонимы этого метода?
19. Почему различия в фазовых переходах сравнительно редко применяются к разделению биомолекул?
20. Какие методы разделения макромолекул основаны на разнице в их размерах?
21. Что такое хроматография и, какие ее разновидности вам известны?
22. Что такое «изоэлектрическая точка» и чем она отличается от понятия «изоэлектрическое состояние»?
23. Что вы знаете об электрофорезе и, чем он отличается от изоэлектрофокусирования?
24. Какие способы концентрирования растворов вам известны?
25. Как убедиться в гомогенности и нативных свойствах препарата?