Все методы защиты от коррозии можно условно разделить на следующие группы:
1. ЛЕГИРОВАНИЕ.
В состав сплава вводят компоненты, вызывающие пассивность металла. В качестве таких компонентов применяют хром, никель, вольфрам, медь, титан и т.д.
Введение добавок к сталям приводит к тому, что при коррозии образуются плотные продукты реакции, которые предохраняют сплав от дальнейшей коррозии. При этом используют сплавы жаростойкие (стойкие по отношению к газовой коррозии при высоких температурах) и жаропрочные (сплавы, сохраняющие свою высокую механическую прочность при значительных повышениях температуры).
2. ЗАЩИТНЫЕ ПОКРЫТИЯ
2.1. Металлические покрытия – цинк, кадмий, алюминий, олово, серебро и др., а также сплавы – бронза, латунь и т.д. В свою очередь металлические покрытия разделяются на:
а) анодные покрытия - покрытие, у которого потенциал меньше потенциала защищаемой поверхности. При нарушении такого покрытия в первую очередь будет окисляться само покрытие.
б) катодные покрытия – покрытие, у которого потенциал больше потенциала защищаемой поверхности. При нарушении такого покрытия в первую очередь будет окисляться защищаемая поверхность.
2.2. Неметаллические покрытия. Их можно разделить на:
а) неорганические покрытия – неорганические эмали (различные силикаты), оксиды металлов, соединения хрома и фосфора и т.д.
б) органические покрытия – лакокрасочные покрытия, покрытия смолами, резиной, полимерными пленками и т.п.
3. ЭЛЕКТРОХИМИЧЕСКАЯ ЗАЩИТА
Данный метод основан на торможении катодных или анодных процессов.
а) протекторная защита – к защищаемой поверхности конструкции присоединяется деталь из более активного металла (протектор), чем защищаемая поверхность. При этом образуется коррозионная пара, в которой защищаемая поверхность будет катодом, а разрушаться в первую очередь будет протектор. Протекторная защита эффективно используется при защите кораблей от коррозии.
б) катодная защита – защищаемое изделие подключается к отрицательному полюсу внешнего источника постоянного тока и становится катодом, а анодом служит вспомогательный, обычно стальной, электрод, который растворяется, а на защищаемом сооружении выделяется водород. Катодная защита используется для защиты от коррозии подземных трубопроводов, кабелей, водных резервуаров.
4. ИЗМЕНЕНИЕ СВОЙСТВ КОРРОЗИОННОЙ СРЕДЫ
а) Для снижения агрессивности среды уменьшают концентрацию компонентов, которые опасны в коррозионном отношении. Например, в нейтральных средах деполяризатором является кислород, поэтому его удаляют кипячением или восстанавливают.
б) Для замедления процессов коррозии широко используют ингибиторы. Ингибиторы - вещества, которые при добавлении в агрессивную среду, уменьшают скорость коррозии. Они используются в тех случаях, когда в системе редко или мало обновляется раствор электролита (в парогенераторах, системах охлаждения и т.д.)
Механизм действия большинства ингибиторов заключается в адсорбции ингибитора на корродирующей поверхности, и затем тормозятся катодные или анодные процессы. В качестве ингибиторов используют органические вещества, содержащие серу, азот и кислород (уротропин), неорганические вещества (H2O2, Na2Cr2O7, NaNO2 и. т.д.)
5. РАЦИОНАЛЬНОЕ КОНСТРУИРОВАНИЕ
При конструировании исключить (по возможности) или сократить число и размеры особо опасных, с точки зрения коррозии, участков (например, сварных швов, узких щелей); предусмотреть специальную защиту металлической конструкции от коррозии.
ПРИМЕР 6: К какому типу покрытия относится лужение железа (железо покрывают оловом)? Рассмотрите схему коррозионного процесса, происходящего при нарушении целостности покрытия в растворе сульфида натрия.
Ответ: Коррозия луженого железа осуществляется за счет работы коррозионного элемента, состоящего из железа и олова.
Е0(Fe) =-0,44B, a E0(Sn) = -0,14B. Т.к. потенциал покрытия больше потенциала металла изделия, то при нарушении целостности покрытия в первую очередь будет окисляться металл изделия, т. е. данное покрытие относится к катодным покрытиям.
В водном растворе сульфид натрия подвергается гидролизу по аниону слабой кислоты:
Na2S = Na+ + S2-
Na2S + H2O ↔ NaHS + NaOH
S2- + HOH ↔ HS- + OH-
В результате гидролиза среда раствора электролита становится щелочной (рН > 7), т.к. накапливаются гидроксид-ионы ОН-, следовательно, деполяризатором являются молекулы кислорода, растворенные в воде, и на катодных участках будет осуществляться кислородная деполяризация.
Процесс коррозии протекает по схеме:
nē
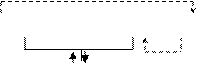 |
(-) Fe /Na2S +H2O+O2 / Sn (+)
nē
NaHS + NaOH
Анодные участки: Fe – 2e = Fe2+
Катодные участки: O2 + 2H2O + 4e = 4OH-
Суммарное уравнение:
2Fe + O2 + 2H2O = 2Fe(OH)2 → Fe(OH)3 → FeOOH
ПРИМЕР 7: Какой из металлов – цинк или медь – можно использовать в качестве протектора для защиты от электрохимической коррозии железной конструкции? Рассмотрите схему коррозионного разрушения железной конструкции в почвенном растворе с рН = 4.
Ответ: Е0(Fe) = -0,44В; Е0(Zn) = -0,76В; Е0(Cu) = 0,34В. В качестве протектора используется наиболее активный металл, у которого потенциал меньше, чем потенциал защищаемой конструкции. В данном случае в качестве протектора для защиты железной конструкции от электрохимической коррозии необходимо использовать цинк, т.к. Е0(Zn) < Е0(Fe).
Т.к. рН = 4, почвенный раствор кислый (pH<7), т.е. в нем преобладают ионы водорода, то на катодных участках будет наблюдаться водородная деполяризация. Поскольку в условии задания не указано конкретное вещество, придающее раствору кислотность, в схеме коррозионного элемента можно указать любую кислоту (например, HCl)
Схема коррозионного процесса:
 nē
nē

(-) Zn / НCl + H2O + O2 / Fe (+)
nē
 Анодный процесс: Zn - 2ē → Zn2+ 1
Анодный процесс: Zn - 2ē → Zn2+ 1
Катодный процесс: рН<7; 2Н+ + 2ē →Н2↑ 1
Суммарное уравнение:
Zn + 2HCl → ZnCl2 + H2 или Zn + 2H+ → Zn2+ + H2
При использовании метода внешнего потенциала защищаемое изделие подключается к отрицательному полюсу источника тока, а положительный полюс замыкают на землю.
ЛАБОРАТОРНАЯ РАБОТА
«Коррозия металлов. Методы защиты металлов от коррозии»
Опыт 1. Электрохимическая неоднородность поверхности стали
Для проведения опыта зачистите стальную пластинку наждачной бумагой, промойте проточной водой и высушите фильтровальной бумагой. Затем положите на пластинку бумажный фильтр, смоченный ферроксилиндикатором. Фероксилиндикатор представляет собой водный раствор хлорида натрия, содержащий гексацианоферрат (III) калия – K3[Fe(CN)6] и фенолфталеин. Гексацианоферрат (III) калия является качественным реактивом на ионы Fe2+, качественным признаком наличия этих ионов является нерастворимого гексацианоферрат (III) калия-железа (II) тёмно-синего цвета, называемого турнбелевая синь.
Fe2+ + K+ + [Fe(CN)6]3- → KFe[Fe(CN)6]
Через 2-3 минуты опишите изменение цвета фильтровальной бумаги, форму и распределение пятен. Опишите наблюдения, запишите уравнения электродных реакций и схему коррозионного процесса.
Опыт 2. Коррозия железа в контакте с углеродом
Заполните U-образную трубку на ½ объёма 0,5 М раствором хлорида натрия. Зачистите наждачной бумагой и промойте проточной водой стальные и графитовые стержни. В одно колено трубки поместите стальной стержень и добавьте 3-4 капли раствора K3[Fe(CN)6], во второе колено погрузите графитовый стержень и добавьте 3-4 капли фенолфталеина.
Замкните внешнюю цепь через милливольтметр и запишите напряжение. Отключите вольтметр, замкните внешнюю цепь и наблюдайте за работой элемента. Как изменяется окраска раствора в катодном и анодном пространствах.
Запишите уравнения катодного и анодного процессов, составьте суммарное уравнение коррозионного процесса и схему коррозионного элемента.
Опыт 3. Легирование металла
В качестве легирующих добавок к железу применяют никель и хром. В две пробирки налейте на ½ объёма воды и добавьте 2-4 мл раствора серной кислоты и 2-3 капли раствора K3[Fe(CN)6]. В одну пробирку поместите зачищенную наждачной бумагой и промытую проточной водой стальную пластинку, во вторую пробирку – пластинку из нержавеющей стали (незачищенную).
Отметьте изменение цвета раствора через 5 минут и количество выделяющихся пузырьков газа в единицу времени.
Объясните ваши наблюдения, запишите уравнения анодных и катодных процессов. Приведите схему коррозионного процесса и уравнение суммарной реакции. Объясните причину различного поведения пластинок в растворе кислоты.
Опыт 4. Анодные и катодные защитные покрытия
В две пробирки налейте на ½ объёма воды и добавьте 1-2 мл раствора серной кислоты и 2-4 капли раствора K3[Fe(CN)6]. В одну пробирку поместите полоску оцинкованного, а в другую – лужёного железа. Отметьте изменение цвета раствора через 5 минут.
Объясните ваши наблюдения, запишите уравнения анодных и катодных процессов, приведите схемы работы коррозионных элементов и суммарные уравнения процессов коррозии. Укажите, какое из изученных покрытий было анодным, какое – катодным.
Вылейте растворы из пробирок; полоски железа хорошо промойте водой и проделайте опыт с раствором щёлочи. Наблюдения запишите и объясните так же, как в случае с кислым раствором.
Опыт 5. Протекторная защита металла
А. Протекторная защита свинца
В две пробирки налейте на ½ объёма 0,4 М раствора уксусной кислоты СН3СООН и добавьте в каждую несколько капель раствора иодида калия. В одну пробирку поместите полоску свинца, в другую – такую же полоску свинца, но в контакте с цинком. Наблюдайте, в какой из пробирок быстрее появится жёлтое окрашивание.
Объясните наблюдаемые явления. Запишите уравнения анодных и катодных процессов, приведите схемы работы коррозионных элементов и суммарные уравнения процессов коррозии.
Б. Протекторная защита стали
В две пробирки налейте на ½ объёма 0,1 М раствора серной кислоты и 2-4 капли раствора K3[Fe(CN)6]. В одну пробирку поместите стальную полоску, в другую – такую же полоску стали, но в контакте с цинком.
Запишите ваши наблюдения и объясните их, написав уравнения анодного и катодного процессов, приведите схемы работы коррозионных элементов и суммарные уравнения процессов коррозии.
Опыт 6. Влияние ингибитора на скорость коррозии
В две пробирки налейте на ½ объёма 0,1 М раствора серной кислоты и поместите в каждую пробирку полоску железа или железные стружки. В одну пробирку добавьте уротропин или другой ингибитор.
Наблюдения запишите и объясните. Запишите уравнения анодных и катодных процессов, приведите схемы работы коррозионных элементов и суммарные уравнения процессов коррозии.
ИНДИВИДУАЛЬНЫЕ ЗАДАНИЯ
Задание 1
Определите тип коррозии. Составьте уравнения процессов, протекающих в каждом из случаев, и схему коррозионного элемента для случая электрохимической коррозии. Укажите тип коррозионного разрушения.
(А) а/ Шероховатая железная пластинка в среде газообразного хлора при Т=573 К;
б/ Изогнутая цинковая пластинка в растворе K2S при Т=298К.
(Б) а/ Полированная пластина из углеродистой стали в сухом хлороводороде при Т=300 К;
б/ Полированная алюминиевая пластина в растворе Са(ОН)2 при Т=298 К.
(В) а/ Полированная алюминиевая пластина в сухом воздухе при Т=400К;
б/ Шероховатая железная пластинка в растворе (NH4)2S при Т=298К.
(Г) а/ Шероховатая железная пластинка в сухом воздухе при Т=373К;
б/ Изогнутая железная пластина в растворе NiSO4 при Т=298К.
(Д) а/ Шероховатая цинковая пластинка в сухом сероводороде при Т=300К;
б/ Полированная алюминиевая пластина в растворе FeCl2 при Т=298К.
(Е) а/ Изогнутая пластина из углеродистой стали в сухом хлороводороде при Т=300К;
б/ Изогнутая цинковая пластина в растворе Na2CO3 при Т=298К.
(Ж) а/ Шероховатая алюминиевая пластина в водяном паре при Т=423К;
б/ Изогнутая железная пластина в растворе HCl при Т=298К.
(З) а/ Полированная цинковая пластина в сухом сероводороде при Т=360К;
б/ Полированная цинковая пластина в растворе CuSO4 при Т=298 К.
(И) а/ Изогнутая пластина из углеродистой стали в насыщенном кислородом бензине при Т=298К;
б/ Изогнутая алюминиевая пластина в растворе Na2SO3 при Т=298 К.
(К) а/ Полированная алюминиевая пластина в сухом воздухе при Т=398К;
б/ Пластина из углеродистой стали в растворе K2SO4 при Т=298 К.
(Л) а/ Полированная пластина из углеродистой стали в сухом хлороводороде при Т=350К;
б/ Шероховатая цинковая пластинка во влажном воздухе при Т=298К.
(М) а/ Шероховатая железная пластинка в насыщенном кислородом керосине при Т=298К;
б/ Пластина из углеродистой стали в растворе CrCl2 при Т=298 К.
(Н) а/ Полированная пластина из углеродистой стали в насыщенном хлором керосине при Т=298К;
б/ Полированная алюминиевая пластина в растворе Ca(NO3)2 при Т=298 К.
(О) а/ Полированная цинковая пластина во влажном воздухе при Т=300К;
б/ Пластина из углеродистой стали в растворе NaOH при Т=298К.
(П) а/ Полированная железная пластина в водяном паре при Т=473К;
б/ Изогнутая цинковая пластина в растворе KCl при Т=298 К.
(Р) а/Шероховатая алюминиевая пластинка в сухом хлороводороде при Т=380К;
б/ Изогнутая железная пластина в растворе (NH4)2SO4 при Т=298 К.
(С) а/ Шероховатая железная пластинка в сухом сероводороде при Т=330К;
б/ Шероховатая алюминиевая пластинка в растворе Na2S при Т=298К.
(Т) а/ Полированная пластина из углеродистой стали в газообразном хлоре при Т=398К;
б/Полированная цинковая пластина в растворе K2SiO3 при Т=298К.
(У) а/ Полированная пластина из углеродистой стали в сухих парах брома при Т=320К;
б/ Изогнутая цинковая пластина в растворе Cr(NO3)2 при Т=298 К.
(Ф) а/ Полированная алюминиевая пластина в насыщенном кислородом керосине при Т=298К;
б/ Полированная алюминиевая пластина в растворе H2SO4 при Т=298 К.
Задание 2
(А) Какой из двух металлов, контактирующих в конструкции, будет подвергаться разрушению. Металлическое изделие находится в растворе электролита. Составьте соответствующие уравнения и схему коррозионного элемента: Fe/Ti в растворе CuCl2;
(Б) См. условие в варианте А: Cu/Au в растворе CrCl2;
(В) См. условие в варианте А: Fe/Cd в растворе KOH;
(Г) См. условие в варианте А: Sn/Cu в растворе Na2SiO3;
(Д) См. условие в варианте А: Fe/Zn в растворе HCl;
(Е) См. условие в варианте А: Cd/Ni в растворе Cr(NO3)2;
(Ж) См. условие в варианте А: Co/Pb в растворе NaOH;
(З) См. условие в варианте А: Mn/Fe в растворе NaCl;
(И) Каким - анодным или катодным – покрытием будет цинк (1), если изделие изготовлено из железа (2)? Напишите схему коррозионного процесса, протекающего при нарушении целостности покрытия в растворе (NH4)2SO4 (3).
(К) См. условие в варианте И. 1 – Ni, 2 – Fe, 3 - в растворе NaCl
(Л) См. условие в варианте И. 1 – Pb, 2 – Fe, 3 - в растворе Na2CO3
(М) См. условие в варианте И. 1 –Cr, 2 – Fe, 3 - в растворе Cu(NO3)2
(Н) См. условие в варианте И. 1 – Cu, 2 – Fe, 3 - в растворе H2SO3
(О) См. условие в варианте И. 1 – Ag, 2 – Fe, 3 - в растворе Na2SO4
(П) См. условие в варианте И. 1 – Sn, 2 – Fe, 3 - в растворе KOH
(Р) См. условие в варианте И. 1 – Au, 2 – Fe, 3 - в растворе MgCl2
(С) В качестве протектора для защиты от коррозии стальных изделий используют алюминий. Составьте схему процессов, лежащих в основе защитного действия протектора, протекающих в растворе Mn(NO3)2.
(Т) В качестве протектора для защиты от коррозии стальных изделий используют алюминий. Составьте схему процессов, лежащих в основе защитного действия протектора, протекающих в почвенном растворе с рН = 7.
(У) В качестве протектора для защиты от коррозии стальных изделий используют марганец. Составьте схему процессов, лежащих в основе защитного действия протектора, протекающих в растворе NaНCO3.
(Ф) В качестве протектора для защиты от коррозии стальных изделий используют марганец. Составьте схему процессов, лежащих в основе защитного действия протектора, протекающих в растворе НNO3.
Приложение