Ход занятия
Организационный момент
- проверка присутствия студентов;
- записи в журнале;
- проверка подготовки к занятию студентов.
Сообщение темы, цели и основных задач занятия.
Мотивация к изучению материала
Изученные вами реакции можно классифицировать по следующим признакам: изменению степеней окисления атомов, входящих в состав реагирующих веществ (окислительно-восстановительные реакции); числу и составу исходных и образующихся веществ (реакции разложения, соединения, замещения, обмена); тепловому эффекту (экзо- и эндотермические реакции); обратимости (обратимые и необратимые реакции). Все химические реакции подразделяют на те, в которых изменяются степени окисления атомов, и на те, в которых степени окисления не изменяются. Сегодня мы рассмотрим реакции в которых степени окисления атомов изменяются.
Актуализация опорных знаний
1) Перечислите известные вам типы химических реакций.
2) По каким признакам классифицируются типы химических реакций?
3) Дайте определение степени окисления.
4) Почему некоторые элементы проявляют различные степени окисления?
Изучение нового материала
Окислительно-восстановительными реакциями (ОВР) называют реакции, протекающие с изменением степеней окисления участвующих в них элементов. К окислительно-восстановительным можно отнести реакции с раздельным протеканием окисления и восстановления (электрохимические). Для характеристики состояния элементов в соединениях введено понятие степени окисления (СО).
Степень окисления элемента – формальный заряд, который был бы на атоме, если бы все связи в соединении были ионными. Характерные степени окисления элемента определяются конфигурацией валентного электронного слоя.
В зависимости от электроотрицательности (ЭО) атома СО может быть отрицательной или положительной. Элементы с высоким значением ЭО имеют отрицательную СО, а с малым – положительную.
Определяют СО, исходя из следующих правил:
1) Степень окисления атомов в простом веществе равна нулю. Например, О20, О30, S80 и т.д.
2) В соединениях с ковалентными полярными связями более электроотрицательный элемент имеет следующие СО: F-, О-2 (за исключением пероксидов (Н2О2 -), надпероксидов (КО2-1/2), озонидов (КО3-1/3) и O+2F2.
3) Элементы с малой ЭО проявляют СО: Н+ (за исключением солеобразных гидридов LiH-), щелочные металлы +1, щелочноземельные металлы +2.
4) Алгебраическая сумма СО элементов в нейтральной молекуле равна нулю, а в сложном ионе – заряду иона.
Большинство элементов в соединениях проявляют переменную СО.
Примеры. Fe+2O-2, Fe2+3O3-2, K+N+3O2-2, H+N+5O3-2.
Максимальная СО имеет периодическую зависимость от порядкового номера в периодической таблице элементов и совпадает с номером группы. Для неметаллов периодическую зависимость имеет также и минимальная СО – это определяется электронным строением атома.
Окисление – процесс, в котором степень окисления элемента повышается вследствие отдачи электронов. Zn – 2e = Zn2+
Восстановитель является донором электронов, то есть «отдает электроны» и окисляется. В окислительно-восстановительных реакциях восстановитель переходит в соответствующую окисленную форму.
К типичным восстановителям относят простые вещества, атомы которых имеют низкое значение ЭО, например, металлы (особенно активные – щелочные и щелочноземельные), водород, углерод, анионы, атомы которых находятся в низшей СО, например, Cl-, NO2- и т.д.
Восстановление – процесс, в котором степень окисления элемента понижается вследствие присоединения электронов. Сu2+ + 2e = Cu.
Окислитель – акцептор электронов, то есть «принимает электроны» и восстанавливается.
В данной реакции Cu является восстановленной формой, а Сu2+- окисленной. К типичным окислителям относят простые вещества, атомы которых имеют высокую ЭО (кислород, хлор, фтор), соединения кислорода – пероксиды (Н2О2), катионы и анионы, содержащие атомы с высокой СО (Fe3+, Pb4+, NO-3, CrO42-, ClO4-).
Процессы окисления и восстановления протекают одновременно.
Окислительно-восстановительные реакции подразделяют на межмолекулярные, внутримолекулярные, диспропорционирования (или самоокисления-самовосстановления), конпропорционирования.
В ходе ОВР восстановитель отдает свои электроны окислителю, сам при этом окисляется. Окислитель, принимая электроны, восстанавливается. Раздельное протекание окисления и восстановления происходит только в электрохимических процессах на электродах.
В уравнениях окислительно-восстановительных реакций должен быть отражен «электронный» и «материальный» баланс. Электронный баланс: число электронов, «отданных» восстановителем, должно быть равно числу электронов, «принятых» окислителем. Материальный баланс: число атомов одного элемента в левой и правой части уравнения должно быть одинаковым.
Метод электронного баланса применяют для составления уравнений реакций ОВР любого типа. Он включает определение степеней окисления элементов, наименьшего общего кратного числа «отданных» восстановителем и «принятых» окислителем электронов, определение коэффициентов электронного баланса:
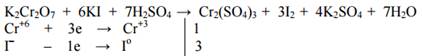
Рассмотрим этот метод на примере восстановления перманганата калия концентрированной соляной кислотой. Эта реакция используется в качестве лабораторного метода получения хлора.
Записываем схему реакции: KMnO4 + HCl = Cl2 + KCl + MnCl2 + H2O.
Определяем СО элементов: K+Mn+7O4-2 + H+Cl- = Cl20 + K+Cl- +MnCl2+H2+O-2. В ходе взаимодействия только атомы марганца и хлора изменяют степень окисления. При этом степень окисления марганца уменьшается (Mn+7 –окислитель), а хлора – увеличивается (Cl- - восстановитель).
Составим схемы, отражающие процесс передачи электронов:
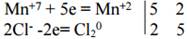
Так как количества отданных и принятых электронов должно быть одинаковым, введем дополнительные множители, устанавливающие электронный баланс.
2KMnO4 + 10HCl = 5Cl2 + KCl + 2MnCl2 + H2O.
Далее уравняем количества атомов, не участвующих в процессах окисления-восстановления, в следующем порядке: количество атомов металлов (катионов), не изменивших степени окисления (калий); ионы кислотных остатков, не изменивших степени окисления (хлорид – анионы); количество ионов водорода; проверка правильности расстановки коэффициентов осуществляется подсчетом общего количества атомов кислорода слева и справа:
2KMnO4 + 16HCl = 5Cl2 + 2KCl + 2MnCl2 + 8H2O
Типы ОВР. Рассмотренное выше уравнение описывает межмолекулярную ОВР. Окислитель и восстановитель являются разными веществами (атомы разных элементах находятся в разных молекулах).
Если окислитель и восстановитель являются атомами разных элементов, но находятся внутри одной молекулы, то реакция называется внутримолекулярной ОВР: 2AgNO3 = 2Ag + 2NO2 + O2.
Ag+ + e = Ag восстанавливается, окислитель
N+5 + e = N+4 восстанавливается, окислитель
2O-2 – 4e = O2 окисляется, восстановитель
2Ag+ + 2N+5 + 2O-2 = 2Ag + 2N+4 + O2
В некоторых ОВР происходит окисление и восстановление атомов или ионов одного и того же элемента. Такие реакции называются реакциями самоокисления-самовосстановления:
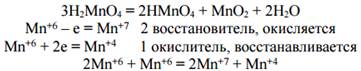
6. Домашнее задание – составить краткий конспект лекции: дать определение окисления и восстановления, привести примеры.
1) Составьте уравнение химической реакции образования хлорида натрия. Является ли данная реакция окислительно-восстановительной? Если да, то укажите окислитель и восстановитель.
2) 4Fe0 + 3O02 + 6H2O = 4Fe+3(O-2H)3
Данное уравнение химической реакции отражает процесс ржавления железа или коррозию железа. Скажите, по признаку изменение степени окисления это будет какая реакция? Окислительно-восстановительная. В чем же заключается суть процесса коррозии? Окислитель? Восстановитель?