Растения
Сроки сбора материала. Сбор материала следует проводить после остановки роста листьев (в средней полосе начиная с июля).
Объем выборки. Каждая выборка должна включать в себя 100 листьев (по 10 листьев с 10 растений). Листья с одного растения хранятся отдельно, для того, чтобы в дальнейшем можно было проанализировать полученные результаты индивидуально для каждой особи (собранные с одного дерева листья связывают за черешки). Все листья, собранные для одной выборки, необходимо сложить в полиэтиленовый пакет, туда же вложить этикетку. В этикетке указать номер выборки, место сбора (делая максимально подробную привязку к местности), дату сбора.
Выбор деревьев. При выборе деревьев важно учитывать, во-первых, четкость определения принадлежности растения к исследуемому виду. По данным некоторых авторов береза повислая способна скрещиваться с другими видами берез, образуя межвидовые гибриды, которые обладают признаками обоих видов. Во избежание ошибок следует выбирать деревья с четко выраженными признаками березы повислой. Во-вторых, листья должны быть собраны с растений, находящихся в сходных экологических условиях (учитывается уровень освещенности, увлажнения и т.д.). Рекомендуется выбирать деревья, растущие на открытых участках (полянах, опушках), т.к. условия затенения являются стрессовыми для березы и существенно снижают стабильность развития растений. В-третьих, при сборе материала должно быть учтено возрастное состояние деревьев. Для исследования выбирают деревья, достигшие генеративного возрастного состояния
Сбор листьев с растения. Сбор материала следует проводить после остановки роста листьев (в средней полосе начиная с июля).У березы повислой собирают листья из нижней части кроны дерева с максимального количества доступных веток равномерно вокруг дерева. Тип побега также не должен изменяться в серии сравниваемых выборок. Листья следует собирать только с укороченных побегов. Размер листьевдолжен быть сходным, средним для данного растения. Поврежденные листья могут быть использованы для анализа, если не затронуты участки, с которых будут сниматься измерения. С растения собирают несколько больше листьев, чем требуется, на тот случай, если часть листьев из-за повреждений не сможет быть использована для анализа.
Подготовка и хранение материала. Для непродолжительного хранения собранный материал можно хранить в полиэтиленовом пакете на нижней полке холодильника. Для длительного хранения надо зафиксировать материал в 60% растворе этилового спирта или гербаризировать.
Рыбы
Сбор материала. Выборки должны состоять из особей сходного возраста. При изучении взрослых рыб необходимо учитывать, что полученные оценки уровня флуктуирующей асимметрии отражают воздействие среды на момент формирования исследованных признаков. Оценку ситуации на текущий момент позволит получить анализ выборок сеголеток. Рекомендуемый объем выборки - 20 особей.
Подготовка и хранение материала. Для анализа лучше всего использовать свежепойманную рыбу. Хранить материал удобно в замороженном виде. Можно фиксировать рыбу в 4% формалине или 70% этаноле. Следует избегать длительного хранения материала, так как при этом возможно нарушение чешуйчатого покрова и некоторых других структур.
7.3. Земноводные
Сбор материала. Для анализа следует брать особей в возрасте от одного года и старше, так как большинство используемых морфологических признаков формируются к этому возрасту и не подвержены дальнейшим возрастным изменениям. Использование сеголеток может быть рекомендовано лишь для сравнения с той же возрастной группой, поскольку к этому моменту не все из исследуемых морфологических структур достигли дефинитивного состояния. Сравниваемые выборки необходимо подбирать из животных сходного размера. Рекомендуемый объем выборки - 20 особей.
Подготовка и хранение материала. Отловленных особей рекомендуется усыплять эфиром. Удобнее всего для анализа использовать свежепойманный материал. При необходимости его можно хранить в замороженном виде, в 4% формалине или 70% этаноле. Хранение в этаноле предпочтительнее, так как при длительном хранении в формалине, окраска лягушек темнеет, что в дальнейшем делает анализ окраски невозможным. Правильно фиксированный материал сохраняет окраску и признаки остеологии на протяжении десятков лет.
Млекопитающие
Сбор материала. При оценке ситуации на текущий момент, необходимы выборки молодых особей этого года рождения, в других случаях для анализа пригодны особи разного возраста. Рекомендуемая выборка - 20 особей. При сборе материала предпочтительнее использование живоловок или ловчих канавок, т.к. другие орудия отлова могут повреждать материал, что особенно нежелательно при малой численности животных. При интерпретации результатов необходимо учитывать, что полученные оценки стабильности развития по краниологическим признакам отражают воздействие на момент формирования исследованных признаков (период пренатального онтогенеза и ранние этапы постнатального развития) и не подвержены дальнейшим возрастным изменениям.
Подготовка и хранение материала. Материал до обработки хранят в замороженном виде. При отсутствии такой возможности для фиксации можно использовать 70% этанол или 4% формалин. Для изучения асимметрии у мелких млекопитающих используют черепной материал. Головы отделяют от тушек и вываривают в воде. Время вываривания зависит от способа и времени консервирования, а также возраста и вида животного (для мышевидных грызунов порядка 50 минут) и в каждом конкретном случае определяется опытным путем. Далее удаляют мягкие ткани с костей черепа при помощи глазного пинцета, препаровальных игол, зубной щетки с жесткой щетиной и глазного скальпеля. Качество очистки черепа контролируют под бинокуляром. Костный материал не требует особых условий хранения. Он может сохраняться длительное время. Материал должен быть снабжен этикеткой с указанием места и времени сбора материала и при необходимости другой информацией.
Выполнение исследований
Растения
При выполнении исследований выполняют следующие операции.Для измерения лист березы помещают пред собой брюшной (внутренней) стороной вверх. Брюшной стороной листа называют сторону листа, обращенную к верхушке побега. С каждого листа снимают показатели по пяти промерам с левой и правой сторон листа (рис. 1).
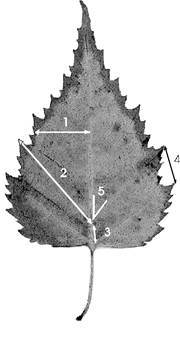
|
Рисунок 1. Схема морфологических признаков, использованных для оценки стабильности развития березы повислой (Betula pendula)
1- ширина левой и правой половинок листа. Для измерения лист складывают пополам, совмещая верхушку с основанием листовой пластинки. Потом разгибают лист и по образовавшейся складке измеряется расстояние от границы центральной жилки до края листа.
2 - длина жилки второго порядка, второй от основания листа.
3 - расстояние между основаниями первой и второй жилок второго порядка.
4 - расстояние между концами этих же жилок.
5 - угол между главной жилкой и второй от основания листа жилкой второго порядка.
Для исследований требуются циркуль-измеритель, линейка и транспортир. Промеры 1 - 4 снимаются циркулем-измерителем, угол между жилками (признак 5) измеряется транспортиром. Для этого центр основания окошка транспортира совмещают с точкой ответвления второй жилки второго порядка от центральной жилки. Эта точка соответствует вершине угла. Кромку основания транспортира надо совместить с лучом, идущим из вершины угла и проходящим через точку ответвления третьей жилки второго порядка. Второй луч, образующий измеряемый угол, получают, используя линейку. Этот луч идет из вершины угла и проходит по касательной к внутренней стороне второй жилки второго порядка. Результаты исследований заносятся в таблицу (образец таблицы см. в разделе 9. Обработка результатов исследований.).
Рыбы
Для оценки уровня стабильности развития при ихтиологических исследованиях используется 6-8 легко учитываемых признаков, таких как число лучей парных плавников, число тычинок на первой жаберной дуге (дополнительно можно учитывать тычинки и на остальных жаберных дугах), число чешуй в боковой линии и др. На рис. 2 приведена система морфологических признаков, используемая для оценки стабильности развития леща и плотвы.
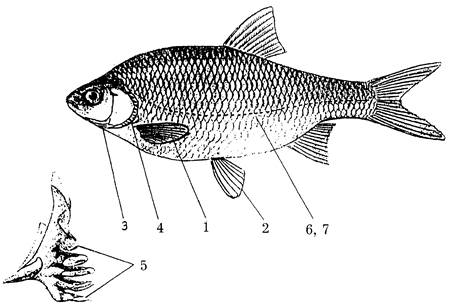
|
Рисунок 2. Схема морфологических признаков леща (Abramis brama) и плотвы (Rutilus rutilus)* для оценки стабильности развития.
1-7 - меристические признаки:
1 - число лучей в грудных плавниках;
2 - число лучей в брюшных плавниках;
3 - число лучей в межжаберной перегородке;
4 - число жаберных тычинок на 1-й жаберной дуге;
5 - число глоточных зубов;
6 - число чешуй в боковой линии;
7 - число чешуй боковой линии, прободенных сенсорными канальцами.
* У плотвы не учитывается признак 5 в связи с направленностью асимметрии этого признака.
У ряда видов (например, у щуки) учитывают количество хемипор на разных участках головы, а у окуня, кроме того, учитывают число шипов (выростов) на преджаберной крышке. Перечни морфологических признаков, используемых для оценки стабильности развития у золотого и серебряного карася, щуки, окуня, бычка-зеленчака, приведены в Приложении 1. Для учета всех признаков необходим бинокуляр.
Земноводные
Для анализа используют две группы признаков – меристические признаки окраски и остеологии (рис. 3). При работе с группой европейских зеленых лягушек - озерной лягушкой (Rana ridibunda), прудовой лягушкой (Rana lessonae), гибридной формой (Rana esculenta) используются такие признаки как число полос и пятен на бедре, голени и стопе, число пятен на спине, число белых пятен на плантарной стороне второго, третьего и четвертого пальцев задней конечности, число пор на плантарной стороне четвертого пальца задней конечности, число зубов на межчелюстной кости и сошнике.
При проведении анализа следует учитывать ряд трудностей:
· Не учитывается мелкий крап.
· При работе с признаками 1-6, бывает трудно отличить пятно от полосы. Полосой следует считать тот элемент рисунка, длина которого по крайней мере в два раза превышает ширину.
· Пятна спины, расположенные между центральной линией и дорзолатеральной железой следует учитывать от основания головы до подвздошной кости, так как дальше часто располагается множество мелких пятен, точный учет которых затруднителен.
· Следует учитывать только наиболее крупные поры на плантарной поверхности четвертого пальца. Число таких пор обычно бывает не больше пятнадцати.
· Место соединения межчелюстной кости и верхнечелюстной кости определить достаточно легко, так как соединение это подвижно.
· При подсчете числа зубов следует помнить, что у амфибий происходит смена зубов в связи с чем, одного или нескольких зубов может не хватать, однако, это довольно легко определить по большому расстоянию между зубами. Такой пропуск в зубном ряду следует учитывать как зуб.
Для учета признаков 8-13 необходим бинокуляр. Схема морфологических признаков для травяной лягушки (Rana temporaria) приведена в Приложении 2.
Примечание.
Используя предлагаемый метод возможно проведение прижизненной оценки. При этом следует исключить признаки остеологии (признаки 12, 13) и признак 11 (рис. 3). Для получения достоверных результатов с помощью такой системы признаков минимальный размер анализируемой выборки следует увеличить до 30 особей.
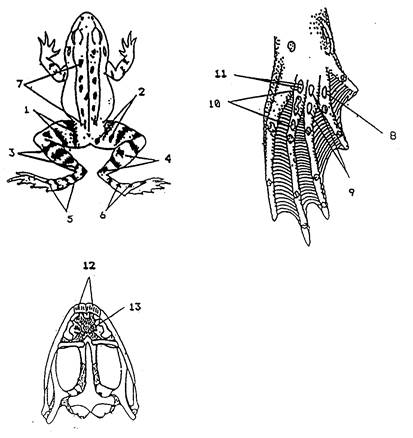
|
Рисунок 3. Схема признаков европейских зеленых лягушек (Rana esculenta complex): озерная лягушка - R. ridibunda Pallas; прудовая лягушка – R. Lessonae Camerano; гибридная форма - R. esculenta L. для оценки стабильности развития.
1-13 – меристические признаки:
1 - число полос на дорзальной стороне бедра;
2 - число пятен на дорзальной стороне бедра;
3 - число полос на дорзальной стороне голени;
4 - число пятен на дорзальной стороне голени;
5 - число полос на стопе;
6 - число пятен на стопе;
7 - число пятен на спине;
8 - число белых пятен на плантарной стороне второго пальца задней конечности;
9 - число белых пятен на плантарной стороне третьего пальца задней конечности;
10 - число белых пятен на плантарной стороне четвертого пальца задней конечности;
11 - число пор на плантарной стороне четвертого пальца задней конечности;
12 - число зубов на межчелюстной кости;
13 - число зубов на сошнике.
Млекопитающие
При изучении стабильности развития млекопитающих используются краниологические признаки, а именно число мелких отверстий для нервов и кровеносных сосудов на левой и правой сторонах черепа. Для учета всех признаков млекопитающих необходим бинокуляр. На рис. 4 приведена схема признаков рыжей полевки (Clethrionomys glareolus) и обыкновенной полевки (Microtus arvalis). Схемы признаков других видов млекопитающих приведены в Приложении 3.

|
Рисунок 4. Cхема морфологических признаков для оценки стабильности развития для рыжей полевки (Clethrionomys glareolus и обыкновенной полевки (Microtus arvalis).
1-10 - число мелких отверстий:
1 - на верхнечелюстной кости (в районе диастемы), перед коренными зубами;
2 - на скуловом отростке верхнечелюстной кости;
3 - на основной затылочной кости (перед подъязычным отверстием);
4 - подъязычное отверстие (вместе с дополнительными);
5 - на предчелюстной кости (над инфраорбитальным каналом);
6 - на латеральной поверхности лобной кости (позади слезной);
7 - в нижней части орбитальной поверхности лобной кости (над орбитальной вырезкой);
8 - в верхней части мозговой пластинки лобной кости под теменным гребнем;
9 - на чешуйчатой кости;
10 - на сосцовой части каменистой кости.