Алканы
Получние
1) Получение метана из природного газа
2) Крекинг нефи
CnH2n+2→ CmH2m+2 + Cn-mH2(n-m)
3) Из карбида алюминия
Al4C3 + H2O → Al(OH)3 + CH4
Al4C3 + HCl → AlCl3 + CH4
4) Из простых веществ
C + 2H2 →{t, Ni, p} CH4
5) Гидрирование непредельных углеводородов
CnH2n+ H2 →{t, Ni} CnH2n+2
CnH2n-2+ 2H2 →{t, Ni} CnH2n+2
6) Реакция Вюрца
2R-Br + 2Na→{t} R-R + 2NaBr
7) Из синтез-газа
nCO + (2n+1)H2→{t,Fe}CnH2n+2+ nH2O
CO + 3H2→{300℃, Ni, p}CH4 + H2O
8) Декарбоксилирование‒ реакция Дюма
R-COONa(тв) + NaOH(тв)→{t}R-H + Na2CO3
9) Электролиз солей карбоновых кислот – электролиз по Кольбе
2R-COONa + 2H2O →{эл. ток}R-R + 2CO2 + H2 + 2NaOH
Химические свойства
1) Галогениерование
R-H + Cl2 →{h󠇟v} R-Cl + HCl
2) Нитрование – реакция Коновалова
R-H + HNO3→{150℃}R-NO2 + H2O
3) Сульфохлорирование
R-H + SO2 + Cl2→{h󠇟v}R-(O)S(O)-Cl + HCl
4) Крекинг
CnH2n+2→ CmH2m+2 + Cn-mH2(n-m)
5) Изомеризация
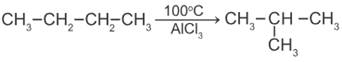
6) Окисление
R-CH3 + [O] →{t, kat}R-CH2-OH
R-CH3 + [O] →{t, kat}R-CH(O)
R-CH3 + [O] →{t, kat}R-C(O)-OH
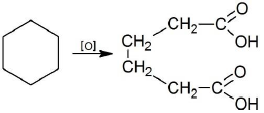
R-CH2CH2-R’ + O2→{(CH3COO)2Mn, 100-150℃}R-COOH + R’-COOH
CnH2n+2 + ((3n+1)/2)O2 → nCO2 + (n+1)H2O
7) Реакции отщепления
CH4→{t}C + 2H2
2CH4→{1500℃}CH≡CH + 3H2
CH3-CH3→{t}CH2=CH2 + H2
8) Паровая конверсия
CnH2n+2+ nH2O → nCO + (2n+1)H2
CH4 + H2O → CO + H2
9) Дегидроциклизация
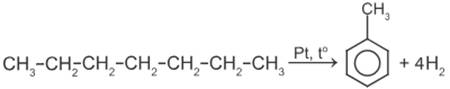
Алкены
Получение
1) Крекинг алканов
CnH2n+2→{t}CmH2m+2 + Cn-mH2(n-m)
2) Дегидрирование алканов
CnH2n+2 →{Cr2O3, 500℃} CnH2n + H2
3) Внутримолекулярная дегидратация спиртов
CH3CH2CH2-OH →{H2SO4(k), >140℃} CH3CH=CH2 + H2O
4) Дегидрогалогенированиемоногалогеналканов
CH3-CH(Cl)-CH2CH3 + KOH→{спирт} CH3-CH=CH-CH3 + KCl + H2O
5) Дегалогенированиедигалогеналканов
CH3-CH(Cl)-CH2(Cl) + Zn/Mg→{t}CH3-CH=CH2 + ZnCl2/MgCl2
6) Реакция Г. Виттига
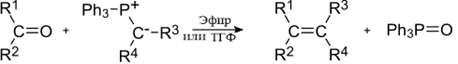
7) Элиминирование третичных аминов из гидроксидов тетраалкиламмония по А. Гофману
CH3-CH2(N(CH3)3I) →{AgOH, H2O, 150℃} CH2=CH2 + N(CH3)3 + H2O + AgI
8) Стереоселективное восстановление алкинов до цис- и транс- алкенов
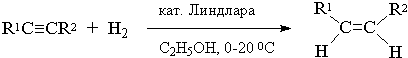 [1]
[1]
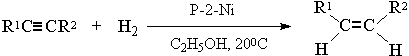 [2]
[2]
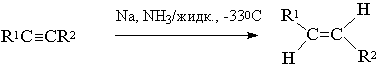
Химические свойства
1) Присоединение
1) + HCl, HBr
CH3-CH=CH2 + HCl → CH3-CH(Cl)-CH3
2) + H2O
CH3-CH=CH2 + H2O → CH3-CH(OH)-CH3
3) + Hal
CH3-CH=CH2 + Br2(p-p) → CH3-CH(Br)-CH2(Br)
4) + H2
CnH2n + H2 →{t, Ni} CnH2n+2
2) Замещение
CH2=CH-CH3 + Cl2 →{t} CH2=CH-CH2-Cl + HCl
3) Отщепление
CnH2n →{t, Ni} CnH2n-2 + H2
4) Полимеризация
nCH2=CH2 →{t} (-CH2-CH2-)n
nCH3-CH=CH2 →{t} (-CH(CH3)-CH2-)n
nCl-CH=CH2 →{t} (-CH(Cl)-CH2-)n
5) Гидроборирование
3R-CH=CH2 + BH3 → (R-CH2-CH2)3B
6) Окисление
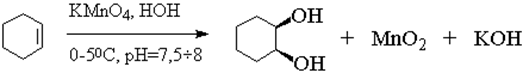
1) Мягкое окисление – реакция Вагнера
CH3-CH=CH2 + KMnO4 + H2O→{0℃} CH3-CH(OH)-CH2(OH) + MnO2 + KOH
2) Жёсткое окисление
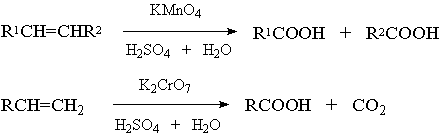
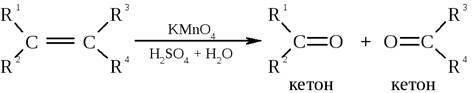
3) Частичное окисление кислородом воздуха
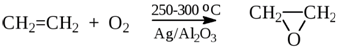
4) Каталитическое окисление
CH2=CH2 + O2→{200℃, CuCl2, PdCl2}CH3-CH=O
5) Полное окисление
CnH2n + (3n/2)O2 →{t} nCO2 + nH2O
7) Син-гидроксилирование
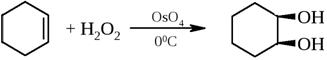
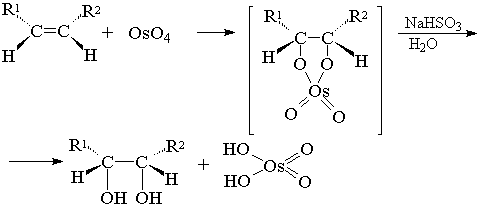
Алкины
Получение
1) Гидролиз карбида кальция
CaC2 + 2H2O → HC≡CH + Ca(OH)2
2) Термический крекинг метана
2CH4→{1500℃}HC≡CH + 3H2
3) Дегидрогалогенированиедигалогеналканов
CH2(Cl)-CH2(Cl) + 2KOH →{спирт, t} HC≡CH + 2KCl + 2H2O
CH3-(Cl)CH(Cl) + 2KOH →{спирт, t} HC≡CH + 2KCl + 2H2O
4) Из ацетиленидов
CH3-C≡C-Na + Br-CH2-CH3 →CH3-C≡C-CH2-CH3 + NaBr
Ag-C≡C-Ag + 2HCl → HC≡CH + 2AgCl
5) Электролиз солей непредельных карбоновых кислот
NaOOC-CH=CHCOONa + 2H2O → HC≡CH + 2CO2 + 2NaOH + H2
Химические свойства
1) Присоединение
1) + H2
HC≡CH + H2 →{Pt, 150℃} CH2=CH2
CH2=CH2 + H2 →{Pt, 150℃} CH3-CH3
2) + Hal
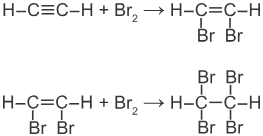
3) + HCl, HBr
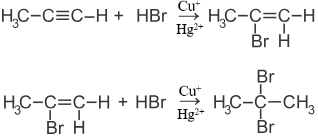
4) + Карбоновые кислоты
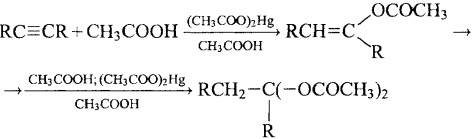
5) + H2O – реакция Кучерова
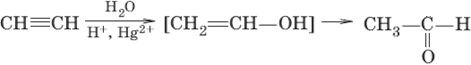
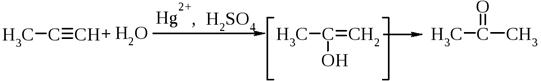
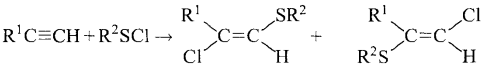
6) + R-SCl
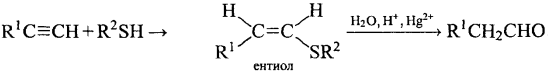
7) + R-SH
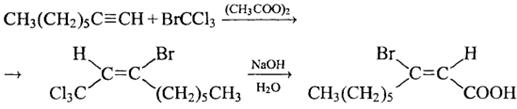
8) + BrCCl3
9) + HCN
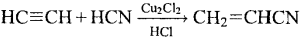
2) Полимеризация
1) Димеризация
2HC≡CH →{CuCl, NH4Cl} CH2=CH-C≡CH
CH2=CH-C≡CH + HCl → CH2=CH-C(Cl)=CH2
2) Тримеризация
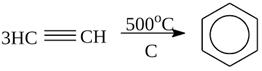
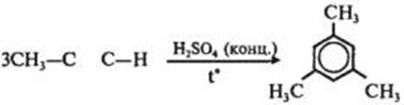
3) Ацетилен-алленовая перегруппировка и миграция тройной связи
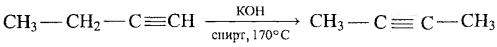
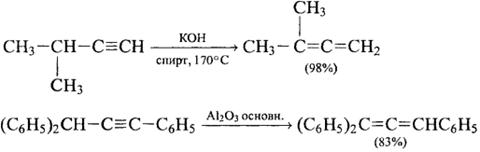
4) Окисление
1) Горение
CnH2n-2 + O2 → CO2 + H2O
2) Мягкоеокисление
HC≡CH + KMnO4 + H2O → HOOC-COOH + MnO2 + KOH
R1-C≡C-R2 →{KMnO4, H2O} R1-COOH + R2-COOH
CH3-C≡C-CH2-CH3 →{KMnO4, H2O, 0℃} CH3-C(O)-C(O)-CH2-CH3
3) Жёсткоеокисление
CH3-C≡CH + KMnO4 + H2SO4 → CH3-COOH + CO2 + K2SO4 + MnSO4 + H2O
CH3-C≡C-CH3 + KMnO4 + H2SO4 → 2CH3-COOH + K2SO4 + MnSO4 + H2O
HC≡CH + KMnO4 + H2SO4 → 2CO2 + K2SO4 + MnSO4+ H2O
5) Образованиесолей
HC≡CH + Na → HC≡C-Na + H2
HC≡CH + [Ag(NH3)2]OH → Ag-C≡C-Ag + NH3 + H2O
R-C≡CH + [Cu(NH3)2]Cl → R-C≡C-Cu + NH4Cl + NH3
Алкадиены
Получение
1) Дегидрирование алканов
CH3-CH2-CH2-CH3 →{Cr2O3, Al2O3, t}CH2=CH-CH=CH2 + 2H2
CH3-CH(CH3)-CH2-CH3 →{Cr2O3, Al2O3, t}CH2=C(CH3)-CH=CH2 + 2H2
2) Дегидрирование и дегидратация спиртов – реакция Лебедева
CH3-CH2-OH + HO-CH2-CH3 →{MnO, ZnO, t} CH2=CH-CH=CH2 + H2O + H2
3) Дегидрогалогенированиедигалогеналканов
CH2(Cl)-CH2-CH(Cl)-CH3 + 2KOH →{спирт} 2KCl + 3H2O + CH2=CH-CH=CH2
4) Восстановление диинов
R1-C≡C-C≡C-R2 + 2H2 →{Ni, C2H5OH, 20℃} R1-CH=CH-CH=CH-R2
Химические свойства
1) Присоединение
1) +H2
CH2=CH-CH=CH2 + H2 ↓→ CH3-CH=CH-CH3
CH3-CH2-CH=CH2
CH2=CH-CH=CH2 + 2H2 →{Pt,t} CH3-CH2-CH2-CH3
2) +Hal
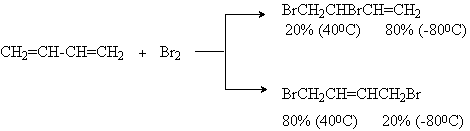
3) +HBr, HCl
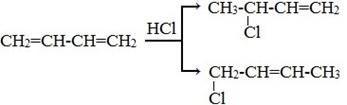
2) Полимеризация
nCH2=CH-CH=CH2 → (-CH2-CH=CH-CH2-)n
nCH2=C(CH3)-CH=CH2 → (-CH2-C(CH3)=CH-CH2-)n
nCH2=C(Cl)-CH=CH2 → (-CH2-C(Cl)=CH-CH2-)n
3) Диеновый синтез – реакция Дильса-Альдера
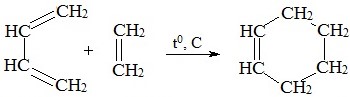
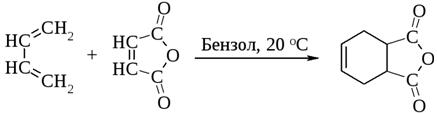
4) Окисление
CH2=CH-CH=CH2 + O2 → CO2 + H2O
CH2=CH-CH2-CH=CH2 + KMnO4 + H2SO4 → HOOC-CH2-COOH + 2CO2 + K2SO4 + + MnSO4 + H2O
Циклоалканы
Получение
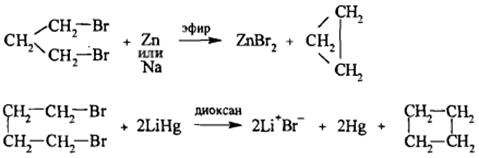
1)  Дегалогенированиедигалогеналканов
Дегалогенированиедигалогеналканов
Cl-CH2CH2CH2-Cl + Mg/Zn →{t} + MgCl2/ZnCl2
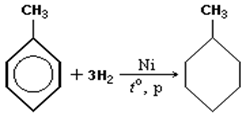
2) Гидрирование аренов
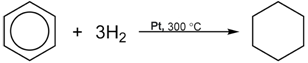
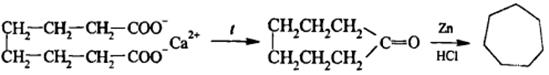
3) Циклизация углеродной цепи пиролизом кальциевых солей адипиновой (CH2)4(COOH)2, пимелиновой (CH2)5(COOH)2, пробковой (CH2)6(COOH)2 кислот с последующим восстановлением кетонов.
4) Из природных соединений
Химические свойства
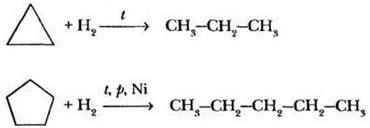
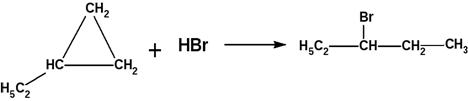
1) Присоединение (характерно для малых циклов)
1) + H2
2) + Hal
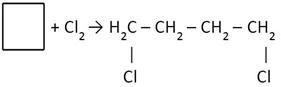
3) + галогенводороды

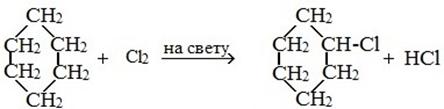
2) Замещение (характерно бля больших циклов)
1) Галогенирование
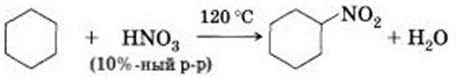
2) Нитрование
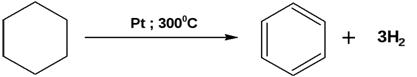
3) Отщепление – дегидрирование
4) Окисление

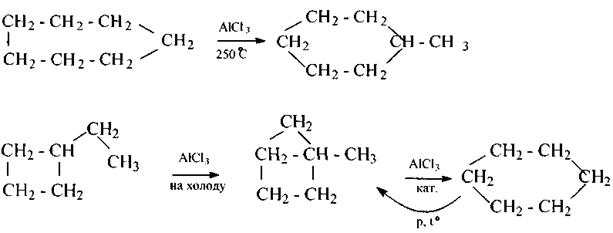
5) Изомеризация
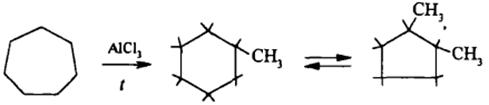
Ароматические углеводороды (Арены)
Получение
1) Коксование угля с последующей перегонкой каменноугольной смолы
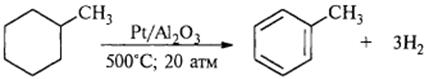
2) Дегидрирование циклогексана и его гомологов
3) Дегидроизомеризация гомологов циклопентана
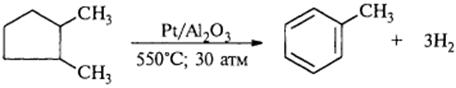
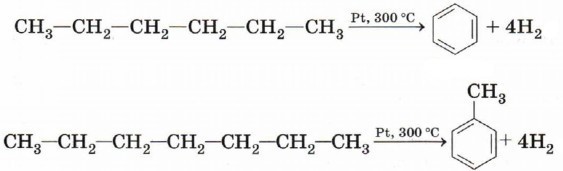
4) Дегидроциклизацияалканов, имеющих 6 и более атомов углерода
5) Тримеризацияалкинов
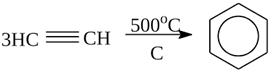
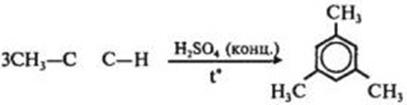
6) Реакция Вюрца-Фиттига
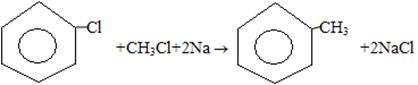
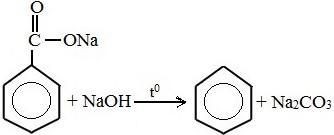
7) Сплавление солей бензойной кислоты с твёрдыми щелочами
8) Алкилирование бензола
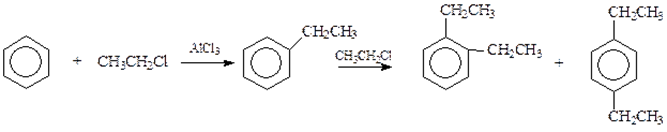
9) Получение бензола из толуола
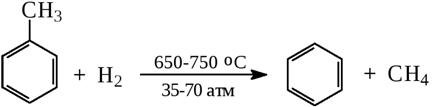
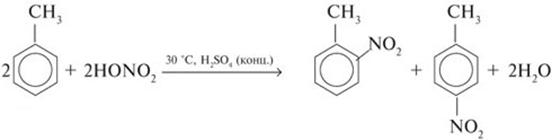
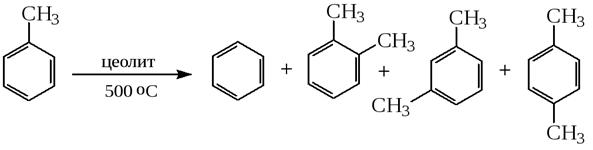
10) Диспропорционирование толуола
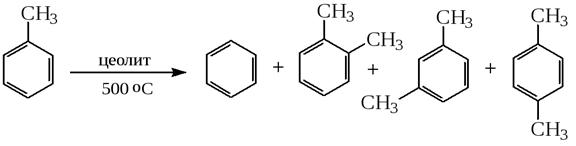
Химические свойства
1) Замещение
1) Галогенирование
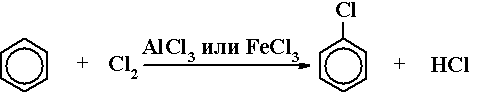
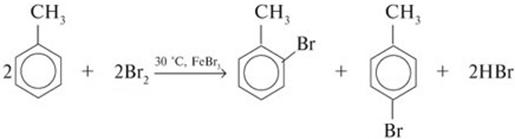
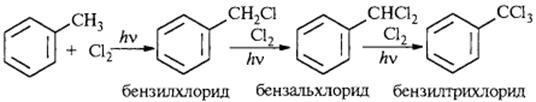
2) Нитрование
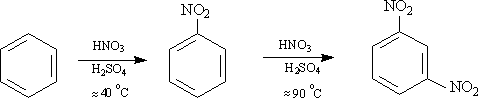
3) Алкилированиеалканами – реакция Фриделя-Крафтса
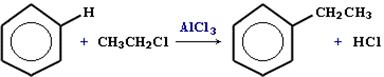
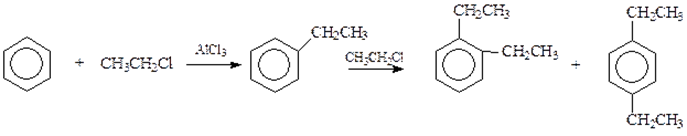
4) Алкилированиеалкенами
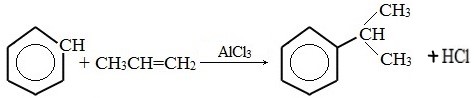
2) Присоединение
1) + H2

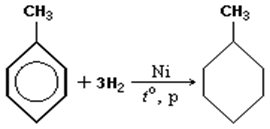
2) + Hal
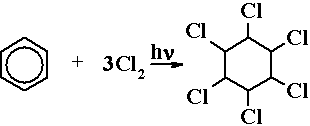
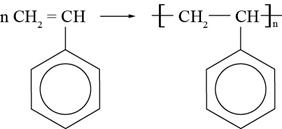
3) Полимеризация
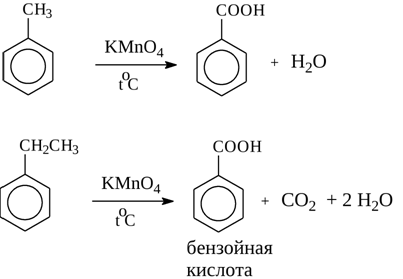
4) Окисление
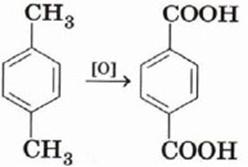
5) Диспропорционирование толуола
6) Гидрирование толуола

Фенолы
Получение
1) Из каменноугольной смолы
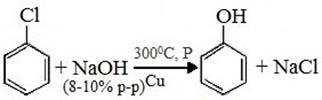
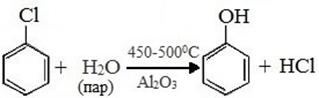
2) Из галогенбензола
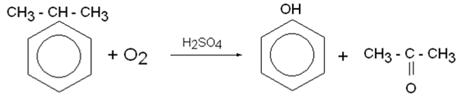
3) Кумольный способ получения
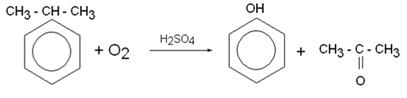
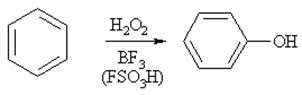
4) Электрофильноегидроксилированиеаренов
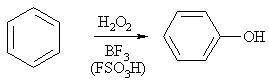
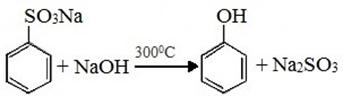
5) Из солей ароматических сульфокислот
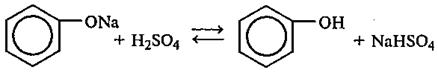
6) Из фенолята натрия
Химические свойства
1) Взаимодействие с активными металлами
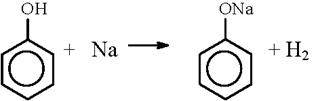
2) Взаимодействие со щелочами
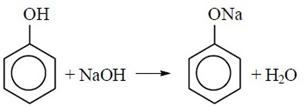
3) Взаимодействие с хлорангидридами кислот
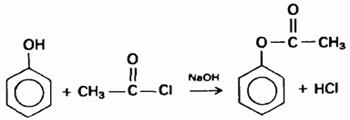
4) Галогенирование
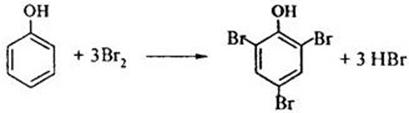
5) Нитрование
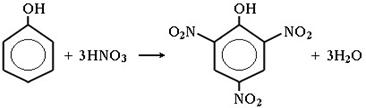
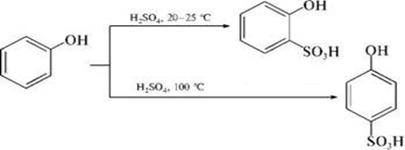
6) Сульфирование
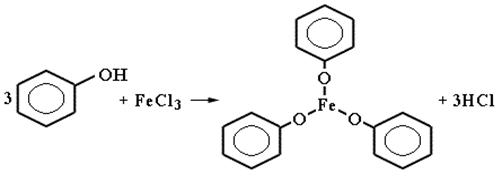
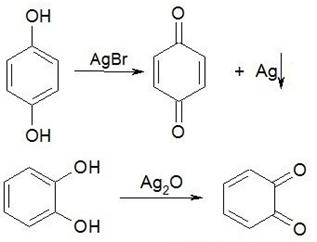
7) Взаимодействие с хлоридом железа(III) – качественная реакция
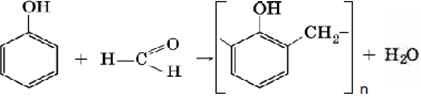
8) Поликондесация с формальдегидом
9) Гидрирование
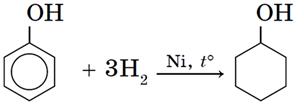
10) Окисление
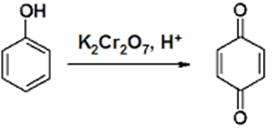
Одноатомные спирты
Получение
1) Из синтез-газа
CO + 2H2 →{p, t, kat} CH3-OH
2) Гидратация этилена
CH2=CH2 + H2O →{t, H3PO4} CH3-CH2-OH
3) Из галогеналканов
CH3-CH2-Cl + KOH(водн.) → CH3-CH2-OH + KCl
4) Восстановление карбонильных соединений
R-CH=O + H2 → R-CH2-OH
R-C(O)-R’ + H2 → R-CH(OH)-R’
5) Брожение глюкозы
C6H12O6 + дрожжи →2C2H5OH + 2CO2
6) Каталитическое окисление алканов
CH4 + [O] →{t, kat} CH3-OH
7) Гидролиз сложных эфиров карбоновых кислот в щелочной среде
R-COOR’ + NaOH → R-COONa + R’-OH
Химические свойства
1) Взаимодействие с активными металлами
CH3-CH2-OH + Na → CH3-CH2-ONa + H2
2) Взаимодействие с галогенводородами
CH3-CH2-OH + HBr →{H2SO4(k)} CH3-CH2-Br + H2O
3) Дегидратация
1) Внутримолекулярная
CH3-CH2-OH →{t>140℃, H2SO4(k)} CH2=CH2 + H2O
2) Межмолекулярная
CH3-CH2-OH + HO-CH2-CH3 →{t<140℃, H2SO4(k)} CH3-CH2-O-CH2-CH3 + H2O
4) Дегидрирование
CH3-CH2-OH →{Cu, t} CH3-CH=O + H2
CH3-CH(OH)-CH3 →{Cu, t} CH3-C(O)-CH3 + H2
5) Окисление
R-OH + O2 → CO2 + H2O
CH3-CH2-OH + CuO →{t} CH3-CH=O + Cu + H2O
CH3-CH2-OH + KMnO4 + H2SO4 → CH3-COOH + K2SO4 + MnSO4 + H2O
CH3-CH2-OH + K2Cr2O7 + H2SO4 → CH3-CH=O + K2SO4 + Cr2(SO4)3 + H2O
CH3-CH2-OH + K2Cr2O7 + H2SO4 → CH3-COOH + K2SO4 + Cr2(SO4)3 + H2O
CH3-CH(OH)-CH3 →{Na2Cr2O7, t, H+} CH3-C(O)-CH3 + H2O
6) Взаимодействие с альдегидами
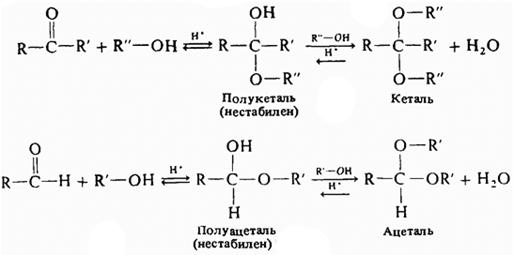
7) Взаимодействие с аммиаком
CH3-CH2-OH + NH3 →{t, kat} CH3-CH2-NH2 + H2O
8) Дегидрирование и дегидратация – реакция Лебедева
2CH3-CH2-OH →{t, kat} CH2=CH-CH=CH2 + H2 + 2H2O
Многоатомные спирты
Получение
1) Каталитическая гидратация оксида этилена
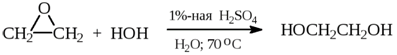
2) Из дигалогеналканов
R-CH(Cl)-CH2-Cl + NaOH(водн.)→ R-CH(OH)-CH2-OH + NaCl
3) Изсинтез-газа
2CO + 3H2 →{250℃, kat, 200МПа} HO-CH2-CH2-OH
4) Мягкоеокислениеалкенов
R-CH=CH2 + KMnO4 + H2O → R-CH(OH)-CH2-OH + MnO2 + KOH
5) Омыление жиров
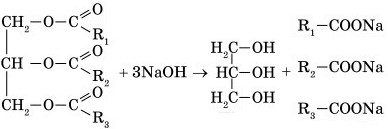
Химические свойства
1) Взаимодействие с активными металлами
HO-CH2-CH2-OH + 2Na → NaO-CH2-CH2-ONa + H2
2) Взаимодействие со щелочами
HO-CH2-CH2-OH + 2NaOH → HO-CH2-CH2-ONa + H2O
3) Взаимодесйтвие с гидроксидом меди(II)
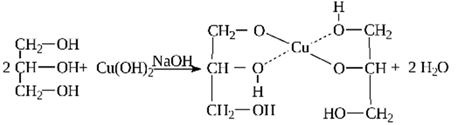
4) Взаимодействие с галогенводородами
HO-CH2-CH2-OH + 2HCl → Cl-CH2-CH2-Cl + 2H2O
5) Взаимодействие с азотной кислотой
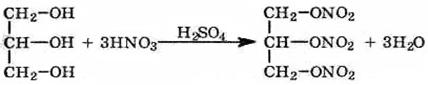
6) Взаимодействие с высшими органическими кислотами
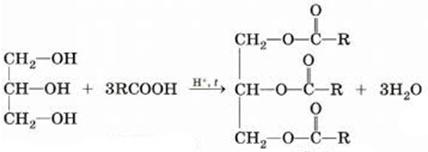
7) Межмолекулярная дегидратация
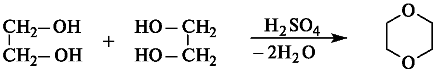
8) Внутримолекулярная дегидратация
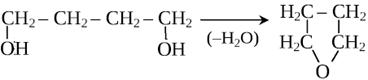
9) Реакция поликонденсации
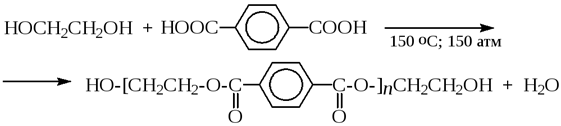
Альдегиды
Получение
1) Окисление спиртов
CH3-CH2-OH + CuO →{300℃} CH3-CH=O + Cu + H2O
CH3-OH + O2 →{650℃, Ag, p} H-CH=O + H2O
2) Дегидрирование спиртов
CH3-CH2-OH →{t, Ni} CH3-CH=O + H2
3) Каталитическое окисление метана
CH4 + O2 →{500℃, kat} H-CH=O + H2O
4) Каталитическое окисление этилена
CH2=CH2 + O2 →{PdCl2, CuCl2} CH3-CH=O
5) Гидратация ацетилена
HC≡CH + H2O →{t, H+, Hg2+} CH3-CH=O
6) Щелочной гидролиз дигалогеналканов
CH3-CH(Cl)-Cl + KOH(водн.)→{t} CH3-CH=O + KCl + H2O
Химические свойства
1) Реакция «Серебряного зеркала»
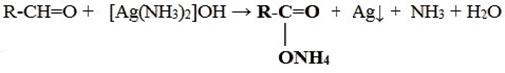
2) Окисление гидроксидом меди(II)
CH3-CH=O + Cu(OH)2 →{t} CH3-COOH + Cu2O + H2O
CH3-CH=O + Cu(OH)2 + NaOH → CH3-C(O)-ONa + Cu2O + H2O
H-CH=O + Cu(OH)2 + NaOH → Na2CO3 + Cu2O + H2O
3) Восстановление водородом
CH3-CH=O + H2 →{t, kat} CH3-CH2-OH
4) Гидратация (только формальдегид и уксусный альдегид)
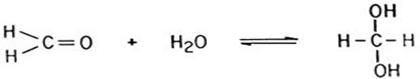
5) Присоединение синильной кислоты
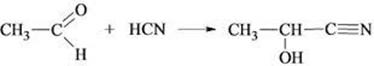
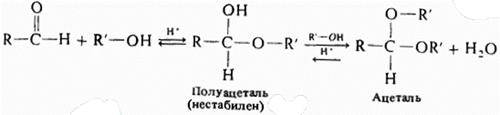
6) Присоединение спиртов
7) Присоединение гидросульфита натрия
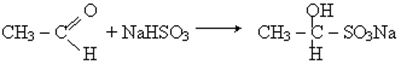
8) Поликонденсация с фенолом
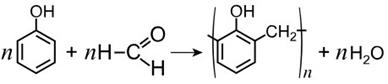
9) Окисление
R-CH=O + O2 → CO2 + H2O
CH3-CH=O + KMnO4 + H2SO4 →{t} CH3-COOH + MnSO4 + K2SO4 + H2O
H-CH=O + KMnO4 + H2SO4 →{t} CO2 + MnSO4 + K2SO4 + H2O
10) Галогенирование
CH3-CH2-CH=O + Cl2 → CH3-CH(Cl)-CH=O + HCl
11) Взаимодействие с реактивом Гриньяра
H-CH=O + CH3-Mg-Cl → CH3-CH2-O-Mg-Cl
CH3-CH2-O-Mg-Cl + H2O → CH3-CH2-OH + Mg(OH)Cl
12) Взаимодействие с аммиаком
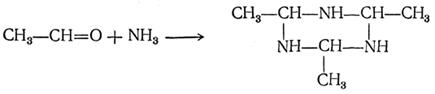
13) Полимеризация формальдегида
nH-CH=O + H2O →{t, kat} (-O-CH2-)
14) Тримеризация формальдегида
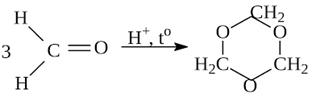
Кетоны
Получение
1) Окисление спиртов оксидом меди(II)
CH3-CH(OH)-CH3 + CuO→{300℃}CH3-C(O)-CH3 + Cu + H2O
2) Дегидрирование спиртов
CH3-CH(OH)-CH3→{t, Ni}CH3-C(O)-CH3 + H2
3) Щелочной гидролиз дигалогеналканов
CH3-(Cl)C(Cl)-CH3 + KOH(водн.)→{t} CH3-C(O)-CH3 + KCl + H2O
4) Каталитическое окисление алкенов
CH3-CH=CH2 + O2→{PdCl2, CuCl2}CH3-C(O)-CH3
5) Гидратация алкинов
CH3-C≡CH + H2O→{t, H+, Hg2+}CH3-C(O)-CH3
6) Из солей карбоновых кислот
(CH3-COO)2Ca(тв) →{t} CH3-C(O)-CH3 + CaCO3
(C2H5-COO)2Ba(тв) →{t} C2H5-C(O)-C2H5 + BaCO3
7) Получение ацетона из кумола
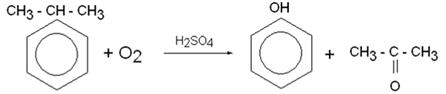
Химические свойства
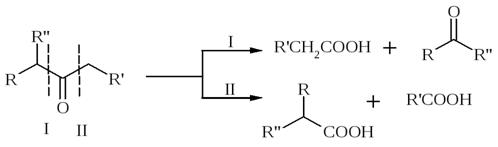
1) Восстановление
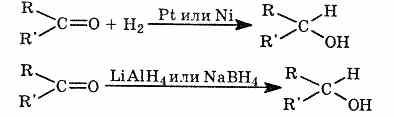
2) Присоединение синильной кислоты
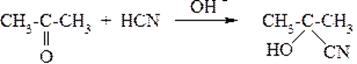
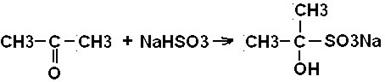
3) Присоединение гидросульфита натрия
4) Альдольная конденсация – реакция Клайзена-Шмидта
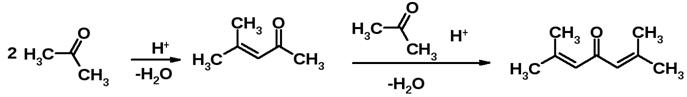
5) Окисление
R-C(O)-R’ + O2 → CO2 + H2O
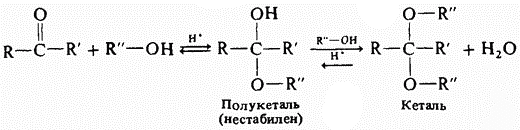
6) Присоединение спиртов
Карбоновые кислоты
Получение
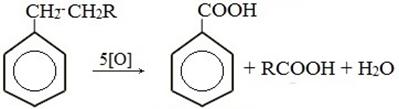
1) Жёсткое окисление алканов, алкенов, алкинов, алкадиенов, аренов, альдегидов, спиртов
CH3CH2CH2CH3 + KMnO4 + H2SO4 → 2CH3-COOH + K2SO4 + MnSO4 + H2O
CH3-CH=CH2 + KMnO4 + H2SO4→{>100℃}CH3-COOH + CO2 + K2SO4 +MnSO4+ H2O
CH3-C≡C-CH3 + KMnO4 + H2SO4 → 2CH3-COOH + K2SO4 + MnSO4 + H2O
CH2=CH-CH2-CH=CH2 + KMnO4 + H2SO4 → HOOC-CH2-COOH + 2CO2 + K2SO4 + + MnSO4 + H2O
CH3-CH=O + KMnO4 + H2SO4 →{t} CH3-COOH + MnSO4 + K2SO4 + H2O
CH3-CH=O + Cu(OH)2 →{t} CH3-COOH + Cu2O + H2O
CH3-CH2-OH + K2Cr2O7 + H2SO4 → CH3-COOH + K2SO4 + Cr2(SO4)3 + H2O
2) Из метанола и угарного газа
CH3-OH + CO →{0,1 МПа,kat, t} CH3-COOH
3) Из угарного газа и щёлочи
CO + NaOH →{0,6-0,8МПа, t} HCOONa
HCOONa + H2SO4 → HCOOH + NaHSO4
4) Гидролиз сложных эфиров
R-COOR’ + H2O →{H2SO4, t} R-COOH + R’-OH
5) Из солей карбоновых кислот
R-COONa + HCl → R-COOH + NaCl
6) Растворение ангидридов карбоновых кислот
(R-CO)2O + H2O → 2R-COOH
7) Щелочной гидролиз галогенпроизводных карбоновых кислот
R-C(Cl)=O + NaOH → R-COOH + NaCl
8) Щелочной гидролиз тригалогенпроизводных углеводородов
R-CCl3 + NaOH → R-COOH + NaCl + H2O
9) Уксусную кислоту получают из продуктов пиролиза древесины
10) Использование реактива Гриньяра
R-Mg-Br + CO2 → R-COO-MgBr
R-COO-MgBr + H2O → R-COOH + Mg(OH)Br
Химические свойства
1) Диссоциация в водном растворе
HCOOH ↔ H+ + HCOO-
2) Взаимодействие с активными металлами
2CH3-COOH + Mg → (CH3-COO)2Mg + H2
3) Взаимодействие с основными и амфотерными оксидами и гидроксидами
2HCOOH + MgO → (HCOO)2Mg + H2O
CH3-COOH + NaOH → CH3-COONa + H2O
4) Взаимодействие с солями более слабых и летучих кислот
2CH3-COOH + CaCO3 → (CH3COO)2Ca + CO2 + H2O
5) Получение ангидридов
2CH3-COOH →{P2O5} CH3-C(O)-O-C(O)-CH3
6) Взаимодействие со спиртами
CH3-COOH + HO-C5H11 →{H2SO4, t} CH3-C(O)-O-C5H11 + H2O
7) Взаимодействие с галогенами
R-CH2-COOH + Cl2 →{Pкрасный} R-CH(Cl)-COOH + HCl
8) Взаимодействие с аммиаком
R-COOH + NH3 → R-COONH4 →{t} R-C(O)-NH2 + H2O
9) Взаимодействие с хлоридом фосфора(V)
R-COOH + PCl5 → R-CO-Cl + POCl3 + HCl
10) Гидрирование
CH3-COOH + H2 → CH3-CH=O + H2O
11) Окисление
R-COOH + O2 → CO2 + H2O