1) Реакция «Серебряного зеркала»
HCOOH + [Ag(NH3)2]OH → (NH4)2CO3 + Ag + NH3 + H2O
2) Разложение
HCOOH →{H2SO4(k), t} CO + H2O
3) Окислениехлором
HCOOH + Cl2 → CO2 + 2HCl
4) Окислениеоксидоммеди(II)
HCOOH + CuO →{t} Cu2O + CO2 + H2O
Химические свойства солей карбоновых кислот
1) Гидролиз в водных растворах
R-COONa +H2O → R-COOH + NaOH
2) Электролиз
2R-COONa + 2H2O →{эл. ток}R-R + 2CO2 + H2 + 2NaOH
3) Взаимодействие с сильными минеральными кислотами
R-COONa + HCl → R-COOH + NaCl
4) Декарбоксилирование
R-COONa + NaOH →{t} Na2CO3 + R-H
5) Разложение
(CH3COO)2Ca →{t} CH3-C(O)-CH3 + CaCO3
6) Образование амидов
CH3-C(O)-ONH4 →{t} CH3-C(O)-NH2 + H2O
CH3-C(O)-NH2→{P2O5}CH3-C≡N + H2O
Простые эфиры
Получение
1) Действие алкоголятов на алкилгалогениды – реакция Уильямсона
CH3CH2-ONa + CH3-I → CH3CH2-O-CH3 + NaI
2) Межмолекулярная дегидратация спиртов
CH3-CH2-OH + HO-CH2-CH3 →{t<140℃, H2SO4(k)} CH3-CH2-O-CH2-CH3 + H2O
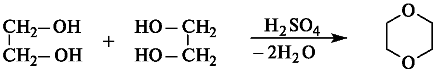
3) Внутримолекулярная дегидратация спиртов
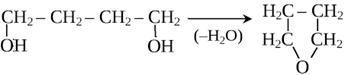
Химические свойства
1) Взаимодействие с галогенводородами
CH3CH2-O-CH2CH3 + HI →{tкомн}CH3CH2-OH + CH3CH2-I
CH3CH2-O-CH2CH3 + HI →{нагр}2CH3CH2-I + H2O
2) Взаимодействие с активными металлами
CH3CH2-O-CH2CH3 + 2Na →{t} CH3CH2-ONa + CH3CH2-Na
3) Взаимодействие с галогенами
CH3CH2-O-CH2CH3 + Cl2 →{-20℃, hv} CH3-CH(Cl)-O-CH2-CH3 + HCl
CH3-CH(Cl)-O-CH2-CH3 + Cl2 →{-20℃, hv} CH3-CH(Cl)-O-CH(Cl)-CH3 + HCl
4) Взаимодействие с серной кислотой
CH3CH2-O-CH2CH3 + H2SO4 → CH3CH2-O-SO3H + CH3CH2-OH
5) Окисление
CH3CH2-O-CH2CH3 + O2 →{hv} CH3-CH(-O-OH)-O-CH2CH3
R-O-R’ + O2 → CO2 + H2O
Сложные эфиры
Получение
1) Этерификация
R-COOH + R’-OH →{H2SO4, t} R-C(O)-O-R’ + H2O
2) Взаимодействие ангидридов со спиртами
(CH3CO)2O + 2CH3CH2-OH → 2CH3-C(O)-O-CH2CH3 + H2O
3) Взаимодействие солей карбоновых кислот с алкилгалогенидами
R-C(O)-ONa + R’-Cl → R-C(O)-O-R’ + NaCl
4) Присоединение карбоновых кислот к алкенам
R-COOH + R'-CH=CH-R'' →{AlCl3, FeCl3} R-C(O)-O-CH-R’-CH2-R’’
Химические свойства
1) Гидролиз
R-C(O)-O-R’ + H2O ↔ R-COOH + R’-OH
R-C(O)-O-R’ + NaOH(водн) →{t} R-C(O)-ONa + R’-OH
2) Взаимодействие с аммиаком
R-C(O)-O-R’ + NH3 → R-C(O)-NH2 + R’-OH
3) Взаимодействие со спиртами
R-C(O)-O-R’ + R’’-OH↔R-C(O)-O-R’’ + R’-OH
4) Восстановление водородом
R-C(O)-O-R’ + H2 → R-CH2-OH + R’-OH
5) Окисление
R-C(O)-O-R’ + O2 → CO2 + H2O
6) Сложные эфиры, имеющие в своём составе непредельную кислоту или спирт, способны к реакциям присоединения
Жиры
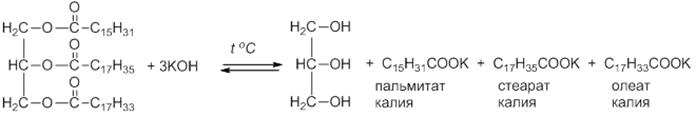
Получение
Взаимодействие глицерина с карбоновыми кислотами
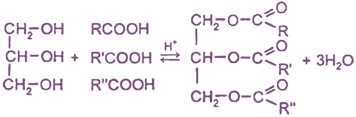
Химические свойства
1) Гидролиз
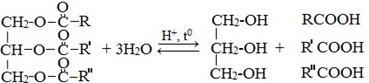
2) Восстановление водородом
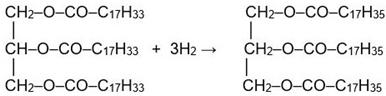
Амины
Получение
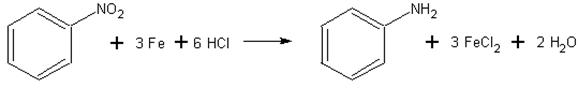
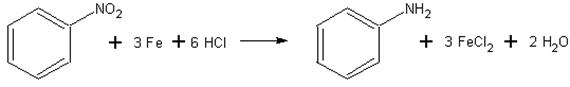
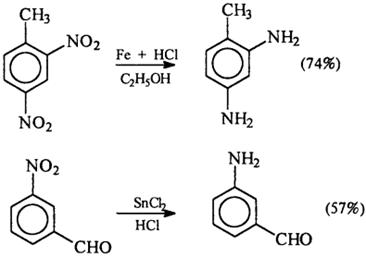
1) Восстановление нитросоединений
R-NO2 + [H] → R-NH2 + H2O
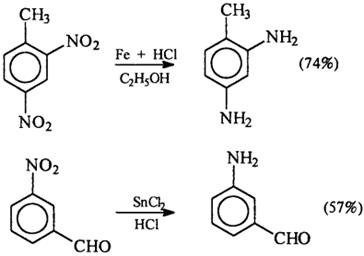
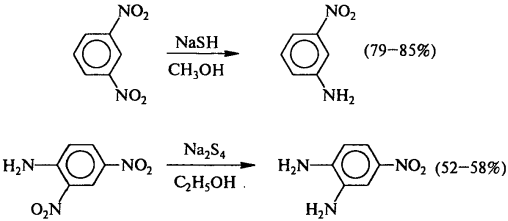
2) Взаимодействие спирта с аммиаком
R-OH + NH3 →{Al2O3, 300℃} R-NH2 + H2O
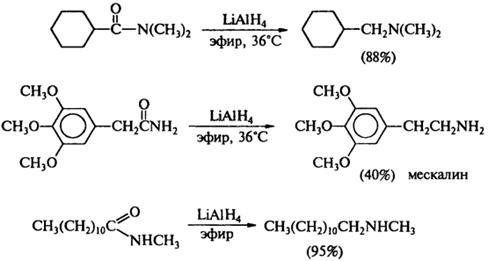
3) Восстановление амидов
R-C(O)-NH2 + [H] → R-CH2-NH2 + H2O
R-C(O)-NH-R’ + [H] → R-CH2-NH-R’ + H2O
R-C(O)-N(R’)-R’’ + [H] → R-CH2-N(R’)-R’’ + H2O
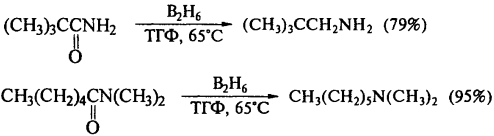
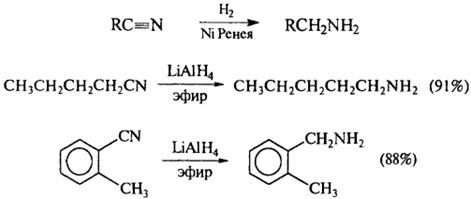
4) Восстановление нитрилов
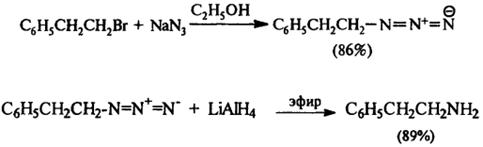
5) Восстановление азидов
6) Восстановление иминов – восстановительное аминирование карбонильных соединений
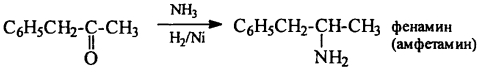
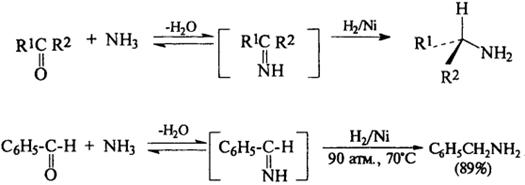
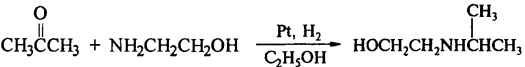
7) Алкилирование аммиака и аминов
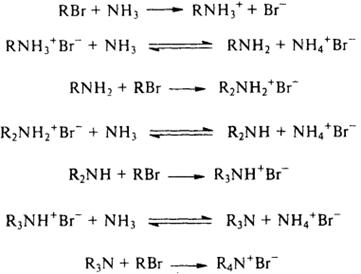
8) Восстановление оксимов
9) Из аминокислот
R-CH(NH2)-COOH →{декарбоксилаза}R-CH2-NH2 + CO2
10) Из солей аминов
[R-NH3]Cl + NaOH →{t} R-NH2 + NaCl + H2O
Химические свойства
1) Гидролиз
CH3-NH2 + HOH ↔ [CH3-NH3]OH
CH3-NH2 + HCl ↔ [CH3-NH3]Cl
2) Алкилирование
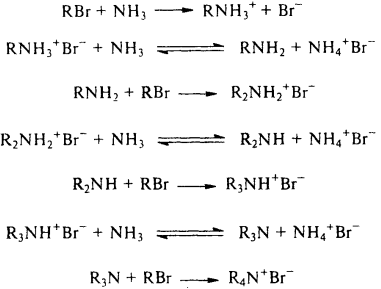
3) Взаимодействие пирвичных и вторичных аминов с карбонильными соединениями – получение иминов и енминов
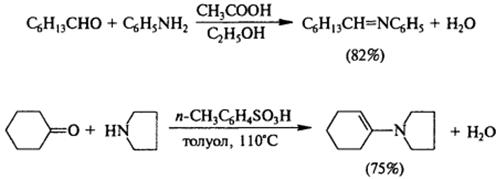
4) Взаимодействие с сульфонилгалогенидами
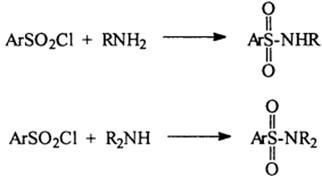
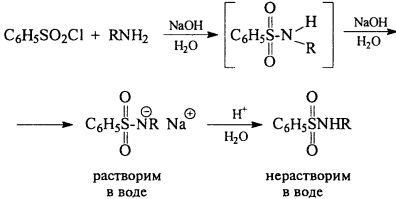
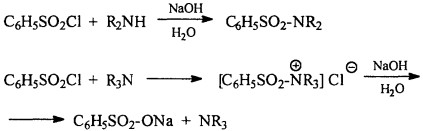
5) Окисление
R-NH2 + O2 → CO2 + N2 + H2O
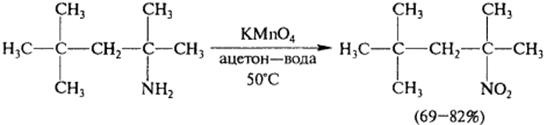
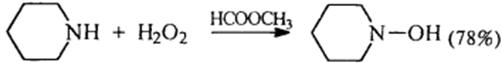

6) Взаимодействиесазотистойкислотой
R-NH2 + HNO2 → R-OH + N2 + H2O
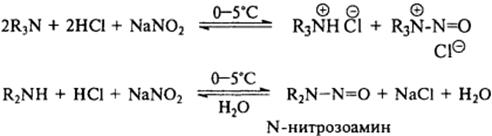
7) Галогенирование аминов
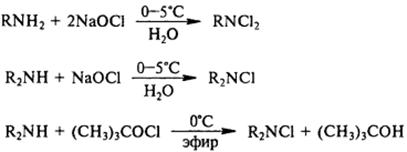
8) Взаимодействие анилина с галогенами
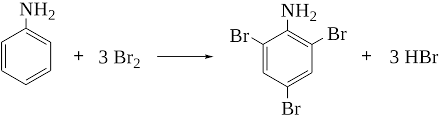
9) Взаимодействие анилина с серной кислотой
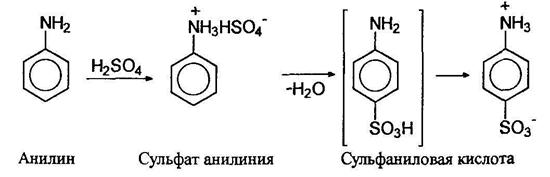
10) Взаимодействие анилина с азотистой кислотой
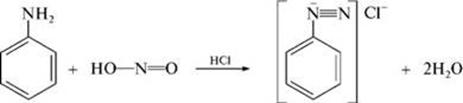
11) Взаимодействие анилина с ангидридами
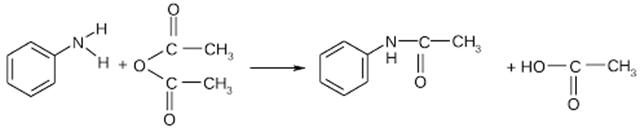
12) Взаимодействие анилина с хлоридом фосфора(III)
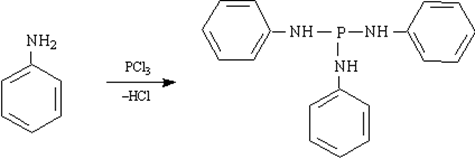
13) Окисление анилина и его гомологов
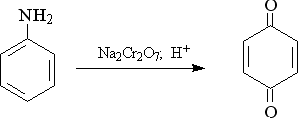
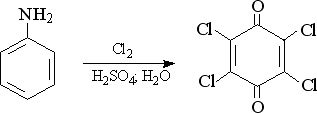
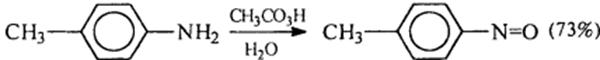
Аминокислоты
Получение
1) Взаимодействие галогенпроизводных карбоновых кислот с аммиаком
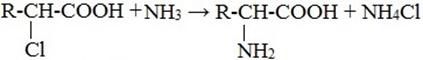
2) Гидролиз пептидов
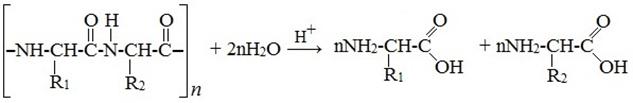
3) Восстановление нитрокислот водородом
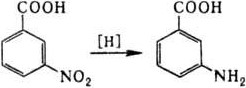
4) Взаимодействие непредельных карбоновых кислот с аммиаком с последующим гидролизом
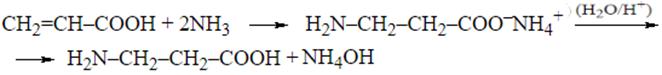
5) Получение из альдегидов
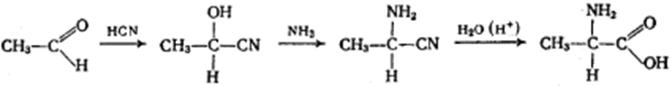
Химические свойства
1) Взаимодействие со щелочами
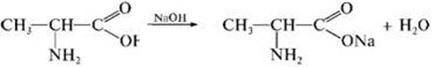
2) Взаимодействие со спиртами
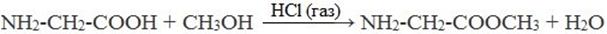
3) Внутримолекулярная нейтрализация
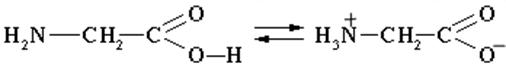
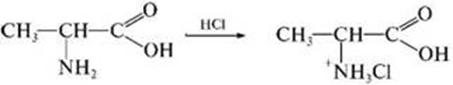
4) Взаимодействие с сильными кислотами
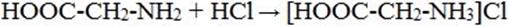
5) Взаимодействие с азотистой кислотой
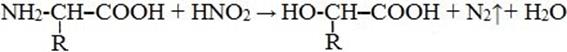
6) Взаимодействие с аммиаком
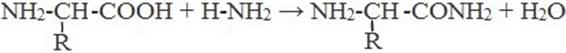
7) Разложение
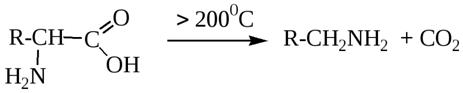
8) Образование внутренней соли
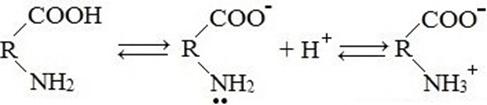
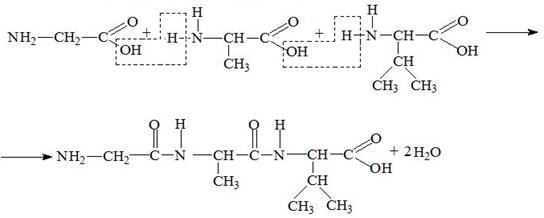
9) Образование пептидов
10) Взаимодействие с гидроксидом меди(II)
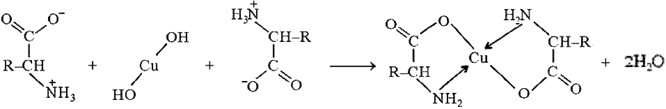
11) Внутримолекулярное взаимодействие функциональных групп
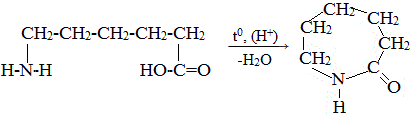
12) Окисление
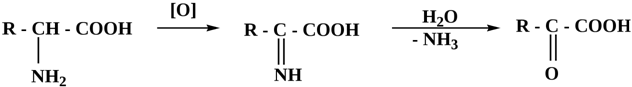
Нитросоединения
Получение
1) Нитрование алканов - реакция Коновалова
R-H + HNO3→{150℃}R-NO2 + H2O
2) Реакция Мейера
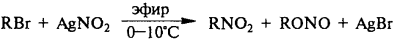
3) Взаимодействие галогенпроизводных карбоновых кислот с нитритами
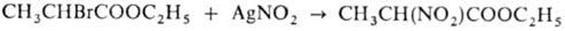
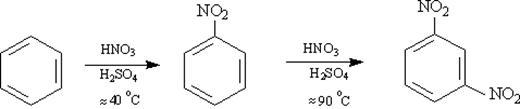
4) Нитрование аренов и нитроаренов
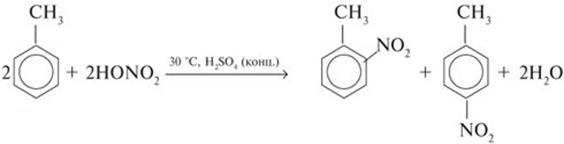
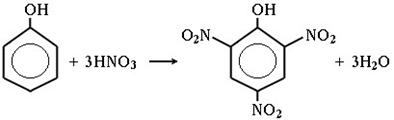
5) Нитрование фенола
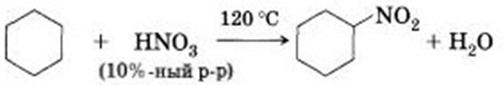
6) Нитрование циклоалканов
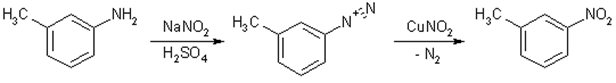
7) Из аминов
Химические свойства
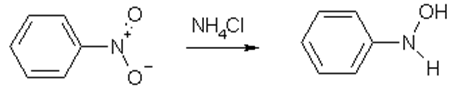
1) Восстановление
R-NO2 →{LiAlH4}R-NH2 + H2O

2) Галогенирование
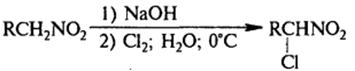
3) Нитрозирование
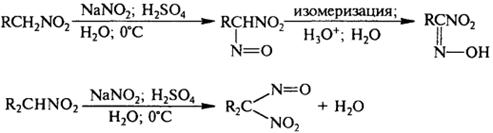
4) Взаимодействие с альдегидами
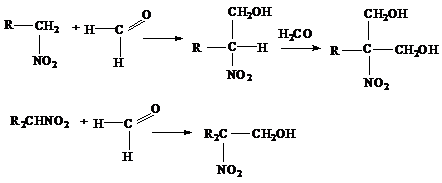
5) Взаимодействие с серной кислотой
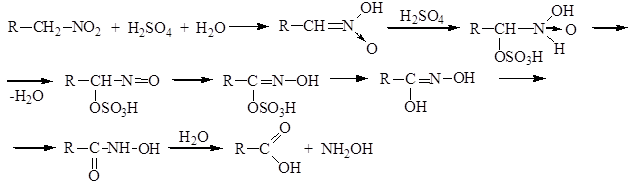
6) Гидролиз в кислой среде
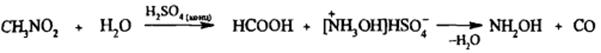
[1]Катализатор Линдлара - это палладий, адсорбированный на нейтральном носителе BaSO4 или CaCO3, дезактивированный хинолином
[2]Катализатор P-2-Ni - это Ni(OAc)2; NaBH4; C2H5OH; NH2CH2CH2NH2, коллоидный никель, полученный восстановлением диацетата никеля боргидридом натрия в ситеме этанол-этилендиамин. Этилендиамин препятствует дальнейшему гидрированию двойной связи.