ЛАБОРАТОРНАЯ РАБОТА
Скорость химических реакций
Цель работы: экспериментальное изучение влияния концентрации реагента на скорость химической реакции и экспериментальное определение порядка реакции по одному из реагентов.
Необходимые приборы и реактивы: штатив с пробирками, бюретки, химические воронки, секундомер, растворы Na2S2O3, H2SO4, дистиллированная вода.
Опыт 1. Зависимость скорости реакции от концентраций реагирующих веществ. Определение порядка реакции
Экспериментально изучается зависимость скорости реакции между тиосульфатом натрия и серной кислотой в растворах от концентрации Na2S2O3:
Na2S2O3 + H2SO4 → Na2SO4 + H2SO3 + S↓
Белый осадок образующейся мелкодисперсной серы становится заметным для глаза наблюдателя после накопления определенной её концентрации ∆С. Хотя эта концентрация неизвестна, она является приблизительно постоянной от опыта к опыту, если наблюдатель одинаково фиксирует время ∆τ от начала реакции, т.е. от момента сливания растворов, до первых признаков «помутнения». Поэтому среднюю начальную скорость реакции можно считать равной величине, обратно пропорциональной времени ∆τ:
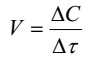
где ∆c =const, при расчетах удобно принять равной 100.
Произвольный выбор этой константы не скажется на наклоне прямолинейного графика в логарифмической системе координат.
Порядок выполнения работы
В одну пробирку налейте 7,5 мл раствора Na2S2O3, а в другую – 2,5 мл раствора H2SO4. Быстро вылейте раствор тиосульфата натрия в пробирку с кислотой, осторожно встряхните её для более полного перемешивания растворов и одновременно начните отсчёт времени по секундомеру. Что наблюдаете? Из-за чего произошло помутнение раствора? Запишите уравнение реакции и время ∆τ1, через которое появляются первые признаки помутнения раствора.
Проведите ещё два аналогичных эксперимента, изменяя концентрацию Na2S2O3 (см. таблицу). При этом следует стараться каждый раз отсчет времени продолжать до одинаковой степени помутнения раствора.
В каждом опыте берется постоянное количество второго реагента – серной кислоты. Суммарный объём реакционной смеси во всех опытах одинаков, поэтому при вычислениях вместо концентрации тиосульфата натрия можно брать пропорциональную ей величину объёма раствора Na2S2O3 в см3. Занесите полученные данные в таблицу.
| № | Объём растворов веществ, см3 | Время ∆τ, с | Скорость
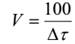 ,
с–1 ,
с–1
| lg v | "с" | lg"c" | ||
| 1 пробирка | 2 пробирка | |||||||
| Na2S2O3 | Н2О | H2SO4 | ||||||
| 7,5 | – | 2,5 | 19, 15, 17 | 7,5 | ||||
| 2,5 | 2,5 | 25, 28, 22 | ||||||
| 2,5 | 2,5 | 49, 52, 55 | 2,5 |
Обработка результатов опыта
Рассчитайте и внесите в таблицу величины v, lgv и lgc.
А) Установление характера зависимости скорости реакции
от концентрации тиосульфата натрия.
Постройте график зависимости скорости реакции v от концентрации с (Na2S2O3), отложив значения скорости по оси ординат, а значения концентраций – по оси абсцисс.
Сделайте вывод о характере зависимости скорости этой реакции от концентрации Na2S2O3.
б) Определение порядка реакции по тиосульфату натрия. Кинетическое уравнение реакции можно записать в виде:
v = k⋅cа (Na2S2O3) ⋅ сb (H2SO4),
где а и b – порядки реакции по Na2S2O3 и H2SO4.
Поскольку в данной серии опытов концентрация серной кислоты берется одинаковой, это уравнение можно переписать в виде: v = k′ ⋅ ca (Na2S2O3),
где k′ = k ⋅ cb (H2SO4).
Линеаризованная форма данной степенной зависимости получается логарифмированием обеих частей уравнения:
lgv = lgk′ + a lg c.
Эта зависимость в координатах lg v – lg c изображается прямой линией с тангенсом угла наклона, численно равным порядку а реакции по веществу Na2S2O3. Постройте график зависимости логарифма скорости реакции lg v, отложив его по оси ординат, от логарифма концентрации lg c тиосульфата натрия, отложив его по оси абсцисс. Из наклона графика рассчитайте порядок реакции по тиосульфату натрия.
Сделайте вывод об экспериментально полученном порядке реакции по тиосульфату натрия и сопоставьте его с теоретическим (коэффициент в уравнении реакции).
Вопросы для подготовки к защите лабораторной работы 1. Что такое скорость химической реакции?
2. Какие бывают виды скорости химической реакции?
3. Сформулируйте закон действующих масс.
4. Какой физический смысл имеет константа скорости химической реакции?
5. От чего зависит скорость химической реакции?
6. Как влияет концентрация реагентов на скорость реакции?
7. Как влияет давление в системе на скорость реакции? На все ли системы оно влияет? На какие системы не влияет?
8. Как влияет температура на скорость эндотермической реакции? На экзотермическую реакцию?
9. Как влияет природа реагирующих веществ на скорость реакции?
10. Как влияет поверхность соприкосновения на скорость реакции? Для каких реакций возможно влияние этого фактора?
11. Что такое катализаторы? Каково их влияние на скорость реакции?
12. Что такое ингибиторы? Каково их влияние на скорость реакции?
13. Что такое порядок реакции по реагенту?
14. Что такое общий порядок реакции?