2.1 Построение и исследование диаграммы состояния La—Sb в атомных и массовых долях.
2.1.1 Данная диаграмма, изображённая на рисунке 5, является двухкомпонентной системой с полной растворимостью в жидком состоянии, с отсутствием растворимости в твердом состоянии, с образованием одного устойчивого химического соединения конгруэнтного плавления и образованием трех неустойчивых химических соединении инконгруэнтного плавления, с вырожденной эвтектикой.
Фазовый состав:
I (L): жидкий расплав;
II (L + SLa): жидкий расплав + кристаллы твердого р-ра на основе компонента La;
III (L + SLa2Sb): жидкий расплав + кристаллы твердого р-ра на основе компонента La2Sb;
IV (SLa + SLa2Sb): кристаллы твердого р-ра на основе компонента La + неустойчивое химическое соединение La2Sb;
V (L+SLa3Sb2): жидкий расплав + устойчивое химическое соединение La3Sb2;
VI (L+SLa2Sb3): жидкий расплав + устойчивое химическое соединение La3Sb2;
VII (SLa2Sb + SLa3Sb2): неустойчивое химическое соединение LaSb3+ устойчивое химическое соединение La2Sb3;
VIII (SLa3Sb2 + SLaSb): неустойчивое химическое соединение LaSb+ устойчивое химическое соединение La3Sb2;
IX (L+ SLaSb): жидкий расплав + неустойчивое химическое соединение LaSb;
X (SLaSb + SLaSb2): неустойчивое химическое соединение LaSb+ неустойчивое химическое соединение LaSb2;
XI (L+ SLaSb2): жидкий расплав + неустойчивое химическое соединение LaSb2;
XII (SLaSb2 + SSb): кристаллы твердого р-ра на основе компонента Sb + неустойчивое химическое соединение LaSb2.
Точкa эвтектики:
E1: LE1 ↔ SLa + SLa2Sb С=0 Ф=3
Переведём в массовые доли точки, соответствующие следующим атомным долям cурьмы: A =0,5 ат.д.; B=0,6 ат.д; C=0,74. Для этого воспользуемся следующеё формулой:

Проведём пересчёт для каждой из точек:
A: 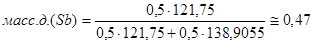
B: 
C: 
2.1.2На данной диаграмме имеется четыре химических соединения, которые условно обозначили следующим образом: LaxSby, LazSbw, LaaSbb, LacSbd .Индексы при химических элементах соответствуют количеству атомов. А количество атомов, в свою очередь, находится из отношения атомных долей этих элементов. Ниже приведены расчёты этих индексов:
x:y=атомная доля(La):атомная доля(Sb).
LaxSby
x:y= 0.33:0.67
x:y= 1:2
Отсюда следует, что химическая формула данного химического соединения LaSb2.
Аналогично, находим индексы для химического соединения LazSbw:
z:w= 0.6:0.4
z:w= 3:2
Следовательно, химическая формула данного соединения – La3Sb2.
Для химического соединение LaaSbb
a:b= 0.5:0.5
a:b= 1:1
Данная формула выглядит следующим образом: LaSb
Химическое соединение LacSbd
c:d= 0.33:0.67
c:d= 1:2
Получили химическое соединение, в котором содержание меди и лантана находится в равных пропорциях – LaSb2.
Скомпонуем полученные результаты: La2Sb, La3Sb2, LaSb, LaSb2.
2.1.3 Температура начала кристаллизации расплава системыLa—Sb, содержащей 0,6 ат.д. Sb, равна »1475°С, температура конца кристаллизации равна 1110°С.
2.1.4 Первые выпавшие кристаллы из расплава, содержащего 0,6 ат. д. Sb находятся в виде неустойчивого химического соединения LaSb. Составу последней капли этого расплава соответствует точка перитектики Р3, содержащая 0,74 ат.д. Sb.
2.1.5 Воспользовавшись данными, полученными в пункте 2.1.1, определим по правилу рычага для системы La - Sb, содержащей 0,6 ат.д. Sb при температуре 12000C и при массе сплава 50г массы равновесных фаз:
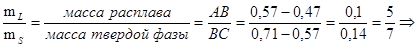
 m S =m L
m S =m L


 m S =m L m S =29,2г
m S =m L m S =29,2г
m S +m L =50г m L =20,8г
2.1.6 Число степеней свободы находится по правилу фаз Гиббса: С=К-Ф+1, где С - степень свободы, которая характеризует число независимых параметров, которые можно свободно изменять; Ф - число фаз системы; К - число компонентов системы.
Отсюда следует, что система, у которой:
состав 40 ат. д. Sb, температура 16900С, имеет: К=2, Ф=3, С=2-3+1=0;
состав 20 ат. д.Sb, температура 8000С, имеет: К=2, Ф=2, С=2-2+1=1;
состав 80 ат. д. Sb, температура 14000C, имеет: К=2, Ф=1, С=2-1+1=2.
2.1.7. При температуре, выше 14750C, состав системы La-Sb находится в виде расплава, Ф=1, С=2. При охлаждении до температуры 14750C расплав становится насыщенным неустойчивым химическим соединением LaSb, и начинается его кристаллизация. Система становится двухфазной, С=1. При дальнейшем охлаждении до температуры 11100C растет масса кристаллов химического соединения LaSb, состав расплава изменяется по кривой MP3, в нем увеличивается содержание сурьмы. Температуре 11100C соответствует точка перитектики P3, отвечающая составу его последних капель, здесь происходит перитектическое превращение:  . Кристаллизация расплава заканчивается при температуре 11100C. При температуре ниже 11100C происходит охлаждение механической смеси твердых химических соединений LaSb и LaSb2, Ф=1, С=2.
. Кристаллизация расплава заканчивается при температуре 11100C. При температуре ниже 11100C происходит охлаждение механической смеси твердых химических соединений LaSb и LaSb2, Ф=1, С=2.
Приложение А
Зависимость теплоемкости Н2 от температуры
| T.К | 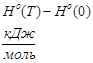
| 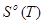

| 

|  
|
| 2,999 | 100,616 | 70,624 | 28,155 | |
| 5,693 | 119,301 | 90,836 | 27,477 | |
| 8,468 | 130,747 | 102,169 | 28,849 | |
| 11,426 | 139,104 | 110,538 | 29,181 | |
| 14,349 | 145,626 | 116,527 | 29,260 |
Приложение Б
Значение термодинамических функций для Mg.
| T,К | 

| 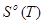

| 

| 
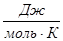
|
| 47.620 | 87.569 | 55.554 | 34.300 | |
| 51.050 | 89.935 | 55.902 | 34.300 | |
| 54.480 | 92.149 | 58.099 | 34.300 | |
| 57.910 | 94.228 | 60.163 | 34.300 | |
| 61.340 | 96.189 | 62.111 | 34.300 | |
| 64.770 | 98.043 | 63.954 | 34.300 | |
| 68.200 | 99.802 | 65.703 | 34.300 | |
| 71.630 | 101.476 | 67.367 | 34.300 | |
| 75.060 | 103.072 | 68.954 | 34.300 | |
| 78.490 | 104.596 | 70.470 | 34.300 | |
| 81.920 | 106.056 | 71.923 | 34.300 |

Приложение В
Значение термодинамических функций для MgO.
| T.К | 

| 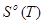
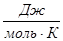
| 
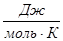
| 

|
| 58.856 | 99.696 | 57.656 | 52.890 | |
| 64.168 | 103.361 | 60.582 | 53.341 | |
| 69.524 | 106.818 | 63.365 | 53.793 | |
| 74.927 | 110.093 | 66.018 | 54.255 | |
| 80.376 | 113.207 | 68.554 | 54.736 | |
| 85.875 | 116.180 | 70.983 | 55.243 | |
| 91.426 | 119.027 | 73.314 | 55.783 | |
| 97.033 | 121.763 | 75.557 | 56.363 | |
| 102.700 | 124.399 | 77.717 | 56.991 | |
| 108.433 | 126.947 | 79.803 | 57.674 | |
| 114.237 | 129.417 | 81.819 | 58.416 |
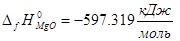
Приложение Г
Значение термодинамических функций для CO2
| T.К | 

| 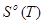
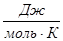
| 
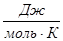
| 

|
| 65.273 | 288.086 | 241.462 | 57.818 | |
| 71.085 | 292.095 | 244.705 | 58.397 | |
| 76.950 | 295.880 | 247.787 | 58.898 | |
| 82.862 | 299.464 | 250.722 | 59.334 | |
| 88.815 | 302.867 | 253.525 | 59.717 | |
| 94.804 | 306.105 | 256.208 | 60.054 | |
| 100.825 | 309.193 | 258.781 | 60.354 | |
| 106.874 | 312.144 | 261.252 | 60.622 | |
| 112.948 | 314.970 | 263.630 | 60.862 | |
| 119.045 | 317.680 | 265.922 | 61.080 | |
| 125.163 | 320.284 | 268.133 | 61.278 |

Приложение Д
Значение термодинамических функций для C.
| T.К | 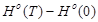

| 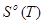
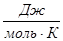
| 
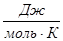
| 

|
| 21.960 | 32.138 | 16.453 | 23.919 | |
| 24.367 | 33.799 | 17.554 | 24.225 | |
| 26.802 | 35.271 | 18.619 | 24.464 | |
| 29.258 | 26.859 | 19.649 | 24.543 | |
| 31.729 | 38.272 | 20.645 | 24.775 | |
| 34.212 | 39.614 | 21.608 | 24.875 | |
| 36.703 | 40.892 | 22.540 | 24.957 | |
| 39.203 | 42.112 | 23.444 | 25.034 | |
| 41.710 | 43.278 | 24.319 | 25.121 | |
| 44.228 | 44.397 | 25.168 | 25.231 | |
| 46.758 | 45.474 | 25.991 | 25.379 |

Список литературы.
1. Термодинамические свойства индивидуальных веществ. Т.1-4 книга вторая. Таблицы термодинамических свойств: Справочное издание / Под ред. В.П. Глушкова. – М.: Наука 1979.
2. Методические указания для выполнения курсовой работы по дисциплинам «Физическая химия» и «Химия». /ВГТУ; Сост. В.В. Корнеева, А.А Щетинин, Ю.П. Хухрянский, А.Н. Корнеева, 2002. 24 с.
3. Реми Г.Курс неорганической химии. 11-е издание, выполненное кандидатом химических наук А.И.Григорьевым.Т.1-4-М.:Мир,1972.
4. Коровин Н.В., Общая химия. – М.: Высшая школа, 2007.
5. Интернет. Сайт https://him.1september.ru.
6. Некрасов Б. Водород, Курс общей химии, 14 изд., М., 1962;