Особый тип поведения репликативной вилки идентифицирован в некоторых митохондриях (в первую очередь митохондриях млекопитающих). Репликация начинается в специфической точке начала репликации в кольцевой двухцепочечной молекуле ДНК.

| Рис. 4.12 | Репликация митохондриальных ДНК млекопитающих начинается в специфической точке OriR. Cинтез инициируется путем образования праймерной РНК. |
Первоначально только одна цепь (H-цепь в митохондриях млекопитающих) используется как матрица для синтеза новой цепи. Синтез происходит только на коротком участке и вызывает вытеснение исходной комплементарной L-цепи, которая остается одноцепочечной. Данное явление было названо вытеснением (displacement), а образующаяся структура – D-петлей. В митохондриях млекопитающих единственная D-петля стабильна и состоит из 500-600 оснований. Синтез короткой цепи, имеющей уникальный 5/-конец инициируется посредством образования праймерной РНК, а вариабельный 3/-конец формируется, по-видимому, в результате терминации синтеза в любом из 3-4 дискретных сайтов. Праймер не достаточно стабилен и может деградировать, а затем синтезироваться заново для сохранения в локусе OriR двойной спирали в открытой форме.
1. Некоторые митохондриальные ДНК, например, у Xenopus laevis (шпорцевая лягушка) имеют одну большую D-петлю.
2. Другие ДНК могут иметь несколько D-петель. Например, в линейной митохондриальной ДНК Tetrahymena (инфузория) обнаружено шесть D-петель.
3. Такой же механизм репликации используется в хлоропластной ДНК, где у высших растений образуются две D-петли.
Репликация митохондриальной ДНК млекопитающих происходит посредством присоединения дезоксирибонуклеотидов к 3/-концу короткой затравочной цепи, которая при этом удлиняется в D-петле. Вытесняемая часть L-цепи становится длиннее и расширяет D-петлю. Расширение продолжается до тех пор, пока не достигнет точки, находящейся на расстоянии 67% длины кольца. Удвоение этой области приводит к раскрытию точки начала репликации в L-цепи. В сайте OriD инициируется синтез Н-цепи, протекающий в противоположном направлении с использованием вытесненной L-цепи в качестве матрицы. Таким образом, раскрытие спирали не обязательно ведет к инициации репликации одновременно на двух материнских цепях ДНК. Структуры D-петель образуются в тех случаях, когда в кольцевых ДНК точки начала репликации двух цепей разделены некоторым расстоянием.
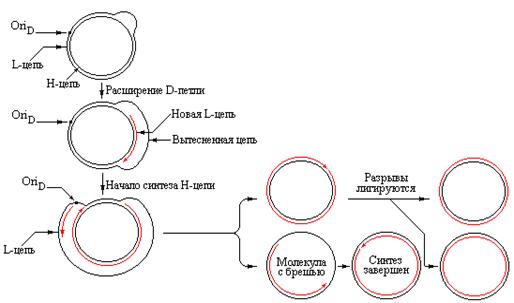
| Рис. 4.13 | В митохондриальной ДНК млекопитающих имеются отдельные точки начала репликации для каждой из цепей (репликация L-цепи инициируется в точке OriR, а синтез новой Н-цепи начинается в точке OriD. Образующиеся D-петли представляют собой стабильные структуры. |
Из-за задержки в инициации репликации второй цепи ДНК, дочерняя H-цепь синтезируется только на 30-40% длины кольца к моменту завершения синтеза дочерней L-цепи. В результате освобождается одна полная двухцепочечная кольцевая ДНК и одна кольцевая молекула, содержащая брешь. Далее брешь заделывается и остающиеся разрывы сшивается с участием лигаз.