В репликации ДНК E. coli принимает участие не только ДНК-полимераза III. Этот сложный процесс зависит также от действия 20 или более вспомогательных ферментов и белковых факторов, каждый из которых выполняет свои специфические функции. Сложный многофункциональный комплекс, обеспечивающий удвоение бактериальной ДНК получил название ДНК-репликазной системы или реплисомы. Вполне понятно, что необходимая сложность ферментативного устройства реплисомы зависит как от структуры самой ДНК, так и оказывается под давлением требований точного воспроизведения структуры ДНК при ее удвоении. В этом разделе рассматриваются основные группы ферментов репликации в свете тех проблем, которые они призваны разрешать.
Доступность материнских цепей исходной ДНК с целью того, чтобы они могли служить матрицами для образования дочерних цепей, достигается в результате их предварительного разделения. Этот процесс зависит от проявления каталитической активности геликаз – ферментов, которые, двигаясь вдоль молекулы ДНК, разделяют ее цепи, используя энергию гидролиза АТР. При этом разделение цепей неизбежно создает специфические топологические проблемы, связанные со спиральной структурой ДНК. Эти проблемы относительно легко разрешаются благодаря участию ДНК-топоизомераз (см. лекцию 3). Разделенные цепи материнской ДНК стабилизируются специфическими ДНК-связывающими белками или SSB-белками. Как было указано выше, для того чтобы ДНК-полимераза могла обеспечить репликацию ДНК, на матричных цепях должны быть синтезированы комплементарные им праймеры – как правило, короткие участки РНК, образование которых зависит от действия праймазы. В конечном итоге РНК-праймеры удаляются путем их замещения участками ДНК. У E. coli этот процесс зависит от участия РНК-азы Н и ДНК-полимеразы I. После удаления праймера и заполнения пробела фрагментом ДНК во вновь синтезированной дочерней цепи остается брешь, суть которой заключается в отсутствии канонической фосфодиэфирной связи. Подобные бреши сшиваются ДНК-лигазами.
Репликация хромосомы E. coli протекает в несколько стадий
Процесс синтеза молекулы ДНК подразделяют на несколько стадий: инициацию, элонгацию и терминацию в зависимости от характера протекающих реакций и ферментов, принимающих участие в их катализе. Следует отметить, что пониманию основополагающих принципов синтеза основных биологических информационных полимеров – ДНК, РНК и белков способствует такое же подразделение этих процессов на указанные выше стадии. Описываемые ниже события являются результатом исследований, выполненных in vitro c использованием выделенных и очищенных ферментов E. coli хотя принципы лежащие в основе этих реакций высококонсервативны и характерны для всех репликативных систем.
Инициация
Точка начала репликации ДНК E. coli, обозначаемая oriC, включает 245 пар оснований: локус ori включает элементы ДНК-последовательностей, которые являются высококонсервативными для всех точек начала репликации у бактерий. Общее расположение консервативных последовательностей приведено на рис. 2.
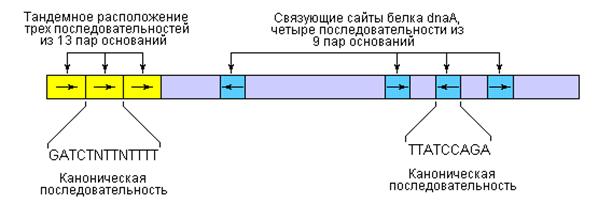
| Рис. 2 | Порядок расположения консервативных последовательностей в точке начала репликации хромосомы E. coli – oriC. Несмотря на то, что повторяющиеся последовательности не совсем идентичны, некоторые нуклеотиды проявляют высокую степень консервативности по отношению к определенным положениям, формируя общую последовательность. В тех положениях, где отсутствует полное совпадение, символ N означает присутствие любого из четырех нуклеотидов. Стрелками показаны ориентации нуклеотидных последовательностей. |
Ключевые последовательности в области точки начала репликации представлены двумя сериями повторов: тремя повторами из 13 пар оснований и четырьмя повторами из 9 пар оснований. Как следует из табл. С в фазе инициации репликации принимают участие, по меньшей мере, 9 различных ферментов и белковых факторов. Эти ферменты и белки раскрывают спираль ДНК в точке начала репликации и формируют предзатравочный комплекс. Ключевым компонентом инициации является белок dnaA.
Таблица С
Белки, необходимые для инициации репликации хромосомы E. coli в локусе oriC
| Белок | Молекулярная масса | Число субъединиц | Функция |
| Белок dnaA | 52.000 | Узнает специфические последовательности oriC. Открывает дуплекс ДНК в локусе ori. | |
| Белок dnaB (геликаза) | 300.000 | 6* | Разделяет цепи ДНК |
| Белок dnaC | 29.000 | Участвует в связывании dnaB в точке начала репликации | |
| HU | 19.000 | Гистоноподобный белок; ДНК-связывающий белок; стимулирует инициацию репликации | |
| Белок dnaG (праймаза) | 60.000 | Синтезирует РНК-праймеры | |
| SSB-белок | 75.600 | 4* | Связывается с одноцепочечным участком ДНК |
| РНК-полимераза | 454.000 | Усиливает активность dnaA | |
| ДНК-гираза (ДНК-топоизомераза II) | 400.000 | 4 | Устраняет топологические напряжения, возникающие в ДНК в результате разделения ее цепей |
| Dam-метилаза | 32.000 | Метилирует последовательности (5/)GATC в точке начала репликации |
* в указанных случаях субъединицы идентичны
Белковый комплекс из 4-5 молекул инициаторного белка dnaA взаимодействует с каждым из четырех повторов из 9 пар оснований в точке начала репликации и обеспечивает плавление ДНК в области трех повторов из 13 пар оснований, которая обогащена А-Т парами. Этот процесс требует участия АТР и бактериального гистоноподобного белка HU. После этого белок dnaC обеспечивает взаимодействие белков dnaВ с денатурированной областью ДНК. Белки dnaВ в виде кольцеобразных гексамеров связываются с каждой цепью ДНК и действуют как геликазы расплетая двойную спираль и формируя две потенциальные репликативные вилки. Если при этом в условиях in vitro в систему репликации добавить SSB-белки и ДНК-топоизомеразу II (ДНК-гиразу) E. coli dnaВ-геликазы с большой скоростью начнут разделять тысячи пар оснований двигаясь в противоположных направлениях от точки начала репликации. Множество молекул SSB-белков кооперативно связываются с одноцепочечной ДНК стабилизируя одиночные цепи и препятствуя их ренатурации в то время как гираза устраняет топологическое напряжение индуцируемое dnaВ-геликазой. После добавления в систему репликации E. coli in vitro дополнительных ферментов dnaВ-зависимый процесс разделения цепей становится сопряженным с собственно удвоением ДНК.
Фаза инициации репликации ДНК, как известно, является единственной стадией всего процесса, которая регулируется, причем регулируется, так что удвоение ДНК происходит только один раз в каждом клеточном цикле. В целом механизм регуляции репликации все еще мало понятен, однако результаты ряда генетических и биохимических исследований проливают некоторый свет на основы такой регуляции.
В частности установлено, что на выбор времени начала репликации влияет метилирование ДНК и ее взаимодействие с бактериальной плазматической мембраной. Участок ДНК, в составе локуса oriC, метилируется специфической Dam-метилазой ( D NA a denine m ethylation), которая вводит метильную группу по N6-положению аденина в составе короткого палиндрома (5/)GATC. Следует отметить, что локус oriC E. coli чрезвычайно обогащен последовательностями GATC – в составе 245 пар оснований их насчитывается 11, в то время как средняя встречаемость GATC в хромосоме кишечной палочки не превышает 1 на 256 пар оснований.
В норме GATC-палиндромы в локусе oriC полностью метилированы. Сразу после удвоения ДНК в точке начала репликации данные участки становятся полуметилированными: родительские цепи остаются метилированными по последовательностям GATC, но вновь синтезированныее дочерние цепи ДНК имеют неметилированные сайты в последовательности GATC. Полуметилированное состояние локуса oriC становится сигналом для его взаимодействия с плазматической мембраной бактериальной клетки и соответственно изолирования этой точки начала репликации от повторной ее активации (правда механизм такого взаимодействия пока не известен). Спустя определенное время последовательность oriC высвобождается из взаимодействия с плазматической мембраной и снова полностью метилируется с участием Dam-метилазы, получая, тем самым, возможность повторно связывать белки dnaA, а, следовательно, активироваться для следующего цикла репликации. В регуляции инициации репликации также определенную роль играет процесс медленного гидролиза АТР под действием белка dnaA, который включается в циклическое превращение его активной (с АТР) и неактивной форм (без АТР) происходящее в интервале времени от 20 до 40 мин.
Элонгация
Стадия элонгации в ходе репликации ДНК включает два различных, но взаимосвязанных процесса: синтез лидирующей цепи и синтез отстающей цепи. Определенный набор ферментов и вспомогательных белков, действующих в области репликативной вилки, является общим для синтеза обеих цепей. К ним относятся ДНК-геликазы, ДНК-топоизомеразы и SSB-белки. Так, ДНК-геликазы разделяют материнские цепи исходной ДНК, ДНК-топоизомеразы устраняют топологическое напряжение, генерируемое геликазами, а SSB-белки стабилизируют разделенные одиночные материнские цепи. Начиная с момента стабилизации разделенных одиночных материнских цепей, процессы синтеза лидирующей и отстающей дочерних цепей приобретают существенные различия.
Синтез лидирующей цепи начинается с образования в точке начала репликации короткого (10-60 нуклеотидов) РНК-праймера под действием праймазы – белка dnaG. Затем синтез лидирующей цепи происходит непрерывно путем добавления дезоксинуклеотидов к 3/-концу праймера под действием ДНК-полимеразы III. В противоположность лидирующей цепи, синтез отстающей цепи осуществляется посредством периодического образования достаточно коротких ДНК-фрагментов, называемых фрагментами Оказаки. В этом случае сначала под действием праймазы также синтезируется РНК-праймер и ДНК-полимераза III начинает добавлять к нему дезоксинуклеотиды, синтезируя фрагмент Оказаки. При всей кажущейся простоте образования каждого отдельного фрагмента Оказаки в целом процесс синтеза ДНК требует решения важной «пространственной задачи» связанной с необходимостью преодоления проблемы антипараллельности цепей исходной молекулы и ее согласования с естественным свойством всех ДНК-полимераз – неспособностью данных ферментов присоединять нуклеотиды к 5/-концам праймеров. Суть решения данной проблемы заключается в необходимости координации образования лидирующей и отстающей цепей. Действительно, синтез обеих цепей происходит с участием одного единственного (в одной репликативной вилке) асимметрического димера ДНК-полимеразы III, который обеспечивает сближение двух точек полимеризации. Такая ситуация может быть реализована в случае образования «петли» на отстающей цепи как это показано на рис. 3.
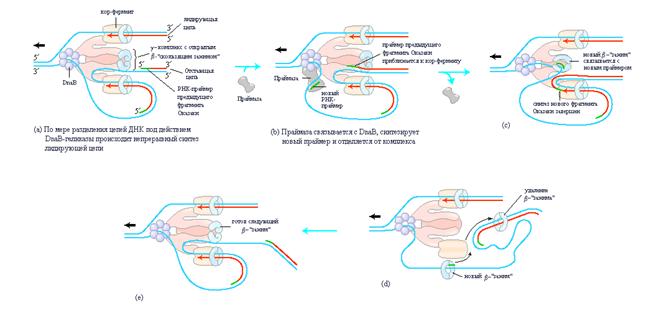
| Рис. 3 | Синтез лидирующей и отстающей цепей ДНК. События в области одной репликативной вилки скоординированы одним единственным асимметрическим димером ДНК-полимеразы III в комплексе с dnaB-геликазой. На рисунке показан уже происходящий процесс репликации. Отстающая цепь образует петлю и взаимодействует с ДНК-полимеразой III так, что синтез лидирующей и отстающей цепей происходит одновременно. Красной стрелкой показаны 3/-концы двух новых цепей и одновременно направление синтеза ДНК. Черные стрелки показывают направление движения родительской ДНК через полимеразный комплекс. Показано образование фрагментов Оказаки на отстающей цепи. |
Синтез фрагментов Оказаки на отстающей цепи представляет собой в некоторой степени элегантную «ферментативную хореографию». Белки dnaВ-геликаза и dnaG-праймаза являются составными частями комплекса называемого праймосомой, который формируется вслед за образованием предзатравочного комплекса в результате связывания с dnaВ-геликазой белка dnaG-праймазы. Для осуществления репликации ДНК-полимераза III использует один набор субъединиц кор-фермента для непрерывного синтеза лидирующей цепи, тогда как другой набор субъединиц кор-фермента осуществляет циклическое образование фрагментов Оказаки. dnaВ-геликаза расплетает двойную спираль ДНК в репликативной вилке (рис. 3-а) по мере своего АТР-зависимого перемещения по отстающей цепи в направлении 5/®3/. ДНК-праймаза время от времени связывается с dnaВ-геликазой и синтезирует короткий РНК-праймер (рис. 3-b). После этого новый «скользящий зажим», обозначаемый b позиционируется на праймере с помощью g-комплекса ДНК-полимеразы III (рис. 3-c). По завершению синтеза фрагмента Оказаки репликация приостанавливается, и субъединицы кор-фермента ДНК-полимеразы отделяются от «скользящего зажима» (и от фрагмента Оказаки) и взаимодействуют с новым «скользящим зажимом» (рис. 3-d,e). Описанные выше события инициируют синтез следующего фрагмента Оказаки. В целом, весь набор ферментов, действующий в области репликативной вилки, называют реплисомой. Характеристика ферментов реплисомы приводится в табл. D.
Реплисома способна поддерживать высокую скорость синтеза ДНК, присоединяя около 1.000 нуклеотидов в сек к каждой растущей цепи. После образования фрагмента Оказаки тот РНК-праймер, который служил основой для его синтеза, удаляется под действием РНК-азы Н и пробел заполняется соответствующим участком ДНК с помощью ДНК-полимеразы I, а остающаяся брешь «залечивается» ДНК-лигазой.
ДНК-лигаза катализирует формирование фосфодиэфирной связи 3/-гидроксильным концом одной цепи и 5/-фосфатным концом другой. Лигазная реакция протекает только в том случае если 5/-концевая фосфатная группа активирована аденилированием. Для этой цели вирусы и эукариоты используют АТР. В тоже время бактериальные ДНК-лигазы в большинстве случаев для активации 5/-концевых фосфатных групп используют АМР являющийся компонентом NAD+. Кроме процесса репликации ДНК ДНК-лигазы также принимают участие в рекомбинации и репарации этой информационной молекулы, а также находят широкое применение в генно-инженерных работах при получении рекомбинантных ДНК.
Терминация
В конечном итоге две репликативные вилки кольцевой хромосомы E. coli встречаются в области терминатора, который представляет собой последовательность, состоящую из множества повторов, построенных из 20 пар оснований и обозначаемую символом Ter (от слова ter minus). Присутствие Ter-последовательности в хромосоме E. coli формирует своеобразную «ловушку», в которую репликативная вилка может попасть, но не может ее покинуть. Механизм функционирования Ter-последовательности заключается в том, что она является сайтом связывания специфическо белка называемого Tus ( t erminus u tilization s ubstance). Комплекс Tus-Ter способен замедлить движение репликативной вилки только в одном направлении. В цикле удвоения ДНК в качестве терминатора действует только один комплекс Tus-Ter, при этом данный комплекс сначала сталкивается с любой репликативной вилкой. Когда любая из двух репликативных вилок наталкивается на функционально активный комплекс Tus-Ter, она приостанавливается, вторая репликативная вилка останавливается при встрече с первой (захваченной) вилкой. Несколько сотен последних пар оснований расположенных между двумя встретившимися крупными ферментными комплексами удваиваются с помощью еще неизвестного способа, завершая тем самым образование двух топологически сцепленных кольцевых хромосом – катенанов. Разделение катенанов осуществляет ДНК-топоизомераза IV, которая относится к ДНК-топоизомеразам типа II и является продуктом экспрессии генов parC и parD.
Организация репликации ДНК в клетках E. coli
Процесс репликации кольцевой хромосомы в клетках E. coli строго упорядочен, а ферментная система, ответственная за удвоение молекулы ДНК отличается высокой степенью организованности. Действительно, после инициации процесса удвоения ДНК в точке начала репликации две сформированные реплисомы не расходятся в противоположные стороны вдоль молекулы ДНК. Вместо этого реплисомы объединяются в единую структуру, которая взаимодействует со специфическим участком на внутренней поверхности бактериальной плазматической мембраны и ДНК-субстрат протаскивается через такую «репликационную фабрику». Место прикрепления двух реплисом располагается в центре удлиненной бактериальной клетки. После инициации каждая из вновь образованных точек начала репликации оказывается в своей части клетки, и продолжающееся удвоение ДНК вытесняет вновь образующиеся хромосомы в те же части клетки. Тщательно разработанная пространственная организация реплицирования хромосом гармонично функционирует и весь процесс в целом поддерживается участием многих специфических белков, в том числе ДНК-топоизомераз. Как только репликация терминируется, бактериальная клетка приступает к делению при этом две новые хромосомы, каждая из которых изолирована в своей части исходной клетки точно распределяются между дочерними клетками.
II. Репликация ДНК эукариот
Точное воспроизведение последовательности нуклеотидов в ДНК в ходе удвоения данной информационной молекулы является ключевым событием для размножения и выживания клеток, происходящее в течение S-фазы (фазы синтеза ДНК) клеточного цикла. Этот раздел курса лекций начинается с краткого «букваря» по вопросам репликации у эукариот и далее рассматривает ее регуляцию. Кроме того, в данном разделе приводится описание белков, которые связываются с точкой начала репликации и обеспечивают условия при которых, каждый регион эукариотической ДНК реплицируется один и только один раз в течение клеточного цикла. В заключение обсуждаются вопросы, посвященные рассмотрению влияния структуры ядра на процесс репликации.
Репликация ДНК: праймер
Одно из наиболее волнующих предвидений вытекающих из модели двойной спирали ДНК, предложенной Уотсоном и Криком, заключалось в выдвижении гипотезы о принципе репликации ДНК. Поскольку структура двойной спирали ДНК определяется комплементарным спариванием оснований, было бы логичным предположить существование ферментов впоследствии названных ДНК-полимеразами, которые, двигаясь по одиночной цепи ДНК и узнавая в ней основания, встраивали бы в соответствии с правилом комплементарности соответствующие нуклеотиды в растущую дочернюю цепь. Можно было также предположить, что для синтеза ДНК вполне достаточно участия только одного единственного фермента. В действительности процесс репликации ДНК в эукариотических клетках зависит от функционирования чрезвычайно сложно устроенной макромолекулярной «машины».
Перед тем, как перейти к рассмотрению механизма репликации ДНК у эукариот и ее регуляции необходимо ввести некоторую терминологию, описывающую геометрию реплицирующейся ДНК. Точное место в хромосомной ДНК, с которого начинается процесс репликации этой информационной молекулы, получило название точки начала двунаправленной репликации. Термин «двунаправленная» подразумевает существование двух белковых ансамблей аппарата репликации ДНК движущихся в противоположных направлениях от точки начала репликации. Каждый «ансамбль» репликативного аппарата вместе с ДНК, которая реплицируется, получил название репликативной вилки из-за того, что в месте репликации молекула материнской ДНК разделяется на две отдельные цепи.
В отличие от прокариот до настоящего времени так и не известно, движутся ли репликативные вилки при удвоении ДНК эукариот вдоль данной молекулы наподобие движения «трамвая» по «рельсам» или же репликативная «машина» расположена в фиксированном месте клетки (наподобие «фабрики» репликации E. coli) через которую протягивается ДНК для последующего удвоения.
Природа двунаправленной репликации ДНК ставит фундаментальную проблему процесса удвоения этой молекулы, поскольку во всех известных случаях синтез дезоксиполинуклеотидов происходит только в направлении 5/®3/. В этой основополагающей полимеразной реакции активированная трифосфатная группа в 5/-положении приходящего дезоксинуклеозидтрифосфата образует фосфодиэфирную связь с ОН-группой в 3/-положении остатка дезоксирибозы концевого нуклеотида растущей дочерней цепи ДНК. Репликация одной, так называемой лидирующей (или непрерывной) цепи, не составляет никаких проблем поскольку образование дочерней цепи ДНК происходит в направлении 5/®3/. Однако синтез другой дочерней цепи ДНК в силу антипараллельности цепей исходной (материнской) двухцепочечной ДНК должен обеспечиваться участием ДНК-полимеразы, способной синтезировать дезоксиполинуклеотидные цепи в противоположном направлении, т.е. в направлении 3/®5/. Многочисленные попытки обнаружить ДНК-полимеразу с 3/®5/-полимеразной активностью оказались безрезультатными. Вместо этого было установлено, что вторая – отстающая цепь синтезируется в виде целой серии коротких фрагментов. При этом каждый раз комплекс полимераза/праймаза (см. далее) инициирует синтез отстающей цепи ДНК путем создания РНК-праймеров. Затем полимераза синтезирует собственно фрагменты ДНК, размером 250 нуклеотидов или около того, и сама полимераза движется в противоположном по отношению к точке начала репликации направлении, соблюдая правильную полярность 5/®3/. Таким образом, синтез отстающей цепи ДНК происходит в направлении, противоположном движению репликативной вилки в целом. Синтез каждого фрагмента отстающей цепи приостанавливается, когда ДНК-полимераза достигает 5/-конца предыдущего фрагмента. Из сказанного следует, что отстающая цепь копируется дискретно с образованием фрагментов, получивших название фрагментов Оказаки. Ферменты, принимающие участие в репликации ДНК и основные события, происходящие в области репликативной вилки, рассматриваются более детально в последующих разделах.
Точки начала репликации
Репликация больших геномов эукариот, происходящая в течение относительно короткой S-фазы клеточного цикла, представляется довольно сложной задачей. Каким образом клетка «узнает», что вся ДНК реплицирована? Аппарат репликации эукариот просто не в состоянии двигаться со скоростью достаточной для копирования всей ДНК эукариотических хромосом в пределах предоставленного S-фазой времени и репликация не сможет завершиться, если начнется в одной единственной точке начала репликации, как это имеет место у Escherichia coli. Для успешной и полной репликации эукариоты начинают удвоение ДНК во многих точках начала репликации, которые распределены по хромосомам: у почкующихся дрожжей обнаружено 400 точек начала репликации, а в клетках человека таких точек насчитывается около 60.000. Точки начала репликации расположены так, что вся ДНК может быть реплицирована в относительно короткий предоставленный для этого процесса промежуток времени.
Каким же образом «запуск» всех точек начала репликации согласуется так, что каждая из них активируется раз и только раз в течение S-фазы. Если бы какие-нибудь точки начала репликации активировались больше или меньше одного раза в S-фазе последствия для клетки были бы драматическими: происходили бы дупликация или потеря генов. Согласованная активация точек начала репликации контролируется с помощью механизма называемого «лицензированием ». При этом каждая точка начала репликации получает разрешение удвоиться только один раз в течение клеточного цикла. Удвоение каждой конкретной точки начала репликации «снимает лицензию », которая не может быть возобновлена до тех пор, пока клетка не осуществит весь цикл и не пройдет через митоз.
Участок хромосомной ДНК, удвоение которого инициируется в одной точке начала репликации, получил название репликона. Точка начала репликации генетически определяется как репликаторный элемент (или просто репликатор). Классическим репликоном, как упоминалось ранее, является хромосома Escherichia coli: она содержит один единственный сайт-репликатор (т.е. имеет одну точку начала репликации), обозначаемый oriC (рис. в разделе «репликация ДНК E. coli). Начало репликации зависит от участия особых инициаторных белков, часто называемых просто нициаторами, (в случае E. coli это продукт гена DnaA), которые связываются с репликатором (точкой начала репликации) и, прямо или косвенно, способствуют плавлению дуплекса ДНК и предоставляя аппарату репликации, доступ к двум отдельным цепям ДНК. В свою очередь, инициаторы связываются с дополнительными белковыми факторы, совместное действие которых порождает «волну» репликации ДНК, распространяющуюся в двух направлениях от точки начала репликации со скоростью 750–1250 нуклеотидов в секунду.
В противоположность единственной хромосоме E. coli (размером 4´106 пар оснований) средние размеры хромосом человека составляют 150´106 пар оснований. Поскольку аппарат репликации млекопитающих движется со скоростью всего 20-100 нуклеотидов в секунду (вероятно в связи с нуклеосомной организацией ДНК в хроматине) потребовалось бы 2000 часов для удвоения ДНК такой длины при инициировании процесса в одной точке начала репликации. Для большинства клеток человека длительность S-фазы составляет приблизительно 8 час. Это означает, что для удвоения средней хромосомы в отпущенное время должно использоваться, по меньшей мере, от 25 до 125 точек начала репликации. В действительности точки начала репликации расположены намного более плотно, чем это вытекает из простых расчетов. Так было установлено, что у млекопитающих точки начала репликации расположены на расстоянии приблизительно 100.000 – 150.000 пар оснований друг от друга. Другими словами в удвоении полного генома человека принимает участие около 60.000 точек начала репликации.
В качестве наиболее удачного примера используется рассмотрение событий, происходящих в репликаторах Saccharomyces cerevisiae, поскольку репликация ДНК дрожжей изучена лучше, чем у любых других эукариот.
Точки начала репликации Saccharomyces cerevisiae
Установлено, что в удвоении полного генома дрожжей принимает участие более 400 точек начала репликации. Основное достижение в понимании механизма инициации репликации ДНК у Saccharomyces cerevisiae состояло в идентификации коротких (100-150 пар оснований) сегментов ДНК, которые действуют как точки начала репликации in vivo при их клонировании в дрожжевой плазмиде. Эти сегменты ДНК названные автономно реплицирующимися последовательностями ( a utonomously r eplicating s equences – или ARS - элементы) позволяют дрожжевым плазмидам несущим, например, ген-маркер ответственный за синтез одной из незаменимых аминокислот реплицироваться параллельно с клеточными хромосомами и тем самым обеспечивать рост дрожжевых клеток на селективной среде, не содержащей данной аминокислоты. Сразу после этого было доказано, что именно ARS-элементы, хотя и не все сразу являются истинными точками начала репликации в их естественном окружении в хромосомах. Репликация всегда начинается в пределах ARS-элементов, но не все ARS-элементы действуют как точки начала репликации ДНК в каждом клеточном цикле. Среднее расстояние между репликаторами у дрожжей составляет около 30.000 пар оснований при максимальной протяженности участков между соседними точками начала репликации, равной около 130.000 пар оснований. Даже этот самый протяженный участок должен быть легко реплицирован в течение 30 мин отведенных на S-фазу у дрожжей. Так как общее количество точек начала репликации заметно превосходит то количество, которое необходимое для удвоения дрожжевого генома в отведенный временной интервал, некоторые репликаторы активируются не в каждом клеточном цикле. Вероятность того, что каждая отдельная точка начала репликации будет активирована в конкретном клеточном цикле составляет от менее 0,2 до более 0,9. Более детальные исследования позволили установить, что ARS-элементы обладают двумя особенностями, делающими их точками начала репликации. Во-первых, любой ARS-элемент имеет консервативные последовательности, являющиеся связующими сайтами для особого белкового комплекса, который метит ARS-элемент как потенциальную точку начала репликации. Во-вторых, поблизости от указанных связующих сайтов присутствуют последовательности, в пределах которых можно легко вызвать плавление дуплекса ДНК, т.е. разделение пар оснований.
Более подробно, ARS-элементы обладают общей последовательностью ДНК, называемой основной (базовой) последовательностью ARS или ARS - кором (ARS core consensus sequence): 5/-(А/Т)ТТТАТ(А/G)ТТТ(А/Т)-3/. В свою очередь ARS-кор отличает важное свойство: одна единственная замена основания по некоторым положениям в пределах этой последовательности полностью инактивирует весь ARS-элемент. Другие менее консервативные последовательности в этом участке ДНК также влияют на активность ARS как точки начала репликации. Одна из них, обозначаемая В1, вместе с ARS-кором, формирует связующий сайт для комплекса из шести белков, названного комплексом узнавания точки начала репликации ( o rigin r ecognition c omplex или ORC) (см. далее). Первичное разделение цепей ДНК необходимое для инициации репликации происходит в пределах другой короткой последовательности В2. Когда точка начала репликации действительно инициирует удвоение ДНК, синтез дочерних цепей начинается в сайте двунапраленной репликации (ТНДР) как раз посередине между ORC-связующим сайтом и В2-элементом.
Впервые комплекс белков ORC удалось идентифицировать благодаря его способности взаимодействовать с последовательностью ARS-кора, включающей 11 пар оснований. Это взаимодействие характеризуется двумя заслуживающими внимания особенностями. Во-первых, процесс взаимодействия ORC требует присутствия АТР, который остается связанным с комплексом ORC. Связывание АТР стабилизирует комплекс ORC, что позволяет ему принимать участие в последующих процессах сборки предрепликационных комплексов и инициации репликации ДНК. Во-вторых, у дрожжей комплекс ORC постоянно связан с точками начала репликации на протяжении всего клеточного цикла. Таким образом, что-то другое, а не присутствие ORC-комплекса должно участвовать в периодической активации точек начала репликации в S-фазе. У многоклеточных эукариот поведение ORC-комплекса является намного более сложным и изучено плохо.
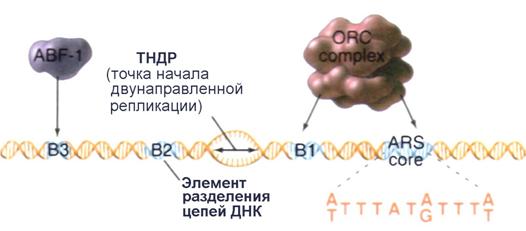
| Рис. 4.16 | Структура элемента ARS1. Белковый комплекс ORC взаимодействует с последовательностью В1 и ARS-кором. Последовательность В2 представляет собой участок ответственный за разделение цепей материнской ДНК. Фактически синтез ДНК начинается в участке, обозначенном ТНДР (точка начала двунаправленной репликации). Последовательность В3 предназначена для связывания вспомогательного фактора ABF-1 являющегося как активатором транскрипции, так и активатором ARS-элементов (Pollard T.D., Earnshaw W.C., Cell Biology, Saunders, 2002). |
В типичных случаях ARS-элементы содержат дополнительные сайты связывания для других, специфичных к определенным ДНК-последовательностям белков, таких как факторы транскрипции. Например, элемент ARS1 включает последовательность В3, которая взаимодействует с фактором транскрипции ABF-1 ( A RS- b inding f actor 1). Однако, как было установлено, делетирование ABF-1-связующего сайта лишь незначительно снижает способность ARS1 действовать в качестве репликатора in vivo. Более того, сам фактор ABF-1 может быть заменен некоторыми другими факторами транскрипции, путем делетирования последовательности В3 и вставки на ее место участка ДНК предназначенного для связывания другого фактора транскрипции. со своими последовательностями в ДНК на взаимодействие с последовательностью В3. В результате таких замен полученные искусственные ARS-элементы реплицируются с эффективностью такой же, как элементы дикого типа.
Оказалось, что между точками начала репликации и промоторными элементами, которые, как известно, ответственны за стимуляцию транскрипции генов, существуют важные функциональные взаимосвязи. В частности, в дополнение к установленной роли гексамерных комплексов ORC в репликации ДНК отдельные компоненты этих комплексов, по-видимому, принимают участие также и в регуляции транскрипции. Действительно, тесное взаимодействие между аппаратами транскрипции и репликации объясняет, почему те области хромосом, с которых активно транскрибируются гены, как правило, рано реплицируются в S-фазе.
Сборка предрепликационного комплекса. Лицензирование.
Для сохранения целостности генома каждая точка начала репликации должна активироваться («поджигаться») только один раз в ходе клеточного цикла. Хотя механизмы, лежащие в основе регуляции согласованной активации точек начала репликации в клеточном цикле эукариот не до конца понятны, определенные положительные результаты исследования данного процесса у дрожжей все же проливают некоторый свет на понимание принципов функционирования репликаторов.
Как указывалось ранее, дрожжевой комплекс узнавания точки начала репликации – ORC стабильно связан с точкой начала репликации в течение всего цикла дрожжевой клетки. При этом было установлено, что комплекс ORC не является «пусковым устройством» репликации ДНК. Скорее его можно рассматривать как некое «приспособление», на котором собирается белковый комплекс непосредственно ответственный за инициацию репликации ДНК. В течение поздней анафазы или очень ранней фазы G1 с комплексом ORC в точке начала репликации связываются два белка обозначаемые Cdc6p и Cdt1. Образовавшийся тройной комплекс [ ORC · Cdc6p · Cdt1 ] в свою очередь привлекает в точку начала репликации гексамерный комплекс белков Mcm и обеспечивает взаимодействие последнего с ДНК. Образовавшийся комплекс, состоящий из ORC, Cdc6p, Cdt1 и белков комплекса Mcm известен как предрепликационный комплекс (рис. 4.17А). Указанный предрепликационный комплекс собирается в каждой точке начала репликации до наступления фазы S.
Белки Mcm 2-7 формируют гексамерный комплекс, имеющий форму «хомута», который охватывает цепь ДНК. В настоящее время не вызывает сомнения, что гексамер Mcm выполняет функцию ДНК-геликазы – фермента, который используя энергию гидролиза АТР разделяет цепи материнской ДНК.
В настоящее время полагают, что именно сборка предрепликационного комплекса является тем ключевым моментом регуляции репликации, в котором каждая точка начала репликации «получает разрешение» («лицензируется») на инициацию удвоения ДНК так, что инициация происходит только однажды в каждом репликаторе в течение клеточного цикла. Это «лицензиров