ГЕТЕРОЦИКЛИЧЕСКИЕ СОЕДИНЕНИЯ.
Гетероциклическими соединениями называются соединения, содержащие циклы, в которых один или большее число атомов являются элементами, отличными от углерода. Наиболее важное значение имеют гетероциклы, содержащие в качестве гетероатома O, S и N. Гетероциклы могут быть классифицированы как по принципу входящего в них гетероатома, так и по числу гетероатомов в цикле. Наиболее важным является общее количество атомов в цикле (пяти- и шести-), а также являются ли системы конденсированными или полициклическими.
Ароматические гетероциклы, природа их ароматичности. Согласно правилу Хюккеля, циклическая система обладает ароматичностью, если она:
а) содержит (4 n + 2) обобщенных электронов;
 б) имеет непрерывную цепь сопряжения.
б) имеет непрерывную цепь сопряжения.
Замена любого числа групп =С-H в ароматическом ядре на =N- в состоянии sp2 - гибридизации или -СН=СН- групп на -NН-, -О- и -S-, имеющих свободную электронную пару, не вызывает нарушения его ароматических свойств.
Номенклатура гетероциклов.
Существуют тривиальные наименования многих гетероциклов, неунифицированные ни по принципу построения, ни по окончаниям, и унифицированные (см. в пунктирной рамке).

Комиссией Международного союза по чистой и прикладной химии была введена новая номенклатура. Названия строятся из префикса, обозначающего гетероатом (N - аза, О - окса, S - тиа, Р - фосфа и т.д., например: пиррол - аза циклопентадиен).
По номенклатуре ИЮПАК тип гетероатома можно указывать соответствующим корнем (N - аз, О - окс, S - ти, Р- фосф и т.д.), затем следует суффикс, обозначающий членность цикла (3 - ир, 4 - ет, 5 - ол, 6 - ин), далее суффикс, разный для предельных и непредельных соединений, как принято в обычной литературе; если гетероатомов несколько, то добавляется числительное ди-, три- и т.д.

Нумерация цикла начинается с гетероатома и ведется вокруг цикла таким образом, чтобы сумма локантов была наименьшей (для гетероатомов и положения других заместителей), при этом кислород имеет преимущество перед серой, а сера перед азотом.
Частично восстановленные циклические соединения называются дигидро- или тетрагидропроизводными ненасыщенных соединений или называются с добавлением символа Н- вместе с номером положения.


Существует еще один способ, согласно которому гетероциклы рассматривают как системы, в которых -СН= группа ароматического углеводорода замещена на гетероатом (или более простой гетероцикл)

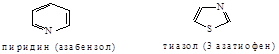
Получение простейших пятичленных гетероциклических
соединений с одним гетероатомом
1. Большое количество гетероциклических соединений может быть получено из каменноугольной смолы.
2. Синтез Пааля - Кнорра. Состоит в нагревании 1,4 -ди карбонильных соединений либо с одним дегидратирующим агентом (H2SO4), либо с NН3 или сульфидом (P2S5) + дегидратирующий агент в зависимости от того, что хотят получить - производные фурана, пиррола или тиофена:
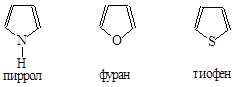



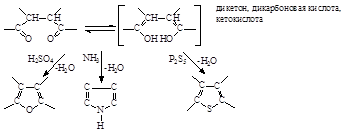
3. Существует генетическая связь между пирролом, фураном и тиофеном. Так, Юрьев показал возможность их взаимного перехода при t » 300°С [катализатор Al2O3], (реагенты H2O;NН3; Н2S).

Препаративно такие переходы лучше осуществлять с гидрированными циклами.
4. Синтез пиррола по Кнорру конденсацией a -аминокетона и кетона (или кетоэфира) в присутствии кислого [ H+ ] или основного [ HO+ ] катализатора (1911 г.)
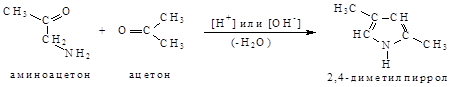
5. Сравнительно недавно был открыт новый способ синтеза пиррола и его производных с высокими выходами (до 96%) путем взаимодействия кетоксимов с ацетиленом и его производными в суперосновной среде ДМСО:
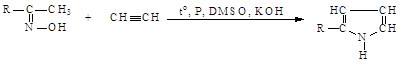
6. Тиофен в промышленности получают путем парофазной дегидратации бутана с серой:
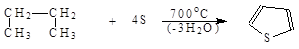
7. Фуран можно получить путем кислого гидролиза полисахаридов через стадию образования фурфурола и превращения его в пирослизевую кислоту по реакции Канниццаро с последующим декарбоксилированием. Формула фурфуролового спирта?
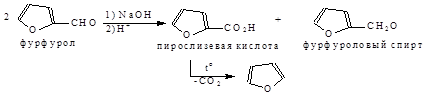
Химические свойства.
Гетероциклические соединения предпочтительно вступают в реакции электрофильного и нуклеофильного замещения по сравнению с реакциями присоединения, при этом существенным является степень их ароматичности, которая зависит от природы гетероатома. Способность пятичленных гетероциклов к типичным для ароматических соединений реакциям электрофильного замещения настолько велика, что их иногда называют суперароматическими соединениями. Однако сначала рассмотрим их кислотные и основные свойства.
1. Основные свойства.
Тиофен практически лишен основных свойств и совершенно не проявляет тенденцию к образованию солей, в то же время сила пиррола и фурана как оснований не может быть определена точно, т.к. они полимеризуются в кислой среде.
Этот процесс связан с нарушением энергии резонанса молекулы (24 ккал/моль), т.е. ацидофобностью ("боязнь" кислот). При этом протон локализирует пару электронов секстета на атоме N или S, поэтому протонирование происходит предпочтительно по a-углеродному атому ядра. Образующиеся таким образом сопряженные кислоты атакуют молекулы пиррола или фурана, приводя к полимеризации.

|
|
2. Кислотность.
В связи с тем, что p- электроны атома азота пиррола втянуты в общий секстет ядра, пиррол практически не обладает основными свойствами, более того, иминогруппа пиррола обладает очень слабыми кислотными свойствами (» как у фенола) и можно получить N -металлические производные пиррола.

Их алкилирование или ацилирование приводит к N -алкил- или N -ацилпроизводным.

Металлирование фурана и тиофена сильными основаниями также приводит к солям
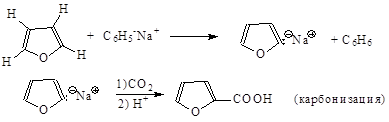
3. Фуран, пиррол и тиофен, подобно другим ароматическим соединениям, могут сравнительно легко гидрироваться при каталитическом восстановлении (не в кислой среде)

при восстановлении натрием в спирте или цинком в уксусной кислоте можно затронуть только 1,2 или 1,4 положения, т.е. получить дигидропроизводные.
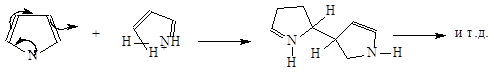
4. В пятичленных гетероциклах ароматический характер наименее ярко выражен у фурана; для него характерны свойства сопряженного диена в реакции Дильса-Альдера

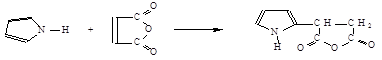
Пиррол в отличие от фурана с малеиновым ангидридом в диеновый синтез не вступает и реагирует иначе
Для тиофена в отличие от фурана и пиррола вообще не характерны реакции присоединения, и он не реагирует с диенофилами. Атом серы инертен и не присоединяет йодистый метил.