Довольно долго существовало мнение, что структура хроматина статична, что он отнюдь не главный игрок на поле генной регуляции. Гистонам же отводилась лишь пассивная роль в сворачивании чрезмерно длинной для ядра молекулы ДНК. Считали (так было проще думать), что контроль транскрипции в клетках эукариот независим от хроматина. Однако после того как была расшифрована структура нуклеосомы, в корне изменились представления о хроматине и о значимости гистонов, в частности. Они оказались непосредственно вовлеченными в процессы, происходящие на ДНК-матрице, такие как репликация (удвоение ДНК), транскрипция, репарация (исправление повреждений ДНК) и расхождение хромосом [6]. Стало ясно, что существует тщательная инструкция для факторов транскрипции, использующих различные ферменты, которые напрямую или опосредованно способствуют перестройке хроматина.
Участие хроматина в судьбе генов стало еще очевиднее, когда в составе активирующих и репрессорных белковых комплексов, управляющих работой гена, были обнаружены ферменты, вносящие или снимающие некоторые модификации в гистоновых “хвостах”. От количества модификаций, их качественного состава и специфического набора зависело, быть гену активным или молчать. Выяснилось также, что мутации генов, кодирующих ферменты-модификаторы, приводят к полной потере клеткой способности развиваться и в конечном счете к гибели. “Гистоновый код” оказался идеальным эпигенетическим механизмом, с помощью которого пишется программа каскадного включения-выключения генов, а информация о белках, записанная в самой ДНК, остается в сохранности.
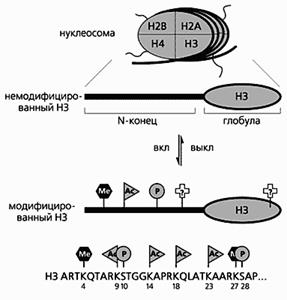
Схема расположения модифицирующих групп в N-концевой части гистона-3.
Этот консервативный домен выходит на поверхность фибриллы и подвергается, как и “хвосты” других гистонов, разным модификациям: ацетилированию (Ас), фосфорилированию (Р) и метилированию (Ме). Вполне возможны и некоторые модификации в глобулярном домене. Внизу показаны точные места модификаций N-концевого фрагмента Н3 человека
(здесь приведены однобуквенные обозначения аминокислот). Остаток лизина (К-9) может быть как ацетилирован, так и метилирован.
Места модификации гистонов весьма консервативны, специфичны и специализированы так, чтобы в клетке протекали необходимые для ее жизни процессы. В Н3 и Н4 модификациям подвергаются в основном аминокислоты с реакционноспособными боковыми группами, как правило, положительно заряженными. Чаще всего это лизины. Если в опытах все лизиновые остатки, находящиеся в “хвосте” Н4, заменяли на другие аминокислоты, терялась возможность модификации, и клетка погибала. Когда в этом гистоне место лизинов в “хвостовом” домене занимали глутамины (аминокислоты с другим суммарным зарядом), нарушалось распределение зарядов на поверхности нуклеосомы, необходимое для нормального деления клетки, и оно останавливалось. Однако если возвращали всего один остаток лизина на N-конец гистона, клетка продолжала делиться.
Поддержание генов в активном или неактивном состоянии обеспечивается комбинациями разных модификаций, причем по определенным аминокислотам и в определенном положении. Любой модифицированный остаток может способствовать или препятствовать “пришиванию” следующей химической метки.
Модификацией гистоновых “хвостов”, естественно, занимаются ферменты. Каждый из них присоединяет только определенную модифицирующую группу. Например, гистоновая ацетилтрансфераза переносит ацетильную группу на конкретные лизины в аминном конце, метилтрансфераза - метильную группу (на лизиновые и/или аргининовые остатки), а гистоновые киназы - фосфатные радикалы на серины и гистидины. Существуют также и многочисленные ферменты, которые снимают модифицирующие группы с гистоновых “хвостов”. Такие ферменты входят в состав сложных белковых комплексов, участвующих в регуляции генной активности. Из сказанного следует, что в клетке достигается определенный баланс между различными ферментами, которые считывают “гистоновый код” и переключают его, меняя степень конденсированности хроматина и, соответственно, активности гена.
По гипотезе “гистонового кода”, маркировки на модифицированных концевых доменах гистонов должны узнаваться регуляторными белками. И это уже подтверждено в экспериментах. Выяснилось, что белковые регуляторы содержат так называемый бромодомен (обнаруженный, кстати, первым), распознающий ацетилированные лизины. Присутствует он во многих регуляторах транскрипции генов. В одном из них - белке TAFII250 (субъединице базального транскрипционного фактора TFIID) - имеются две последовательно расположенные копии бромодомена, и каждая узнает свою ацетильную группу. В этом тоже проявляется комбинаторный характер “гистонового кода”. Бромодомен обнаружен более чем в 75 белках человека. В некоторых из них бывает по нескольку - до шести - копий, и тогда они способны узнавать уникальную комбинацию ацетильных групп, сформировавшуюся на “хвостах” разных гистонов.
Следующим был обнаружен хромодомен; он реагирует на метильные метки в гистоновых “хвостах”. Среди белков с хромодоменом лучше всего изучен гетерохроматиновый белок - НР1 (англ. Нeterochromatin Рrotein), участвующий в структурной организации гетерохроматина (так называют области хроматина, находящиеся в высококонденсированном состоянии), где ни один ген не работает. Следовательно, НР1 - это маркер неактивного состояния хроматина. Связываясь с метилированным по девятому лизину “хвостом” гистона-3 в одной нуклеосоме, гетерохроматиновый белок способствует метилированию Н3 в соседней частице, и CН3-метка “расползается” по хроматину [6]. В результате его протяженные участки переходят в высококонденсированное состояние. Гены, попавшие в эту область, перестают работать (генетики это часто называют эффектом положения).
Пока мало известно о белковых доменах, узнающих другие “ярлыки” на гистоновых “хвостах”, такие как фосфатные группы, белок убиквитин, АДФ-рибозильный остаток. Сейчас интенсивно ведется поиск таких доменов.

Модели активации и угнетения генной активности на основе гипотезы «гистонового кода».
Слева приведена схема модификаций N-концевых доменов Н3 и Н4, на которой видно, что ацетилирование и фосфорилирование оказывают взаимно усиливающее действие, так же как ацетилирование и метилирование, а фосфорилирование и метилирование блокируют друг друга. Стрелка с ножницами указывает на возможное протеолитическое расщепление. Справа приведена схема комбинаторной модификации гистоновых «хвостов», от которой зависит состояние гена - активен он или неактивен.
Количество экспериментальных данных о связи модификаций гистонов и их комбинаций с работой или молчанием гена огромно. Однако “гистоновый код” не расшифрован - он оказался гораздо сложнее генетического кода. Современные лаборатории (к сожалению, не наши) оснащены инструментами, каких не было во время расшифровки генетического кода; исследователи владеют изощренными методами, которых тогда не знали, а мощные компьютеры обрабатывают экспериментальную информацию. Поэтому нет причин сомневаться, что и “гистоновый код” будет раскрыт и мы поймем механизм избирательного считывания информации с ДНК в составе хроматина. А пока…
Инструкция к ДНК
Очень сложная программа последовательности включения-выключения генов записана в многочисленно модифицированных гистоновых “хвостах”, выходящих на поверхность хроматиновой фибриллы, и комбинациях “ярлыков”, огромном наборе специализированных ферментов, узнающих эти сочетания. Генетическая информация, заложенная в ДНК, оказывается недостаточной для развития полноценного организма. К ней нужна инструкция по использованию. Подтверждением этого служат сложности, которые возникают при клонировании животных. Чтобы получить таким искусственным способом новый организм, ДНК из клетки какого-либо органа переносится в яйцеклетку, из которой удалено ядро. Результат далеко не всегда бывает ожидаемым. Выясняется, что эпигенетические механизмы развития в исходной соматической клетке давно запущены, стереть эту информацию невозможно, и многие гены уже навсегда замолчали. Хотя ДНК соматической клетки идентична той, что была в ядре яйцеклетки, программа развития не срабатывает. Только в половых и эмбриональных стволовых клетках (они образуются на первых делениях оплодотворенной яйцеклетки) эпигенетические механизмы еще не включены, поэтому клетки могут дифференцироваться - стать и клеткой печени, и клеткой мозга, и клеткой кожи. Расшифровав структуру геномной ДНК, мы надеялись, что сможем управлять клеточными процессами. Однако выяснилось, что важна еще и эпигенетическая информация, но до ее полной расшифровки еще очень далеко.
Как реализуется “гистоновый код” в процессе включения-выключения генов? Что собой представляют белки, узнающие модифицированные концевые домены гистонов, какую функцию выполняют после узнавания хроматиновых маркировок? Точных ответов на эти вопросы пока нет.
Рассматриваются лишь возможные варианты. При модификации гистоновых “хвостов” меняется, как уже сказано, их суммарный заряд. За счет этого может, например, уменьшиться степень конденсации хроматиновой фибриллы (т.е. она сделается более рыхлой), и ДНК станет доступной для регуляторных белков. В этом случае ферменты-модификаторы только расширяют зону своего влияния, усиливают деконденсацию (или, наоборот, как гетерохроматиновый белок-1, делают фибриллу еще плотнее). В пользу такого хода событий свидетельствуют данные о белках с бромо- или хромодоменами; многие из подобных белков сами модифицируют гистоновые “хвосты” [6].
Еще один процесс, меняющий статус гена, осуществляют факторы перестройки хроматина. В 1992 г. этот механизм был впервые выявлен у дрожжей. В присутствии АТФ определенные белковые комплексы удаляли или сдвигали нуклеосомы с регуляторных участков ДНК, в результате чего активировались молчащие гены [7]. Оказалось, что в состав комплексов входят белки, имеющие бромо- и хромодомены. Благодаря их способности узнавать метильные и ацетильные метки на “хвостах” гистонов комплекс достигает регуляторного участка гена. Происшедшие вслед за тем структурные изменения хроматина облегчают доступ к ДНК белков, которые активируют транскрипцию этого гена [8].
Есть некоторые свидетельства того, что белки, узнающие “гистоновый код”, выполняют еще и транспортную функцию - доставляют к необходимым генам комплекс других, регуляторных, белков. Они проводят целый каскад биохимических реакций в области хроматина, соответствующей регуляторному участку гена. В состав комплекса входят как белки-модификаторы, так и транскрипционные факторы, которые тоже могут подвергаться разным модификациям, если это необходимо для активности.
Перестройки в хроматине затрагивают главным образом небольшие регуляторные области генов. Основная же часть ДНК, накрученная на нуклеосомы (хотя и модифицированные при активации генов), остается недоступной для молекул РНК-полимеразы, осуществляющей транскрипцию. Тем не менее этот нуклеосомный барьер преодолевается. Каким же образом? В нашей лаборатории 20 лет назад был разработан метод гибридизации с “белковыми тенями”, который позволяет понять, как открываются транскрипционные области ДНК [9]. По своей сути - это метод картирования мест в ДНК, где она контактирует с белковыми компонентами. Оказалось, что продвижение РНК-полимеразы обеспечивается структурным переходом в нуклеосомах: временно из них удаляются димеры Н2А-Н2В, а контакт гистонового тетрамера (Н3)2-(Н4)2 с ДНК сохраняется. Полимераза свободно проходит сквозь такую нуклеосому, после чего ее структура быстро восстанавливается. Эти данные соответствуют современным представлениям об организации нуклеосомы, согласно которым димер Н2А-Н2В в определенных условиях может исчезать [10].
Со структурными особенностями нуклеосомы связан еще один механизм изменения степени конденсации хроматина, а стало быть, и регуляции генной активности. Как уже неоднократно упоминалось, межнуклеосомные взаимодействия и распознавание хроматиновой фибриллы разными факторами определяются “хвостами” гистонов, выходящими на ее поверхность. Структуру хроматина можно нарушить модификацией “хвостов”, но равнозначный результат достигается заменой какого-либо гистона на его вариант, отличающийся последовательностью аминокислот в N-концевом участке молекулы.
Уже давно из клеток многих организмов и разных тканей одного и того же организма выделяли такие гистоновые варианты. У человека, например, известно как минимум пять вариантов Н2А [11]. Из них наиболее изучен H2AZ. Этот чрезвычайно консервативный гистон обнаружен у всех эукариот - от дрожжей до человека. От нормального гистона-2А он отличается аминокислотной последовательностью в домене, который ответствен за взаимодействие димера Н2А-Н2В с тетрамером (Н3)2-(Н4)2, а также заменами в N-концевой части полипептидной цепи. Поэтому суммарный заряд на “хвосте” изменен по сравнению с зарядом на обычном Н2А [11] и, как следствие, - изменены поверхностные свойства нуклеосомы, содержащей Z-вариант. В результате этого нарушается степень конденсации хроматина - он переходит в более рыхлое состояние, необходимое для активации генов. Без Z-варианта клетка жить не может - мутации по его гену всегда летальны.
Другой хорошо изученный вариант того же гистона-2А - Х-вариант. Его отличительная особенность - наличие фосфатной группы в одном из аминокислотных остатков на С-конце молекулы. Этой модификации гистон подвергается в ответ на двухцепочечный разрыв ДНК, вызванный ионизирующим излучением или другими причинами. Фосфорилированный Н2АХ моментально притягивает к себе комплекс белков, устраняющий дефект. Этот механизм используется клеткой не только при случайных повреждениях ДНК, вариант Н2АХ участвует в репарации естественно возникающих, нормальных для клетки разрывов ДНК. Такие разрывы происходят, например, во время созревания половых клеток, когда гомологичные хромосомы обмениваются участками; при выработке антител, чьи гены состоят из многих удаленных друг от друга фрагментов, которые должны быть вычленены из ДНК и затем воссоединены, и т.д.
В последние годы обнаруживаются все новые способы, которые меняют компактность хроматина, а следовательно, и активность генов. Видимо, в клетке “гистоновый код” распознается, считывается и переключается не единым механизмом, а комбинацией разных механизмов. Их поисками занимаются во многих лабораториях мира, и скорее всего в ближайшие годы нас ожидают очень интересные открытия.
Изучение эпигенетических процессов давно уже вышло за пределы фундаментальной науки и стало предметом исследований в медицине. Для этого есть немало оснований. Известно, например, что при онкологических заболеваниях и некоторых вирусных инфекциях нарушается свойственный нормальной клетке баланс между ацетилированием и деацетилированием гистонов. Так, аденовирусный онкобелок Е1А ингибирует активность гистоновой ацетилтрансферазы, и, следовательно, гистоны остаются без ацетильной метки. А коли так, то гистоновой деацетилазе, удаляющей эти метки, нечего делать, а ведь от ее взаимодействия с определенным белком зависит подавление роста клеток раковой опухоли. Еще один пример касается ретинобластомного белка (RB), который в норме синтезируется в сетчатке и многих других тканях. Если ген этого белка поврежден, образуется измененный RB, неспособный связываться с транскрипционным комплексом, а тот, будучи без RB, не может взаимодействовать с гистоновой деацетилазой. В результате молчащие в нормальной клетке гены начинают работать, что и приводит к онкопатологии. Такой ход событий выявлен при многих раковых заболеваниях. Более того, некоторые вирусные онкобелки способны целенаправленно блокировать взаимодействие нормального ретинобластомного белка с гистоновой деацетилазой [6].
Давно известно, что канцерогенез и старение сопровождаются отклонением от нормы в уровне и характере метилирования ДНК. Но связь этих процессов с посттрансляционными модификациями гистонов была выявлена всего два года назад. Оказалось, метилирование Lys-9 в гистоне-3 и метилирование ДНК взаимозависимы [12]. Иными словами, СН3-модификация ДНК определяется ее эпигенетическим выключением (т.е. метилированием гистоновых “хвостов”) в составе хроматина. Выключение генов, продукты которых подавляют раковые опухоли, и активация генов, необходимых для их роста, происходят одновременно. Расшифровка специфического эпигенетического “ракового кода” и “кода старения” на уровне метилирования ДНК имеет огромное практическое значение и уже сейчас может использоваться для диагностики онкологических заболеваний. Более того, правильно подобрав препараты, в идеале можно изменить “раковый код” и вернуть клетку к нормальному состоянию.
* * *
В последнее десятилетие взгляд на значение хроматина в считывании генетической информации, заложенной в ДНК, коренным образом изменился. Теперь хроматин представляется формой существования клеточного генома, на уровне которой действуют главные механизмы, программирующие развитие живого организма. Эти механизмы обусловлены структурно-функциональными особенностями нуклеосомы, гистонов, образующих ее сердцевину, межнуклеосомными взаимодействиями, тонко регулируемыми внешними сигналами. Именно на уровне нуклеосомы реализуется “гистоновый код”, служащий основой эпигенетической наследственности и играющий ключевую роль в управлении сложнейшим каскадом биохимических реакций в клетке. Эпигенетические механизмы обеспечивают сбалансированную работу необходимых генов любой специализированной клетки организма, благодаря чему он приспосабливается к изменяющимся условиям внешней и внутренней
среды. Сейчас иными видятся причины многих изменений, происходящих в клетке при патологических процессах, вирусных и других инфекциях, раковых заболеваниях и старении. Расшифровка “гистонового кода” помогла бы нам контролировать генетический потенциал, чтобы создавать новые породы домашних животных и сорта растений, находить более эффективные средства борьбы с болезнями и, наконец, продлевать здоровую жизнь человека.
Список литературы
1. Kornberg R.D. // Science. 1974. V.184. P.868-871.
2. Mirzabekov A.D., Shick V.V., Belyavsky A.V., Bavykin S.G. // Proc. Natl. Acad. Sci. USA. 1978. V.75. P.4184-4188.
3. Георгиев Г.П., Ченцов Ю.С. // Докл. АН СССР. 1960. №132. С.199-202.
4. Luger K., Mader A.W., Richmond R.K.et al. // Nature. 1997. V.389. P.251-260.
5. Jenuwein Th., Allis C.D. // Science. 2001. V.293. P.1074-1080.
6. Berger S.L., Felsenfeld G. // Molecular Cell. 2001. V.8. P.263-268.
7. Peterson C.L., Herskowitz I. // Cell. 1992. V.68. P.573-583.
8. Hayes J.J. // Nature Structural biology. 2002. V.9. P.161-163.
9. Karpov V.L., Preobrazhenskaya O.V., Mirzabekov A.D. // Cell. 1984. V.36. P.423-431.
10. Adelman K., Lis J.T. // Molecular Cell. 2002. V.9. P.451-457.
11. Redon Ch., Pilch D., Rogakou E., et al. // Current Opinion in Genetics and Development. 2002. V.12. P.162-169.
12. Jones P. // Oncogene. 2002. V.21. P.5358-5360.